曝气策略调控CANON工艺降温降基质稳定运行
谢弘超,王晓东,王伟刚,张 姚,史 勤,王亚宜
曝气策略调控CANON工艺降温降基质稳定运行
谢弘超,王晓东,王伟刚,张 姚,史 勤,王亚宜*
(同济大学环境科学与工程学院, 污染控制与资源化研究国家重点实验室,上海 200092)
通过调整曝气策略,研究了降温降基质(氨氮)运行过程中实现全程自养脱氮(CANON)序批式生物膜反应器(SBBR)稳定运行的可行性.结果表明,在中温(35℃)高基质[(446.47±43.77) mg NH4+-N/L]曝气/停曝=60min/60min条件下,反应器稳定运行223d,总氮去除负荷(TNRR)和总氮去除率(TNRE)分别为(0.49±0.07) kg N/(m3·d)和(84.3±4.6)%.温度降至20~23℃,根据一个运行周期内NO2--N积累速率和去除速率之比调整曝气工况为曝气/停曝=40min/80min,运行69d后TNRR和TNRE分别降至(0.43±0.04) kg N/(m3·d) 和 (69.5±5.7)%.而后逐步梯度降低基质至(105.6±16.1) mg NH4+-N/L,采用相同策略分别调整曝气/停曝时间为40min/80min、30min/90min和8min/32min,运行93d后TNRR降至(0.16±0.02) kg N/(m3·d),TNRE升至(71.5±7.5)%.高通量测序结果从群落组成角度证实了降温和降基质过程中实施的曝气调控策略维持了CANON系统脱氮功能菌的主导地位,亚硝酸盐氧化菌NOB相对丰度一直被控制在0.1%以下.
CANON;生物膜反应器;间歇曝气工况;温度;氨氮浓度;高通量测序
基于亚硝化的全程自养脱氮工艺(CANON)通过将短程硝化和厌氧氨氧化(Anammox)工艺耦合于一个反应器中以实现全程自养脱氮[1-2].参与这两个过程的功能菌分别为氨氧化菌(AOB)和厌氧氨氧化菌(AnAOB),均为自养型微生物[3].相比传统硝化反硝化脱氮工艺,CANON工艺节省约60%的曝气量,无需外加有机物且减少90%的污泥产量,极大降低污水处理能耗[4].目前CANON工艺主要适用于中温(如>30℃)高氨氮(如>100mg NH4+-N/L)废水处理,包括污泥消化液[5]和垃圾渗滤液[6-7]等,但其在市政污水处理的应用仍存在若干问题:(1)市政污水低氨氮浓度(30~100mg/L)[8]以及季节性温度波动(10~ 30℃),致使缺乏高游离氨(FA)、高游离亚硝酸(FNA)和中温条件对亚硝酸盐氧化菌(NOB)的抑制作用[9],维持稳定的短程硝化较为困难[10-11].(2)AnAOB 最适生长温度为30~40℃[12],降温会导致其活性显著降低[13-15],温度每降低5℃,其生长速率下降30~ 40%[2],并最终导致反应器失稳.这些问题极大限制了其在低温低基质(氨氮)的市政污水处理工艺中的应用.奥地利Strass污水处理厂利用水力旋流器分离污泥消化液自养脱氮处理系统中的AnAOB和AOB污泥,并将其补充到主流自养脱氮系统中,脱氮性能得到明显提升[16],但同时也增加了污水处理厂长期运行管理的复杂程度.
目前已有较多研究利用序批式生物反应器(SBR)成功启动了CANON工艺,并获得了良好的脱氮效果[17-19],且多推荐采用间歇曝气代替连续曝气模式来提升反应器脱氮稳定性[20-21],但不合理的间歇曝气工况往往会限制CANON优势的充分发挥[22]. 由于各研究中进水水质特征各异,致使提出的间歇曝气工况不具备普适性,因此急需完善和优化间歇曝气策略以实现CANON工艺的稳定运行.
另一方面,AnAOB对氧气十分敏感,超过0.5%空气饱和度就会对其活性产生抑制[23-26].因此当AnAOB与AOB共存于一个反应体系时,反应器内微生物需形成良好的生物膜生态位,即AOB分布于好氧表层,AnAOB分布于缺氧内层以缓解曝气过程溶解氧的抑制,同时利用基质扩散实现自养脱氮[27].由于生物膜(或颗粒污泥)具有微生物持留效果好的特性,尤其适用于富集AnAOB这类生长速率低、产率低的微生物[28].因此将生物膜应用于CANON工艺中可在富集培养两种功能菌的同时,减小溶解氧等不利因素对AnAOB的影响,并减少AnAOB的流失.
本研究在SBR中投加机械强度较高的聚乙烯(PE)环作为生物填料,在中温高基质(35℃,³300mg NH4+-N/L)条件下接种高活性CANON污泥,启动运行序批式生物膜反应器(SBBR).随后分阶段逐步降低反应器运行温度和基质水平,同时根据一个运行周期内曝气段NO2--N积累速率与停曝段NO2--N消耗速率之比进行曝气工况调整,以期实现降温降基质过程中自养脱氮系统的稳定运行,并结合不同阶段生物膜中微生物群落组成的数据,为CANON工艺在以低温低氨氮为特点的城市污水处理领域的应用推广提供指导依据.
1 材料与方法
1.1 实验装置与运行工况
SBBR实验装置为圆柱形有机玻璃容器,有效容积2.5L,设计换水比为50%.利用恒温循环水浴环控制反应器反应区温度,液位计控制进水量,自动出水球阀控制出水.装置内部设搅拌器,搅拌速度为150r/min.填料选用PE环(规格K3,密度0.97~ 1.03kg/m3,比表面积300~700m2/m3),串联后固定于反应器搅拌桨上部,以减少搅拌桨在进行混合搅拌时对填料挂膜的影响.填料填充率为40%.
反应器共运行385d.如表1所示,根据进水氨氮浓度和温度共分为3个阶段.其中阶段I代表中温高基质,阶段II代表常温高基质,阶段III代表常温低基质,同时,阶段III又根据曝气工况的不同分为A、B、C 3个小阶段.阶段I反应器运行周期初步设定为8h,其中进水10min,间歇曝气440min(曝气/停曝时间= 60min/60min,共3个曝停周期,最后缺氧搅拌80min),沉淀20min,出水3min,闲置7min.曝气阶段 DO浓度控制在1.0~1.2mg/L.在日常反应器维护中进行pH值和DO的实时监控,并及时做出工况调整.之后几个阶段则根据一个运行周期内曝气段NO2--N积累速率与停曝段NO2--N消耗速率之比进行曝气工况调整(表1).
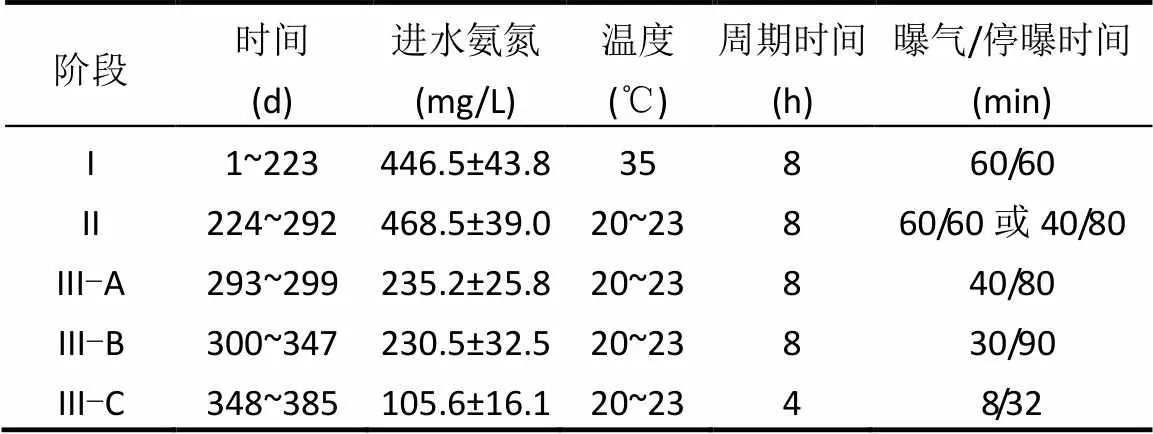
表1 反应器不同阶段的运行工况
1.2 接种污泥与实验用水
本实验接种2L已在30~33℃驯化成功的CANON活性污泥, 污泥呈现部分颗粒和部分絮体形态.接种后反应器MLSS=3538mg/L,MLVSS= 3166mg/L.实验用水为人工配制的高氨氮废水,进水pH值控制在8.0~8.2.基质浓度随反应器脱氮能力进行调整,其主要成分如下(g/L): NH4HCO3(按需配制), NaHCO3[按需配制, NH4+:HCO3-=1:2, (mol/L):(mol/ L)]; KH2PO4, 0.025; CaCl2, 0.3; MgSO4·7H2O, 0.3; FeSO4·7H2O, 0.00625; Na2EDTA, 0.00625.微量元素浓缩液1.5mL/L.
微量元素浓缩液包括(g/L): H3BO3,0.014; CoCl2·2H2O,0.24;CuSO4·5H2O,0.25;ZnSO4·7H2O, 0.43, MnCl2·4H2O, 0.99; NiCl2·6H2O, 0.19; NaMoO4·2H2O, 0.22; Na2WO4·2H2O, 0.050; Na2SeO4·10H2O,0.21; EDTA,15.
1.3 分析测试方法
1.3.1 常规指标检测及计算方法 常规水质指标NH4+-N、NO3--N、NO2--N以及SS/VSS的检测方法参考国家标准方法[29].DO使用WTW(Multi350i)DO测定仪监测.pH值使用WTW(Multi350i)pH值测定仪监测.
根据厌氧氨氧化代谢反应方程式[30]以及对一个运行周期内各氮素存在形式(NH4+-N, NO2--N, NO3--N)的测定,分别计算出反应器曝气过程AOB氨氧化速率(AOR)、NOB亚硝酸盐氧化速率(NOR)和曝气段同步脱氮负荷(NRRa),用以表征反应器的原位活性,并结合总氮去除负荷(TNRR) 和总氮去除率(TNRE),以反映反应器脱氮性能.其中NRRa还可通过表征曝气阶段AnAOB的活性进而反映生物膜中AnAOB生态位的稳定性.计算公式分别如下:
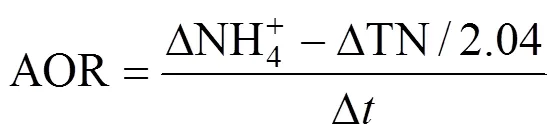
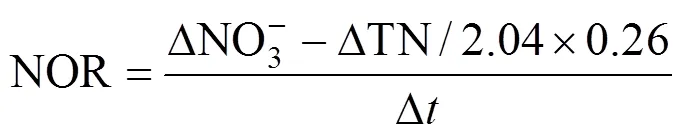
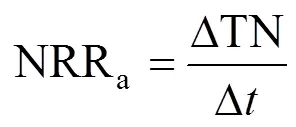
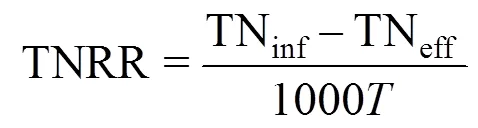
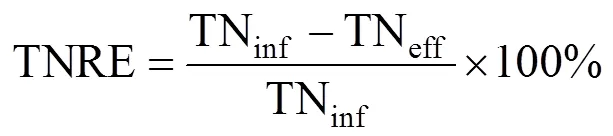
式中:△NH4+为曝气过程NH4+-N去除量总和,mg/L;△NO3-为曝气过程NO3--N生成量总和,mg/L;△TN为曝气过程总氮损失量总和,mg/L; △为一个运行周期内曝气段时间总和,h; TNinf为进水后反应初期反应器中的总氮浓度; TNeff为出水总氮浓度,mg/L;为一个周期的时间,d.AOR、NOR、NRRa单位均为g N/(m3·h), TNRR单位为kg N/(m3·d).
1.3.2 基于16S rDNA的Illumina平台高通量测序 在运行第31,220,290,385d分别从反应器中取出适量填料,依次标记为PE0, PE1, PE2, PE3.PE0代表中温高基质阶段启动接种污泥,PE1、PE2、PE3则分别对应中温高基质、常温高基质、常温低基质下稳定脱氮的生物膜.参考郑照明等[31]的方法对填料进行超声处理.随后采用漩涡混匀仪(Scilogex MX-F)对填料进行涡旋处理,时间为5min.收集脱落的生物膜存放于−20℃冰箱保存.待实验全部完成后将所有污泥样品送至上海美吉生物科技医药公司进行高通量分析测序.测序分析后,根据barcode序列区分各个样本的数据,进行嵌合体过滤,得到可用于后续分析的有效数据,即Clean reads.为了研究样品的物种组成多样性,对所有样品的Clean reads进行聚类,以97%的一致性(Identity)将序列聚类成OTUs (Operational Taxonomic Units),然后对OTUs的代表序列进行物种注释.
2 结果与讨论
2.1 中温高基质启动及稳定运行
如图1阶段I所示,反应器在接种CANON泥后在中温高基质条件下共运行223d,进水氨氮控制在(446.5±43.8)mg/L.在经历了前10d较低水平的脱氮[ 全周期总氮去除负荷TNRR=(0.14±0.08) kg N/ (m3·d)]后,迅速进入高效脱氮阶段并维持稳定,反应器总氮去除率TNRE稳定在(84.3±4.6)%,总氮去除负荷TNRR稳定在(0.49±0.07) kg N/(m3·d).
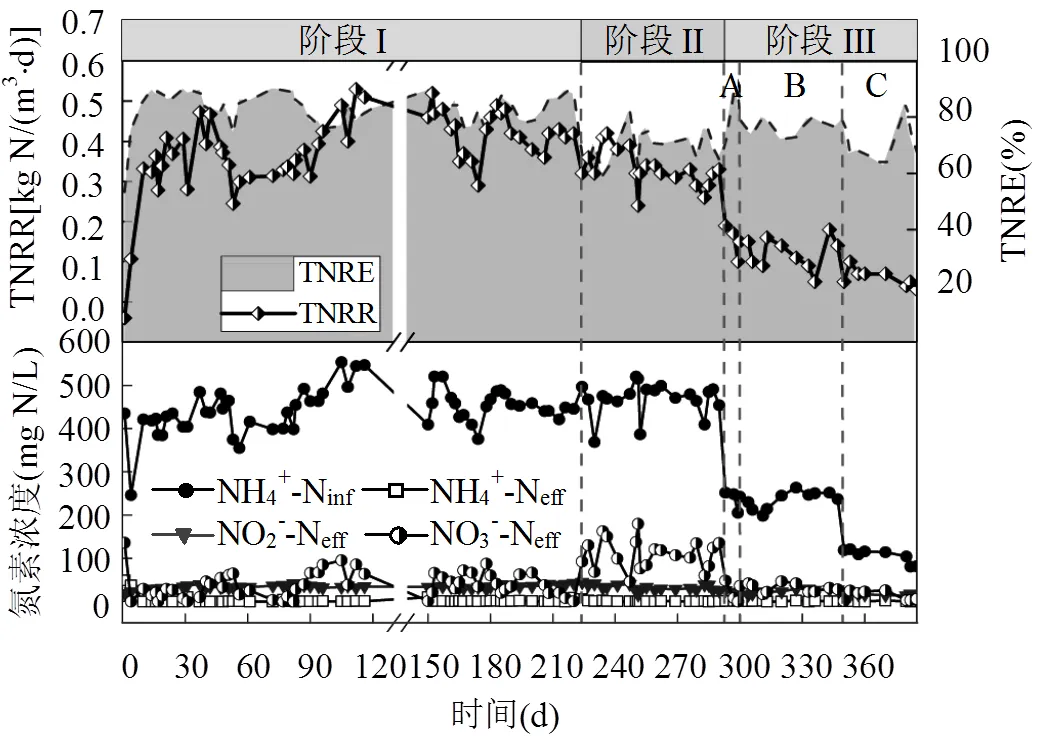
图1 不同温度和基质浓度下反应器长期脱氮效果
以第208d一个运行周期内脱氮情况及沿程pH值和DO变化(图2)为例.计算得该周期TNRR为0.52kg N/(m3·d),AOR为32.44g N/(m3·h), NRRa为32.21g N/(m3·h),而NOR则继续维持在0g N/(m3·h)左右.该周期中曝气段积累的NO2--N在停曝段被AnAOB完全反应,限制了下一个曝气阶段NOB的增殖,使反应器能在中温高基质下稳定运行,同时也为下一步降温做好了准备.
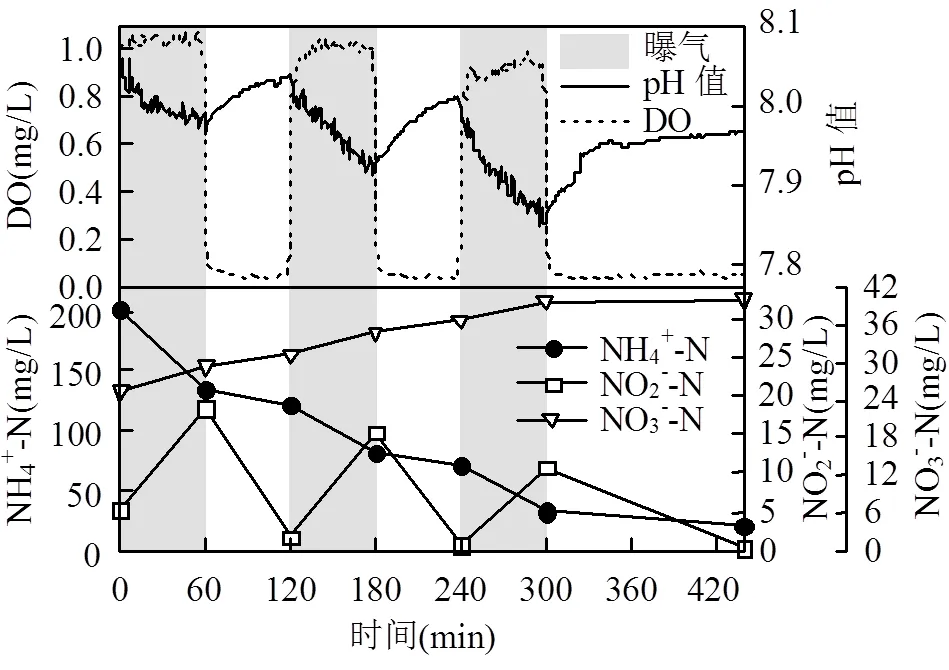
图2 中温高基质下SBBR第208d一个运行周期NH4+-N、NO2--N、NO3--N、pH值、DO的变化
2.2 常温高基质稳定运行
反应器温度直接降至20~23℃后共运行69d(图1阶段II).在采用合理的曝气工况调整策略后,反应器也获得了稳定的脱氮效果,出水NO2--N除降温第1d达到29.9mg/L,之后基本稳定在0mg/L,总氮去除负荷稳定在(0.43±0.04) kg N/(m3·d),总氮去除率为(69.5±5.7)%.
在反应器降温的第1个运行周期,继续采用曝气/停曝时间=60min/60min的工况进行试运行,结果如图3所示.推测一方面降温使生物膜中好氧微生物活性下降, DO在生物膜传质过程中消耗速率降低,穿透能力上升,生物膜好氧区扩大, 激发了生物膜内层AOB的活性,因而反应器曝气段AOR并未下降,计算得该周期AOR为36.36g N/(m3·h),略高出阶段I.但另一方面,DO穿透能力上升间接导致生物膜中AnAOB生态位被压缩,加之降温的影响, AnAOB活性明显受到抑制,NRRa仅为20.29g N/(m3·h),低于阶段I一个运行周期的32.21g N/(m3·h).这也使得60min曝气段NO2--N积累速率高达24.01g N/(m3·h),而60min停曝段的NO2--N去除负荷只有12.21g N/(m3·h),致使亚硝酸盐严重积累,NO2--N浓度最高达60.6mg/L,出水浓度达29.9mg/L.因此根据一个运行周期内NO2--N的积累速率和去除速率之比(24.01:12.21),调整反应器的曝气工况为曝气/停曝时间=40min/80min.
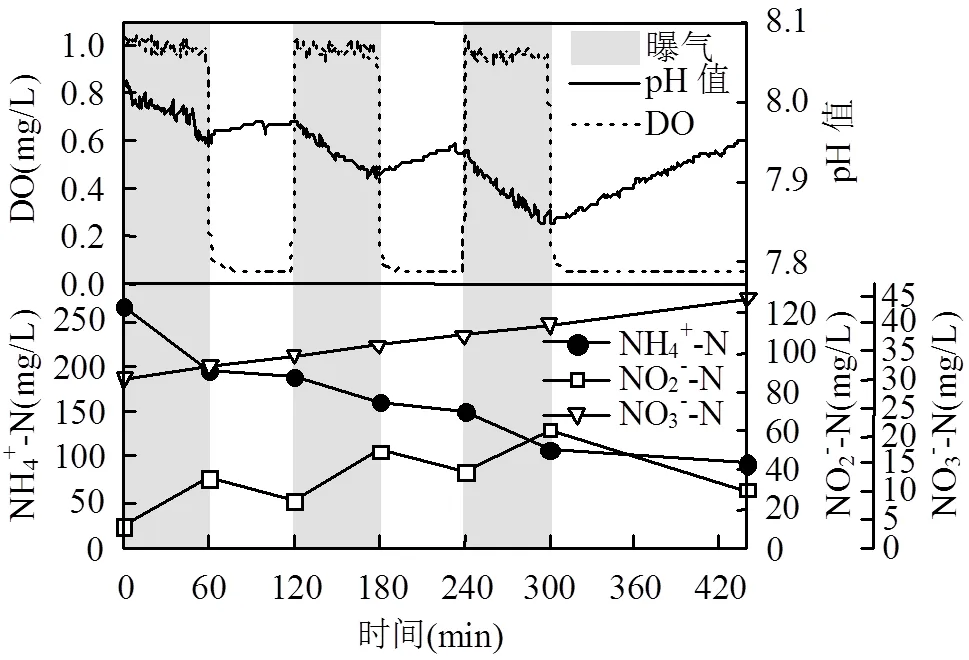
图3 常温高基质下SBBR第224d一个运行周期内NH4+-N、NO2--N、NO3--N、pH值、DO的变化
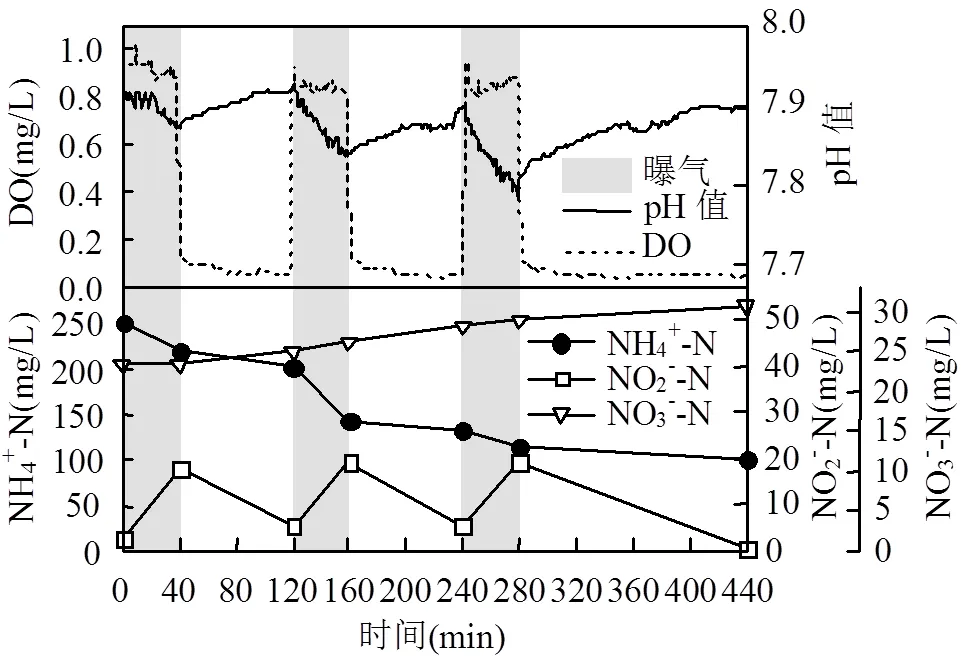
图4 常温高基质下SBBR第276d一个运行周期内NH4+-N、NO2--N、NO3--N、pH值、DO的变化
以调整曝气工况后第276d一个运行周期内脱氮情况及沿程pH值和DO变化(图4)为例.进水后反应器初始NH4+-N浓度250.6mg/L,出水NH4+-N为101.5mg/L,保证了FA对NOB的持续抑制.与曝气工况调整前相比,该周期AnAOB活性已经恢复,曝气段同步脱氮负荷NRRa回升至30.61g N/(m3·h).同时AOR升至38.10g N/(m3·h),而NOR则被抑制在0g N/(m3·h)左右.反应器TNRR为0.43kg N/(m3·d),未出现NO2--N和NO3--N的积累.由此可见,降温过程合理缩短曝气时间并未对反应器AOR产生不利影响,反而有利于生物膜中AnAOB的活性恢复.曝气工况的合理调整有利于生物膜抵御降温的影响,反应器在该温度条件下维持稳定运行,为下一步降基质做好了准备.
2.3 常温低基质稳定运行
如图1阶段III所示,进一步降低基质后,反应器共运行了93d.阶段III-A中反应器经历了第一个梯度的基质降低.进水NH4+-N降至(235.2±25.8)mg/L,但反应器仍维持在较高脱氮水平.TNRE升至 (82.8±10.7)%,相比阶段II有明显回升,并达到阶段I水平,TNRR则稳定在(0.25±0.04) kg N/(m3·d).但同时AnAOB活性也受到了一定的抑制,逐渐出现了亚硝酸盐的积累.Gilbert等[32]在利用PE填料启动常温低基质MBBR的时候遇到了同样的问题.因此在阶段III-B保持进水基质浓度,调整曝气工况为曝气/停曝时间=30min/90min,通过延长单个曝停周期中停曝时间以提高反应器脱氮能力.反应器稳定运行48d,TNRR为(0.22±0.04)kg N/(m3·d),TNRE为(76.9±2.9)%.在阶段III-C进行第2梯度的基质降低,进水NH4+-N降至(105.6±16.1) mg/L.为防止过度曝气,重新调整曝气工况为曝气/停曝时间=8min/ 32min,以维持反应器在常温低基质下的稳定脱氮.反应器在38d稳定运行过程中, TNRR为(0.16±0.02) kg N/(m3·d), TNRE稳定在 (71.5±7.5)%,未出现过度曝气的情况.
图5(a)中,在III-A运行周期内,进水NH4+-N为248.5mg/L,进水后反应器初始NH4+-N浓度为102.4mg/L,计算该周期TNRR为0.27kg N/(m3·d), TNRE为88.7%,AOR为24.87g N/(m3·h),NOR约为0,但曝气段亚硝酸盐积累速率:停曝段亚硝酸盐消耗速率=16.34g N/(m3·h):6.11g N/(m3·h) ,这使得反应器在40min:80min的曝停工况下无法将NO2--N反应完全,为NOB复苏留下隐患.因此延长单个曝停周期的停曝时间,使NOB在每次曝气开始时都处于低基质环境,如图5(b)所示.该周期中TNRR为0.25kg N/(m3·d),TNRE为75.3%,AOR为23.78g N/(m3·h), NOB未表现出活性.
反应器运行至阶段III-C,随着基质的进一步降低,阶段III-B的曝停工况已无法保证稳定脱氮,极易出现过量曝气的情况.因此缩短运行周期,并根据曝气段亚硝酸盐积累速率:停曝段亚硝酸盐消耗速率=13.71g N/(m3·h):3.76g N/(m3·h),最终确定反应器曝气工况为曝气/停曝时间=8min/32min(图5(c)),利用频繁曝停对NOB进行选择性抑制[16].在该运行周期中,TNRR为0.15kg N/(m3·d),TNRE为75.0%,AOR为17.37g N/(m3·h),而NOR为1.91g N/(m3·h),依旧维持在低水平,且未出现NO2--N的积累.反应器在常温低基质条件下达到了较理想的自养脱氮效果并维持稳定.
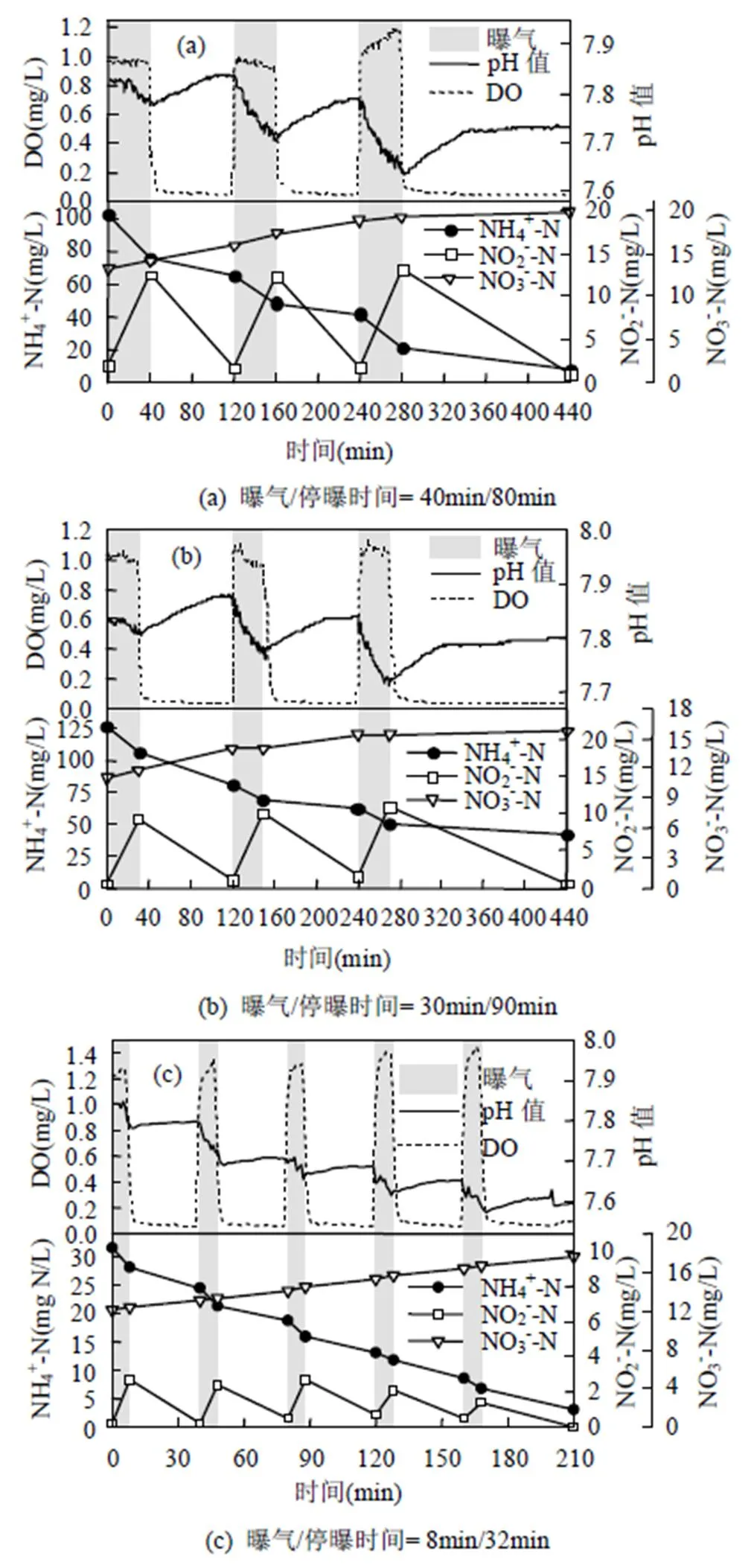
图5 不同曝气工况下SBBR一个运行周期NH4+-N、NO2--N、NO3--N、pH值、DO变化
2.4 微生物群落组成分析
从门、属两个水平分析反应器内微生物群落组成变化,结果分别如表2和图6所示.表2中4个生物膜样本中共检出38个菌门.其中相对丰度较高的5个菌门为变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)、绿菌门(Chlorobi)、绿弯菌门(Chloroflexi),在各个样本中均占据了80%以上.在这5种主要菌门中,变形菌门(Proteobacteria)和浮霉菌门(Planctomycetes)分别为CANON系统中AOB和AnAOB的所属菌门,且在每个生物膜样品中均占据了最大的相对丰度,其中浮霉菌门最高达42.61%,与报道的CANON脱氮系统中该菌门的相对丰度相近[33].推测在中温高基质条件下(PE0→PE1),随着无机环境的延续[34]、生物膜挂膜以及反应器中絮体逐渐外排[33],变形菌门相对丰度下降,而浮霉菌门则通过生物膜作用被截流下来.温度和基质的降低对其他菌门的胁迫作用逐渐减小[35-36],变形菌门和浮霉菌门所占比例随之减小,但依然占据着最大的相对丰度.
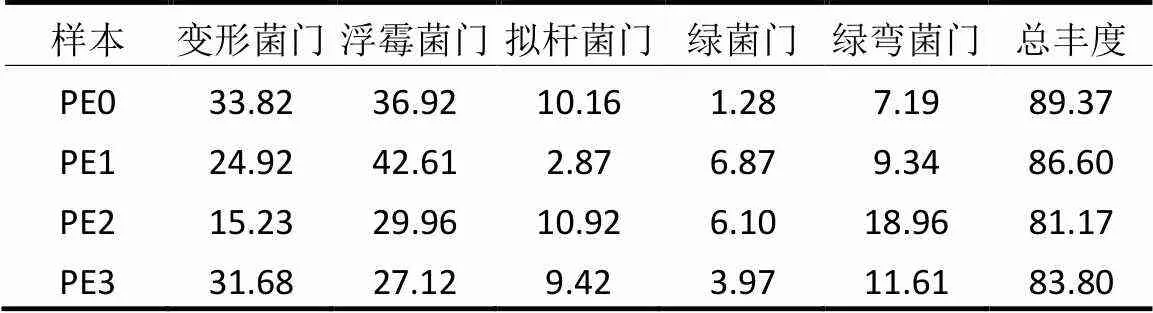
表2 各样本中主要菌门相对丰度(%)
图6a显示了在属分类水平上微生物群落组成变化.其中与CANON系统脱氮直接相关的菌属为Jettenia、Kuenenia、Brocadia以及.Jettenia、Kuenenia、Brocadia为3种AnAOB菌属[37],其中以Jettenia为主,在4个生物膜样品中相对丰度分别为25.93%, 28.02%,13.74%,12.96%.为AOB的一种菌属[38-39],其在4个生物膜样品中的相对丰度分别为16.89%、9.98%、2.65%、3.56%.而疑似为NOB的unidentified Nitrospiraceae在整个反应器运行过程中都只占有极小的相对丰度(£0.1%),这一结果从群落组成角度揭示了反应器在运行过程中几乎未出现全程硝化并保持很好的脱氮性能的生物学原因.
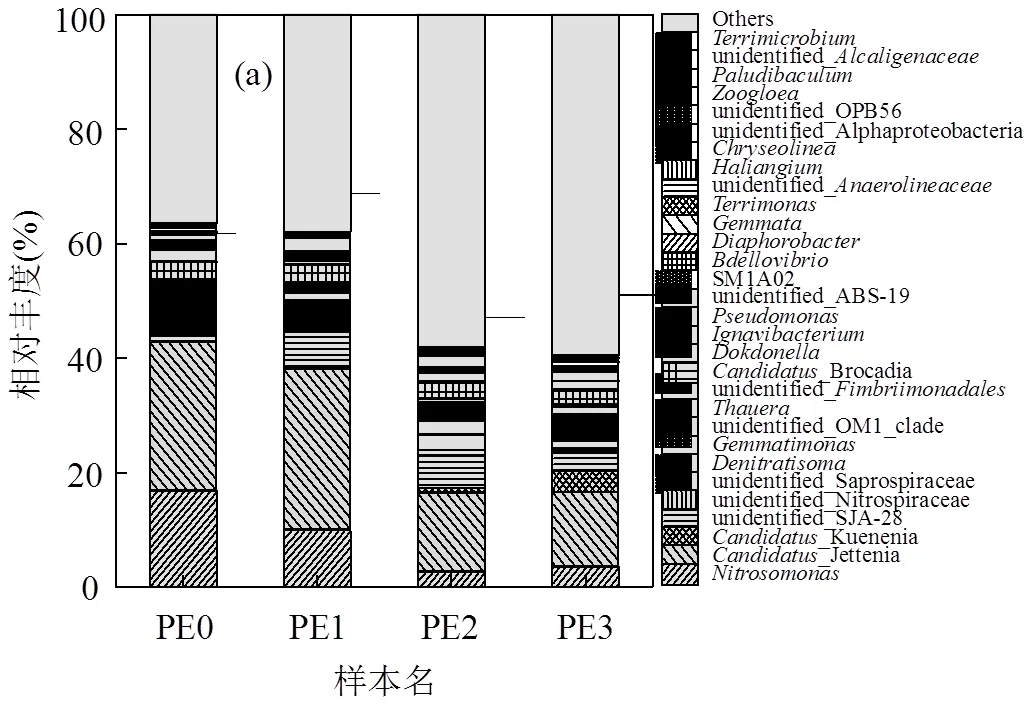
如图6b所示,将各样品中主要自养脱氮功能菌Jettenia、Kuenenia、Brocadia以及的相对丰度与相应工况阶段下反应器脱氮性能相结合,可以看出,脱氮功能菌相对丰度降低主要发生在降温阶段(PE1→PE2),与此同时TNRR也略有降低.而在降基质阶段(PE2→PE3) TNRR出现了显著降低,但该阶段除Kuenenia相对丰度显著增加外,其余功能菌相对丰度均未发生明显变化.Kuenenia被认为因具有更强的基质亲和力而在低基质环境中更具竞争优势[40-41].由此可见,降温对功能微生物相对丰度影响更大,但曝气工况的合理调整能很好地维持反应器自养脱氮性能的稳定,避免NO2--N的积累和NOB的复苏.而降基质阶段由于进水负荷的限制,致使AOR和TNRR显著下降,但除对基质亲和力更强的Kuenenia相对丰度有所增加外,其余功能菌相对丰度变化不大.反应器TNRE维持在70%左右,自养脱氮性能依旧保持稳定,未出现向全程硝化转变的趋势.
3 结论
3.1 SBBR反应器在中温(35℃)高基质[(446.5± 43.8) mg NH4+-N/L]曝气/停曝=60min/60min条件下稳定运行223d,总氮去除负荷(TNRR) 和总氮去除率(TNRE)分别为(0.49±0.07) kg N/(m3·d)和(84.3± 4.6)%.
3.2 温度降至20~23℃,根据一个运行周期内NO2--N积累速率和去除速率之比调整曝气工况为曝气/停曝=40min/80min, 避免了NO2--N的积累.反应器运行69d后TNRR和TNRE分别降至(0.43±0.04) kg N/(m3·d)和(69.5±5.7)%.
3.3 分3个阶段逐步降低基质至(105.6±16.1) mg NH4+-N/L,采用相同策略分别调整曝气/停曝时间为40min/80min、30min/90min和8min/32min,反应器运行93d后TNRR降至(0.16±0.02) kg N/(m3·d),TNRE升至(71.5±7.5)%.
3.4 16S rDNA高通量测序结果表明,样品中自养脱氮功能微生物始终占据主导地位.AnAOB主要有Jettenia、Kuenenia、Brocadia 3个属,AOB主要为.脱氮功能菌相对丰度降低主要发生在降温阶段,但依旧占据主导地位,反应器TNRR仅略有下降.降基质阶段由于进水负荷的限制影响了反应器总氮去除负荷,但未威胁AOB和AnAOB的优势地位,对基质亲和力更强的Kuenenia相对丰度甚至有所增加.生物膜中NOB相对丰度则一直被抑制在0.1%以下.
[1] 郑 平,徐向阳,胡宝兰.新型生物脱氮理论与技术 [M]. 北京:北京科学出版社, 2004. Zheng P, Xu X, Hu B. New biological nitrogen removal theoryand technology [M]. Beijing: Science Press, 2004.
[2] Strous M, Kuenen J G, Jetten M S M. Key Physiology of Anaerobic Ammonium Oxidation [J]. Applied & Environmental Microbiology, 1999,65(7):3248-3250.
[3] Graaf A A v d. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor [J]. Microbiology, 1996, 142(8):2187-2196.
[4] Schaubroeck T, Clippeleir H D, Weissenbacher N, et al. Environmental sustainability of an energy self-sufficient sewage treatment plant: Improvements through DEMON and co-digestion [J]. Water Research, 2015,74:166-179.
[5] Joss A, Salzgeber D, Eugster J, et al. Full-scale nitrogen removal from digester liquid with partial nitritation and anammox in One SBR [J]. Environmental Science & Technology, 2009,43(14):5301-5306.
[6] Shalini S S, Joseph K. Nitrogen management in landfill leachate: Application of SHARON, ANAMMOX and combined SHARON– ANAMMOX process [J]. Waste Management, 2012,32(12):2385- 2400.
[7] Helmer C, Kunst S, Juretschko S, et al. Nitrogen loss in a nitrifying biofilm system [J]. Water Science & Technology, 1999,39(7):13-21.
[8] Metcalfeddy I, Tchobanoglous G, Stensel H D. Wastewater engineering : treatment and reuse [J]. McGraw-Hill Series in Water Resources and Environmental Engineering), 2003,73(1):50-51.
[9] 张肖静,李 冬,梁瑜海,等.氨氮浓度对CANON工艺性能及微生物特性的影响 [J]. 中国环境科学, 2014,34(7):1715-1721. Zhang X, Li D, Liang Y, et al. Effect of ammonia concentration on the performance and microbial characteristics of CANON process [J]. China Environmental Science, 2014,34(7):1715-1721.
[10] 李 冬,赵世勋,王俊安,等.污水处理厂CANON工艺启动策略 [J]. 中国环境科学, 2017,37(11):4125-4131. Li D, Zhao S, Wang J, et al. Startup strategies of CANON process in wastewater treatment plant [J]. China Environmental Science, 2017, 37(11):4125-4131.
[11] 李 冬,赵世勋,关宏伟,等.常温低氨氮CANON工艺稳定性研究 [J]. 中国环境科学, 2017,37(1):102-107. Li D, Zhao S, Guan H, et al. Stable operation of CANON process at normal temperature and low ammonia concentration [J]. China Environmental Science, 2017,37(1):102-107.
[12] Egli K, Fanger U, Alvarez P J J, et al. Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate [J]. Archives of Microbiology, 2001,175(3): 198-207.
[13] Dosta J, Fernández I, Vázquez-Padín J R, et al. Short- and long-term effects of temperature on the Anammox process [J]. Journal of Hazardous Materials, 2008,154(1):688-693.
[14] Isaka K, Date Y, Kimura Y, et al. Nitrogen removal performance using anaerobic ammonium oxidation at low temperatures [J]. Fems Microbiology Letters, 2010,282(1):32-38.
[15] Vázquez-Padín J R, Fernández I, Morales N, et al. Autotrophic nitrogen removal at low temperature [J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2011,63(6):1282.
[16] Wett B, Omari A, Podmirseg S M, et al. Going for mainstream deammonification from bench to full scale for maximized resource efficiency [J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2013,68(2): 283.
[17] Hippen A, Rosenwinkel K H, Baumgarten G, et al. Aerobic deammonification: A new experience in the treatment of waste waters [J]. Water Science & Technology, 1997,35(10):111-120.
[18] Zhang L, Zhang S, Peng Y, et al. Nitrogen removal performance and microbial distribution in pilot- and full-scale integrated fixed-biofilm activated sludge reactors based on nitritation-anammox process [J]. Bioresource technology, 2015,196:448-453.
[19] Xu Z Y, Zeng G M, Yang Z H, et al. Biological treatment of landfill leachate with the integration of partial nitrification, anaerobic ammonium oxidation and heterotrophic denitrification [J]. Bioresource technology, 2010,101(1):79-86.
[20] 刘 涛.基于亚硝化的全程自养脱氮工艺(CANON)效能及微生物特征研究 [D]. 哈尔滨:哈尔滨工业大学, 2013. Liu T. The efficiency and microbial characteristics of the whole autotrophic denitrification process (CANON) based on nitrosation [D]. Harbin: Harbin Institute of Technology, 2013.
[21] 李 冬,李晓莹,杨 杰,等.SBR中不同曝气方式下CANON工艺的启动与运行 [J]. 哈尔滨工业大学学报, 2017,46(9):109-116. Li D, Li X, Yang J, et al. Start-up and long term operation of CANON in sequencing batch reactor with different aeration patterns [J]. Journal of Harbin Institute of Technology, 2017,46(9):109-116.
[22] Corbalá-Robles L, Picioreanu C, Van Loosdrecht M C, et al. Analysing the effects of the aeration pattern and residual ammonium concentration in a partial nitritation-anammox process [J]. Environmental Technology, 2016,37(6):694-702.
[23] Strous M, Gerven E V, Kuenen J G, et al. Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing (anammox) sludge [J]. Appl. Environ. Microbiol., 1997,63(6):2446- 2448.
[24] Graaf A A v d. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor [J]. Microbiol, 1996, 142(8):2187-2196.
[25] Schmidt I, Sliekers O, Schmid M, et al. Aerobic and anaerobic ammonia oxidizing bacteria–competitors or natural partners [J]. Fems Microbiology Ecology, 2002,39(3):175-181.
[26] 张 姚,韩海成,王伟刚,等.溶解氧对CANON颗粒污泥自养脱氮性能的影响 [J]. 中国环境科学, 2017,37(12):4501-4510.
[27] Siegrist H, Reithaar S, Lais P. Nitrogen loss in a nitrifying rotating contactor treating ammonium rich leachate without organic carbon [J]. Water Science and Technology, 1998,37(4/5):589-591.
[28] 张 彤,曹国民,赵庆祥.固定化微生物脱氮技术进展 [J]. 城市环境与城市生态, 2000,(2):17-20. Zhang T, Cao G, Zhao Q. Progress of immobilized microbial denitrification technology [J]. Urban Environment and Urban Ecology, 2000,(2):17-20.
[29] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京中国环境科学出版社, 2002. Editorial Board of the State Environmental Protection Administration of China "Water and Wastewater Monitoring and Analysis Method". Water and wastewater monitoring and analysis method (4th edition) [M]. China Environmental Science Press, 2002.
[30] Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Applied Microbiology & Biotechnology, 1998,50(5):589-596.
[31] 郑照明,李 军,杨京月,等.SNAD工艺在不同间歇曝气工况下的脱氮性能 [J]. 中国环境科学, 2017,37(2):511-519. Zheng L, Li J, Yang J, et al. Nitrogen removal performance of the SNAD process under different intermittent aerobic conditions [J]. China Environmental Science, 2017,37(2):511-519.
[32] Gilbert E M, Agrawal S, Karst S M, et al. Low Temperature Partial Nitritation/Anammox in a Moving Bed Biofilm Reactor Treating Low Strength Wastewater [J]. Environmental Science & Technology, 2014, 48(15):8784-8792.
[33] Chu Z R, Wang K, Li X K, et al. Microbial characterization of aggregates within a one-stage nitritation–anammox system using high-throughput amplicon sequencing [J]. Chemical Engineering Journal, 2015,262:41-48.
[34] 熊 蕾.Anammox反应器的启动运行及Mn(Ⅱ)的作用特性研究 [D]. 长沙:中南大学, 2014. Xiong L. The start-up operation of Anammox reactor and the action characteristics of Mn(II) [D]. Changsha: Central South University, 2014.
[35] Zhang X, Li D, Liang Y, et al. Performance and microbial community of completely autotrophic nitrogen removal over nitrite (CANON) process in two membrane bioreactors (MBR) fed with different substrate levels [J]. Bioresource technology, 2014,152(1):185-191.
[36] Liu T, Li D, Zhang J, et al. Effect of temperature on functional bacterial abundance and community structure in CANON process [J]. Biochemical Engineering Journal, 2016,105:306-313.
[37] Ali M, Okabe S. Anammox-based technologies for nitrogen removal: Advances in process start-up and remaining issues [J]. Chemosphere, 2015,141:144-153.
[38] Bagchi S, Biswas R, Nandy T. Autotrophic Ammonia Removal Processes: Ecology to Technology [J]. Critical Reviews in Environmental Science and Technology, 2012,42(13):1353-1418.
[39] Kouba V, Vejmelkova D, Proksova E, et al. High-Rate Partial Nitritation of Municipal Wastewater after Psychrophilic Anaerobic Pretreatment [J]. Environmental Science & Technology, 2017,51(19): 11029-11038.
[40] Ding, Shuang, Zheng, et al. Ecological characteristics of anaerobic ammonia oxidizing bacteria [J]. Applied Microbiology & Biotechnology, 2013,97(5):1841-1849.
[41] Wrl V D S, Miclea A, Van Dongen U, et al. The membrane bioreactor: A novel tool to grow anammox bacteria as free cells [J]. Biotechnology & Bioengineering, 2010,101(2):286-294.
Stable operation of CANON system during temperature and substrate decreasing process via aerobic regime adjustment.
XIE Hong-chao, WANG Xiao-dong, WANG Wei-gang, ZHANG Yao, SHI Qin, WANG Ya-yi*
(State Key Laboratory of Pollution Control and Resources Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China)., 2019,39(7):2781~2788
The feasibility of the stable operation of a sequencing biofilm batch reactor (SBBR) for completely autotrophic nitrogen removal over nitrite (CANON) was investigated using aeration condition adjusting strategy, along with decreasing temperature and influent substrate (anammonia). The SBBR operated steadily for 223 days at 35°C and high substrate [(446.47±43.77) mg NH4+-N/L] with the aeration regime of aeration/non-aeration=60min/60min; the total nitrogen removal rate (TNRR) and total nitrogen removal efficiency (TNRE) reached (0.49±0.07) kg N/(m3·d) and (84.3±4.6)%, respectively. After temperaute decreasd to 20~23°C, the intermittent aerobic condition was changed to aeration/non-aeration=40min/80min based on the ratio of NO2--N accumulation rate to NO2--N removal rate in the single-cycles. The TNRR and TNRE decreased to (0.43±0.04) kg N/(m3·d) and (69.5±5.7)% for 67days of operation, respectively. With gradual decreasing ammonia to (105.6±16.1) mg NH4+-N/L, the aeration/non-aeration time was regulated to 40min/80min, 30min/90min and 8min/32min in sequence. For 67days operation, the TNRR decreased to (0.16±0.02) kg N/(m3·d); nevertheless, the TNRE increased to (71.5±7.5)%. High-throughput sequencing results confirmed that the regulation strategy applied herein ensured the dominance of nitrogen removal functional bacterias in CANON system during decreasing temperature and substrate while the relative abundance of nitrite oxidizing bacteira was always below 0.1%.
CANON;biofilm reactor;intermittent aerobic conditions;temperature;ammonium concentration;high-throughput sequencing
X703.5
A
1000-6923(2019)07-2781-08
谢弘超(1995–),男,江西吉安人,同济大学硕士研究生,主要从事污水生物处理理论与应用研究.
2018-12-04
国家自然科学基金资助项目(51522809)
* 责任作者, 教授, yayi.wang@tongji.edu.cn

