癌基因HuR调节胃癌功能的研究*
曹小梅, 曹楠婧, 王福花, 孙瑞芳, 李 峰△, 郭素堂△
(1山西医科大学生物化学与分子生物学教研室, 山西 太原 030001; 2山西省肿瘤研究所分子生物室, 3山西省肿瘤医院样本库, 山西 太原 030013)
胃癌是全球高发的恶性肿瘤之一,其死亡率在男性肿瘤死亡率中排第3位,在女性肿瘤死亡率中排第5位。虽然胃癌的全球发病率在下降,但亚洲的发病率仍然很高[1],尤其是中国,是胃癌发病率最高的国家之一,每年新增胃癌患者约40万人,占全世界的40%以上[2]。但我们对胃癌的发生发展机制还需更深刻的了解。
随着医疗技术的发展,研究者发现RNA结合蛋白(RNA binding protein,RBP)的表达和代谢异常与多种肿瘤的发生发展相关[3]。RBP能够调控mRNA的表达改变,并与其相关联形成高度动态的核糖核蛋白(ribonucleoprotein,RNP)复合物,在转录后转化或降解转录蛋白,从而在维持细胞基因表达稳态中起着关键作用,以防止蛋白质的异常合成从而导致疾病的产生[4]。高通量测序技术的应用使研究者在在多种人类肿瘤,如胃癌[5]、乳腺癌[6]、宫颈癌[7]、前列腺癌[8]和结直肠癌[9]等中筛选出表达异常的RBP,这些RBP通过与不同分子的相互作用调节细胞的增殖、凋亡、迁移和侵袭。
人抗原R(human antigen R,HuR)属于果蝇胚胎致死异常视觉(embryonic lethal abnormal vision, ELAV)家族的RBP。我们的研究发现,HuR在胃癌组织中整体表达上调,提示HuR有可能通过调节肿瘤相关的基因表达从而参与肿瘤的发生发展过程。而HuR在胃癌细胞中如何发挥调控作用,以及如何参与胃癌的发生发展还未见详细报道,因此,本实验通过研究HuR的表达,探索其对胃癌细胞功能的影响,从而在胃癌患者中找到新的诊断或治疗思路。
材 料 和 方 法
1 主要材料
胃癌MGC-803细胞系(ATCC)。胃癌组织及癌旁组织80例(>4 cm)取自山西省肿瘤医院生物样本库,源于临床确诊的胃癌患者。 LipoFiterTM转染试剂(Life Technology);胰蛋白酶(索莱宝); GAPDH和pSIH质粒(北京瑞博泰克); DMEM高糖培养基和胎牛血清(HyClone); RNA提取试剂盒(TaKaRa);反转录试剂盒(天根); Transwell小室(BD)。用DNAMAN 6.0设计引物,并由天一辉远生物科技有限公司合成。
2 方法
2.1细胞培养与转染 胃癌MGC-803细胞系用含10%胎牛血清的DMEM高糖培养基于37 ℃、5% CO2恒温箱中培养,等贴壁生长75%~85%汇合率时,用胰蛋白酶进行消化并传代。细胞在转染前1 d转到6孔板,加入含10%胎牛血清的DMEM高糖培养,在37 ℃、5% CO2恒温箱中培养,第2天观察细胞汇合度达到75%~85%时进行转染,然后37 ℃、5% CO2恒温箱中培养36~48 h。
2.2RNA提取、逆转录及RT-qPCR TRIzol法提取组织细胞总RNA,紫外分光光度仪测定RNA浓度和纯度。通过逆转录酶合成cDNA并扩增,以GAPDH为内参照,扩增设3个复孔。HuR的正向引物序列为5’-AACATGACCCAGGATGAGTTA-3’,反向引物序列为5’-TCCAGTGCAGGGTCCGAGGT-3’;GAPDH的正向引物序列为5’-ACCACAGTCCATGCCATCAC-3’,反向引物序列为5’-TCCACCACCCTGTTGCTGTA-3’。
2.3细胞功能实验 使用对照(si-control)组及敲低(si-HuR)组转染MGC-803细胞,48 h后,胰酶消化制备细胞悬液,按照每孔1×103细胞密度种植于96孔板中,每组3个复孔,检测前3 h每孔加入10 μL CCK-8,并将在37 ℃、5% CO2培养箱内孵育3 h后,用酶标仪测定在450 nm处的吸光度(A)值,检测其对细胞活力的影响;细胞转染48 h后,胰酶消化制备细胞悬液,按照每孔8×105细胞密度种植于6孔板中,每组3个复孔(种植前用marker笔在6孔板背后,用直尺每隔0.5~1 cm均匀划3~5条横线),等第2天细胞接近铺满6孔板时,用200 μL枪头垂至于背后横线划痕,用PBS洗涤细胞3次,去除划痕产生的细胞碎片,加入无血清培养基,放入37 ℃,5% CO2培养箱培养,0、36和72 h后显微镜50 μm下观察并拍照,检测其对细胞迁移能力的影响;细胞转染48 h后,胰酶消化制备细胞悬液,按照每孔2×105细胞密度种植于Transwell小室中,小室中细胞悬液总体积为400 μL无血清的DMEM培养基,下室为600 μL含10%胎牛血清的DMEM培养基,继续培养24 h后,用棉签浸润PBS,擦去小室内的细胞,PBS洗2遍,倒置小室,将膜风干约20 min,将小室置于干净24孔板,加入1 mL多聚甲醛固定约10 min后将小室取出晾干,加1 mL 1%结晶紫染色约10 min,显微镜下拍照计数。
3 统计学处理
实验数据以均数±标准差(mean±SD)表示,采用SPSS 16.0 统计软件进行方差齐性检验和方差分析,以P<0.05为差异有统计学意义。
结 果
1 HuR在胃癌样本中表达整体上调
RT-qPCR检测了80例胃癌患者中癌旁组织(>4 cm)和胃癌组织中HuR的表达水平,结果表明,与癌旁组织相比, 67例(84%)胃癌组织HuR表达上调,13例(16%)胃癌组织中HuR表达下调,见图1。
2 敲减HuR表达能显著抑制MGC-803细胞的活力
MGC-803细胞转染si-control和si-HuR后,通过RT-qPCR检测其表达水平,证明成功敲减HuR的表达,见图2。分别在0、24、48和72 h检测细胞活力,结果显示,敲减HuR表达能显著抑制胃癌MGC-803细胞的活力,见图3。

Figure 1.The mRNA expression of HuR in 80 cases of gastric cancer tissues and paired adjacent tissues detected by RT-qPCR analysis. Relative expression value = expression value of the same pair of sample cancer tissues-expression of adjacent tissues.
图1 80例胃癌组织及其癌旁组织中HuR的相对表达

Figure 2.The mRNA expression of HuR in MGC-803 cells transfected with si-HuR detected by RT-qPCR. Mean±SD.n=3.**P<0.01vssi-control group.
图2 RT-qPCR检测转染后HuR在MGC-803细胞中的表达
3 敲减HuR表达能抑制肿瘤细胞的迁移能力
MGC-803细胞转染si-control和si-HuR后,通过划痕实验显示,敲减HuR表达能抑制MGC-803细胞的迁移能力(P<0.01),见图4。
4 敲低HuR能抑制肿瘤细胞的侵袭能力
MGC-803细胞转染si-control和si-HuR后,通过Transwell实验显示,敲减HuR表达能抑制肿瘤的侵袭能力(P<0.01),见图5。
讨 论
本实验通过RT-qPCR分析了80例临床确诊的胃癌患者中癌组织及癌旁组织中HuR的表达,结果发现在67例胃癌组织中HuR的表达水平明显上调,13例胃癌组织中表达下调,可能跟胃癌的发展及临
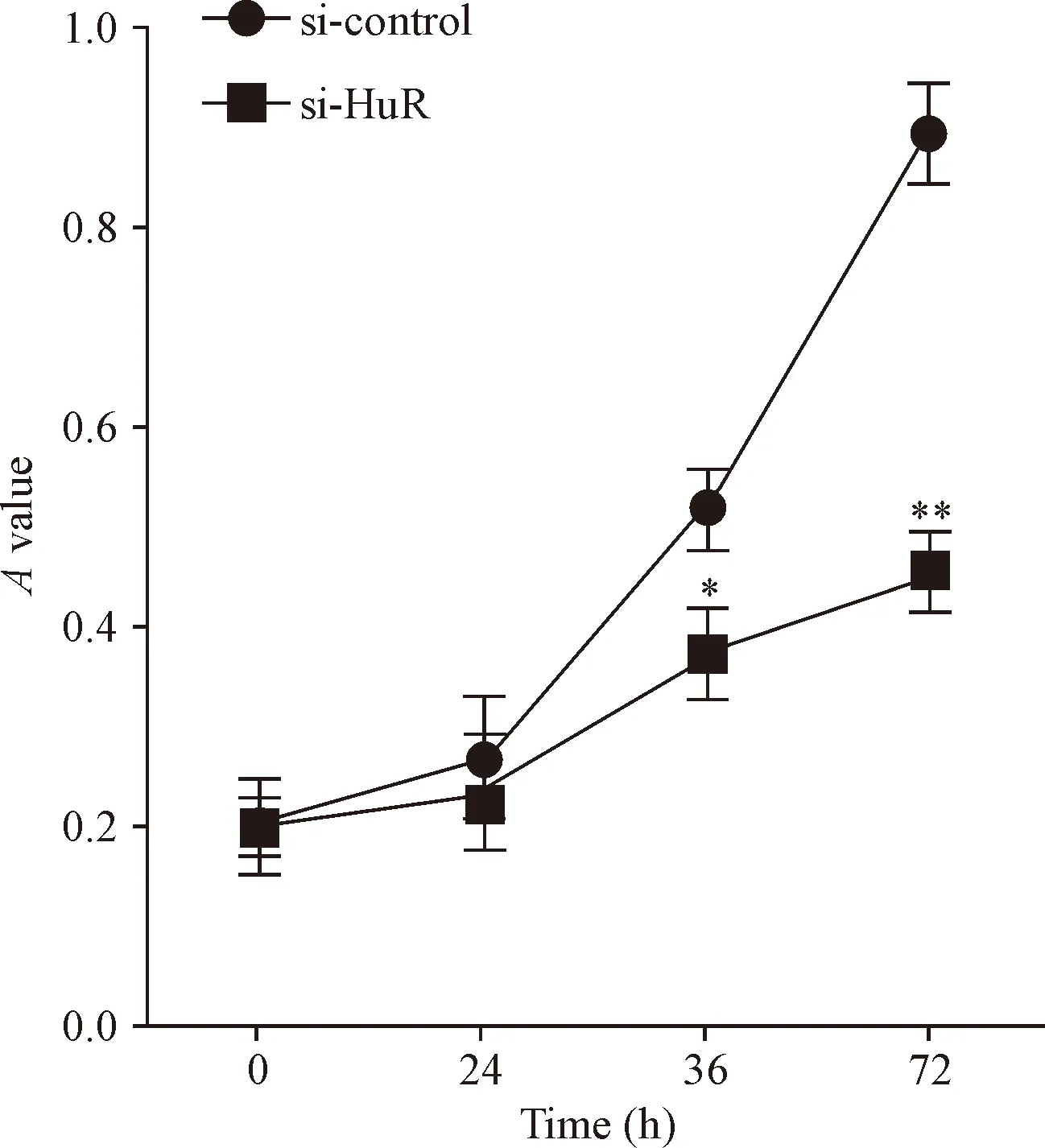
Figure 3.The viability of MGC-803 cells transfected with si-HuR and si-control measured by CCK-8 assay. Mean±SD.n=3.*P<0.05,**P<0.01vssi-control group.
图3 CCK-8检测转染后MGC-803细胞活力的变化
床分期分型有关,我们通过临床诊断及病理报告发现,67例胃癌患者为腺癌II~III级,13例胃癌患者中,12例为腺癌I级,1例为腺癌II级,我们推测,HuR可能作为癌基因在胃癌的发生发展中起调控作用,随着胃癌的进展HuR表达逐渐升高。通过在胃癌细胞MGC-803中转染si-HuR、si-control及功能实验发现,下调HuR能抑制肿瘤的增殖、迁移和侵袭能力。
目前有大量临床证据表明HuR可能与一些癌症的恶性转化过程、临床病理参数有关[10]。在口腔癌中,游离的HuR表达与患者的性别、肿瘤分级和转移相关[11]。此外,HuR表达上升与肿瘤大小、疾病分期和食管癌淋巴侵袭存在明显相关性[12]。研究发现,在淋巴和血管侵犯的晚期肺癌患者中,HuR表达增加[13]。在淋巴管侵犯的宫颈癌患者中,也能明显观察到HuR表达升高[14]。在胆囊癌中,HuR表达与肿瘤的大小、分级以及血管、神经周围的侵袭存在正相关[15]。研究还发现,细胞质中HuR表达模式是口腔、食管、胃、胆囊、肾、尿路上皮、肺、乳腺和卵巢癌患者存活的不良预后因子[10]。而且在胰腺导管癌中,细胞质HuR表达与吉西他滨治疗患者的良好预后密切相关。对于大部分表达异常的HuR,其研究结论与本课题的结果一致,但其可能的作用及与其他基因间的相互关系尚无深刻报道,然而,本实验研究显示HuR在67%的胃癌病人中表达上调,而且与肿瘤细胞的增殖、转移和侵袭相关,更进一步地说明,HuR在胃癌发生发展过程中的重要作用,能够为HuR的临床靶向治疗提供一定的实验依据。我们通过生物信息分析及预测发现, HuR可能靶向结合miR-133a和miR-133b,参与mTOR-PI3K/Akt信号通路,诱导肿瘤细胞的增殖,我们会通过实验进一步确定。

Figure 4.The wound healing assay of MGC-803 cells transfected with si-HuR and si-control. The scale bar=500 μm. Mean±SD.n=3.**P<0.01vssi-control group.
图4 划痕实验检测转染对MGC-803细胞的迁移能力的影响
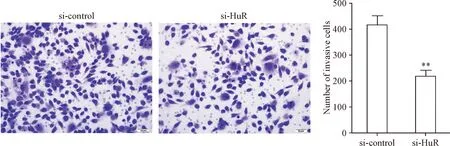
Figure 5.Transwell analysis of MGC-803 cells transfected with si-HuR and si-control. The scale bar=100 μm. Mean±SD.n=3.**P<0.01vssi-control group.
图5 Transwell 实验检测转染对MGC-803细胞侵袭能力的影响
综上所述,本研究的证据表明HuR可能与人胃部肿瘤的恶性状态相关,可作为潜在的新的靶标[16]。由于目前样本数量相对较少,样本分期数量不够,还需要其它进一步研究才能得到证实。
- 中国病理生理杂志的其它文章
- 《中国病理生理杂志》第七届编辑委员会
- 人参皂苷Rb1对高脂血症大鼠肝脏细胞焦亡的影响及其可能机制*
- 杜鹃素通过增强Kv1.5和Kv2.1表达抑制尼古丁所致的肺动脉平滑肌细胞增殖*
- 合欢皮乙醇提取物通过调控NF-κB通路减轻四氯化碳诱导的小鼠急性肝损伤*
- Puerarin alleviates radicular pain caused by lumbar disc herniation by inhibiting spinal glial cell activation and inflammatory response*
- miR-23b-3p靶向XIAP调控类风湿关节炎滑膜成纤维细胞增殖和凋亡的机制研究*

