来自光裸方格星虫产纤溶酶蜡状芽孢杆菌的鉴定
李小媚 周宗慧 尹秀华 江虹锐 刘小玲
(广西大学轻工与食品工程学院,南宁 530004)
血栓性疾病是由血栓形成和栓塞引起的一系列疾病的统称。急性血栓性疾病的治疗方式主要有外科手术抗凝管介入溶栓、手术取栓及滤器置入、服用抗凝剂以及溶栓疗法等。针对急性血栓疾病,目前PCI术的治疗效果最佳,但溶栓剂成本较低,在不能及时进行PCI术的情况下可以快速实现血管再通,纤溶酶是最常见的溶栓剂之一[1]。纤溶酶又称为纤维蛋白溶解酶,能特异性降解血栓的主要成分纤维蛋白,因此能溶解血栓,起到疏通血管的作用,在临床上可用于治疗血栓性疾病[2]。天然纤溶酶的来源多样化,有动物、植物和微生物,其中,微生物是一个重要来源,现已报道出来的产纤溶酶的微生物种类丰富,如海洋假单胞菌、南方小药酒中的根霉、纳豆中的枯草芽孢杆菌等[3]。
光裸方格星虫(Sipunculus nudus)又名沙虫,主要分布于太平洋、大西洋、印度洋沿岸,我国沿海均有分布,其中广西沿海区域资源量最为丰富,其体内具有溶解纤维蛋白的酶。有研究表明,光裸方格星虫的微生物多样性丰富,可培养的微生物包括有Bacillus、Leucobacter、Pseudomonas等多个属,是一种良好的微生物来源[4]。目前,光裸方格星虫纤溶酶大多由虫体直接提取,未见来源于其共生微生物的相关报道。本研究拟以光裸方格星虫为原料,采用脱脂乳平板、纤维蛋白板联合筛选的方式分离出一株纤溶酶产量高的菌株,并探究其血栓溶解机理和纤溶活性,为今后利用分子生物学手段提高产量和生产适用工程菌的选育奠定基础,为海洋微生物来源纤溶酶的工业开发提供理论依据。
1 材料与方法
1.1 材料
光裸方格星虫产地为广西北海市,平均重量(25.0±2.2)g,平均长度(17.0±1.1)cm,采集日期2018年9月30日。采集后即刻海水保湿(海水来自广西北海海域),运送至实验室。
1.2 方法
1.2.1 培养基的配制 脱脂乳平板培养基:将10%(W/V)的脱脂乳和4%(W/V)的琼脂分别进行121℃,1×105Pa灭菌20 min,冷却至50℃混匀,作为产蛋白酶初筛平板培养基。
菌株分离与发酵培养基:2216E海生菌液体培养基购自索莱宝生物科技有限公司,于121℃,1×105Pa灭菌20 min,备用。
1.2.2 菌株的分离纯化 新鲜方格星虫的体表用1%无菌NaCl溶液清洗8次至表面清洁后,放进无菌玻璃研钵中,按1∶2(W/V)加入1% NaCl溶液充分研磨。用1% NaCl溶液将研磨液进行10-1、10-2、10-3、10-4梯度稀释,在2216E海生菌固体培养基上涂布培养,26℃恒温培养3 d。挑取完整的单菌落于2216E海生菌固体培养基分离纯化,直至获得纯菌,即固体培养基上无其他形态的菌落。将收集的海水进行相同梯度稀释,并涂布至2216E海生菌固体培养基进行单菌落分离纯化,所得纯菌作为对照组。
1.2.3 产蛋白酶活性菌的筛选 挑取纯化后的单菌落放入含有100 μL/孔2216E海生菌液体培养基的96孔板中,26℃,200 r/min震荡培养24-48 h。培养结束后,每株菌的发酵液按2 μL/孔取出涂布在脱脂乳平板上,于30℃恒温倒置培养48-72 h。将形成明显溶解圈的菌株做好标记,为具有产蛋白酶活性菌。每个纯化后的单菌落作3组平行试验。
1.2.4 产纤溶酶活性菌株的筛选 用无菌牙签将分离纯化后,具有产蛋白活性的单菌落接种至脱脂乳平板,30℃恒温倒置培养48-72 h,用微生物计数仪测量溶解圈和菌落的直径大小,得出溶解圈直径(D)与菌落直径(d)比值,选取D/d比值大于1的菌株作为目的发酵菌株。目的菌株摇瓶发酵培养72 h,收集发酵液于4℃,10 000 r/min离心15 min,取上清液得到发酵粗酶液,采用纤维蛋白板测定粗酶液酶活。选取酶活最高的菌株作为实验菌株。
1.2.5 纤维蛋白板的制作 纤溶酶酶活用纤维蛋白板法测定,纤维蛋白板的制作参考Astrup等[5]的方法。将0.02 g牛纤维蛋白原加入10 mL 0.9% NaCl溶液中于37℃充分溶解。取5 mL 10 U/mL凝血酶于37℃中水浴备用。0.2 g琼脂糖加入到10 mL超纯水中,灭菌使用。无菌的琼脂糖溶液冷却到45℃时加入凝血酶,混匀后再加入10 mL 浓度为0.002 g/mL牛纤维蛋白原溶液,快速混匀后倒平板。纤维蛋白板凝固后室温水平倒置3 h,用直径为3 mm的玻璃管打孔备用。
1.2.6 菌株产纤溶酶活力的测定 分别配制浓度为100、200、300、400、500 U/mL的尿激酶溶液,各取10 μL加入直径为3 mm的纤维蛋白孔中,在室温下静置10 min后,37℃恒温培养18 h测量溶解圈垂直直径大小。以尿激酶纤溶活性的对数(lgC)为横坐标,溶解圈垂直直径平方的对数(lgA)为纵坐标,得出尿激酶标准曲线线性方程y=0.282 7x+2.2558(R2=0.994 1)。将10 μL发酵粗酶液加到纤维蛋白板的孔中,37℃恒温培养18 h后测量纤溶圈垂直直径大小,由尿激酶曲线得出菌株粗酶液酶活力。以0.9%NaCl溶液作为阴性对照组(Negative Control,NC)。
1.2.7 菌株形态以及生理生化鉴定 将筛选出的产纤溶酶菌株菌液经2216E琼脂培养基划线进行37℃培养12 h,挑取新鲜菌苔经0.9%生理盐水梯度稀释制备浓度为3×108CFU/mL菌悬液,采用细菌新型生化鉴定管(购于广东环凯生物科技有限公司)对筛出的菌株进行厌氧试验、过氧化氢、运动性、V-P试验、硝酸盐还原、生长温度、溶菌酶耐性、蛋白质毒素、耐盐性等生理生化鉴定[6]。
1.2.8 16S rDNA PCR扩增与序列鉴定与生物信息学分析 采用Biospin细菌基因组DNA提取试剂盒提取细菌的总DNA作为PCR的模板,PCR所用引物为细菌通用引物27F和1492R,其序列为:正向引物(27F):5′-AGAGTTTGATCCTGCCTCAG-3′;反向引物(1492R):5′-TACGGCTACCTTCTTACCACTT-3′。PCR扩增产物经2%的琼脂糖凝胶电泳后的测序由南宁国拓生物科技有限公司完成。测序结果的同源比对和系统发育树的构建在NCBI的搜索工具BLAST进行。根据同源比对结果分析,下载高同源性的菌株16S rDNA序列。将实验菌株与同源性菌株用MEGA5.0的邻近法构建系统发育树。
1.2.9 酶的作用机制研究 按照1.2.5所述的方法配制纤维蛋白平板,经过85℃,30 min热处理的纤维蛋白板称为加热平板,未进行热处理的纤维蛋白板称为未加热平板。分别取10 μL来源于光裸方格星虫试验菌株发酵粗酶液与同等酶活的尿激酶加入加热平板和未加热平板中,于37℃培养18 h观察纤溶圈,以此判断该试验菌株所产纤溶酶溶解血栓的作用机制[7]。重复3次平行试验。
1.2.10 体外溶血实验 取新鲜鸡血静置30 min后,经5 000 r/min离心10 min,去除上清液,吸干表面的血清。将凝血块切成15 mm×5 mm×3 mm小块,加入无菌试管中,再分别加入1 mL的0.9%NaCl和粗酶液,置于37℃恒温水浴,6 h后小心取出血块,用滤纸条吸干血块表面水分,进行称量,以血块溶解率公式计算粗酶溶解血栓的能力,重复实验平行3次。血块溶解率公式[8]:
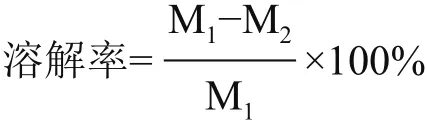
其中,M1为凝血块溶解前质量;M2为凝血块溶解后质量。
2 结果
2.1 产纤溶酶菌株筛选结果
通过脱脂乳平板从光裸方格星虫和海水样品中共筛出8株产蛋白酶菌株(图1)。利用纤维蛋白板进行复筛,有6株菌具有产纤溶酶的能力(表1,图2),其中6号菌来自海水对照组,命名为GXUSPL-2菌株;3号菌为光裸方格星虫中产酶能力最强菌株,将其命名为GXUSPL-1菌株,其余产酶菌株均来自光裸方格星虫。由尿激酶线性回归方程得出GXUSPL-1菌株粗酶液的酶活力为303.2 U/mL,GXUSPL-2菌株则为251.4 U/mL。
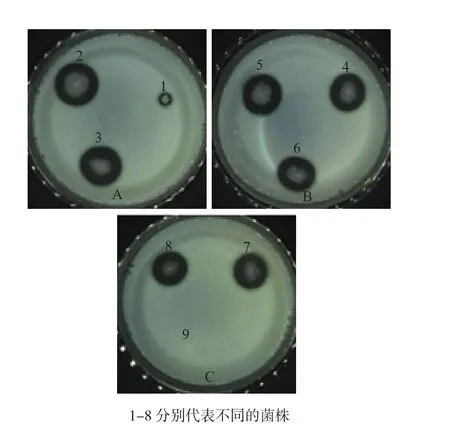
图1 初筛菌株在脱脂乳平板中产生的溶解圈
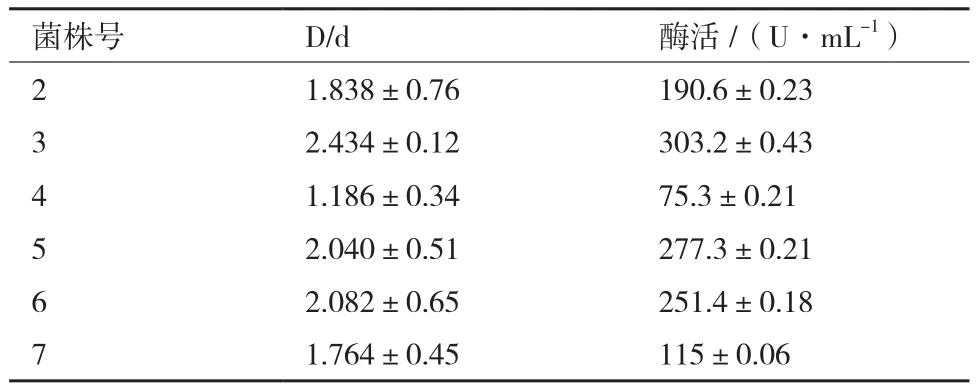
表1 产纤溶酶菌株筛选结果
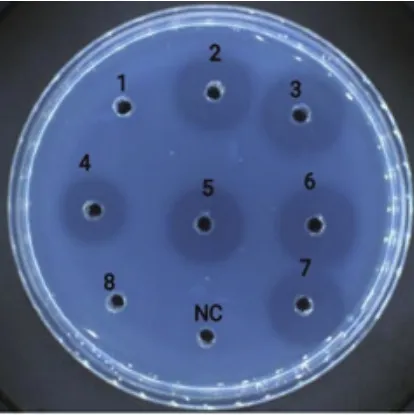
图2 复筛菌在纤维蛋白板产生的溶解圈
2.2 产纤溶酶活性菌株鉴定以及生理生化特性

图3 菌落形态
2.2.1 产纤溶酶菌株的菌落形态 GXUSP-1和GXUSP-2经过恒温培养48 h后菌落形态相似(图3),单菌落呈橙红色,中心凸起,边缘成锯齿状或波浪状,表面粗糙,质地不透明。
2.2.2 菌株生理生化特性 由表2可知,GXUSP-1菌株在还原硝酸盐和产生蛋白质毒素呈阴性,在5、10以及50℃的生长环境中不能生长,最高生长温度45℃,V-P测定、过氧化氢、溶菌酶耐性均为阳性,具有运动性,专性厌氧,耐盐性强,盐的耐受值达到10%;GXUSP-2菌株在还原硝酸盐显阳性,其他特征均与GXUSP-1菌株相同,根据菌株形态特征与生理生化特性,可初步鉴定两株菌均属于蜡状芽孢杆菌。
2.2.3 16S rDNA PCR结果以及系统发育树分析 提取细菌总DNA作为模板,采用细菌通用引物27F/1492R进行PCR扩增,扩增产物用2%琼脂糖凝胶电泳得到结果,扩增产物为1 600 bp左右(图4)。 将 GXUSP-1的 16S rDNA 序 列 在 NCBI中 的nucleotide blast核酸数据进行同源性比对。同源性比对结果显示,GXUSP-1与多株菌相似度达到99%。根据该菌在NCBI核酸数据库的比对结果,使用其在数据库中相似性达到99%以上的部分同源、同属和同种的16S rDNA序列构建系统发育树。从图5可以看出,GXUSP-1与GXUSP-2自展支持率为65%,且两株菌与MH041184.1Bacillus cereus strain自展支持率高达100%。因此,GXUSP-1属于蜡状芽孢杆菌属(Bacillus cereus),同时也是海洋共生菌。
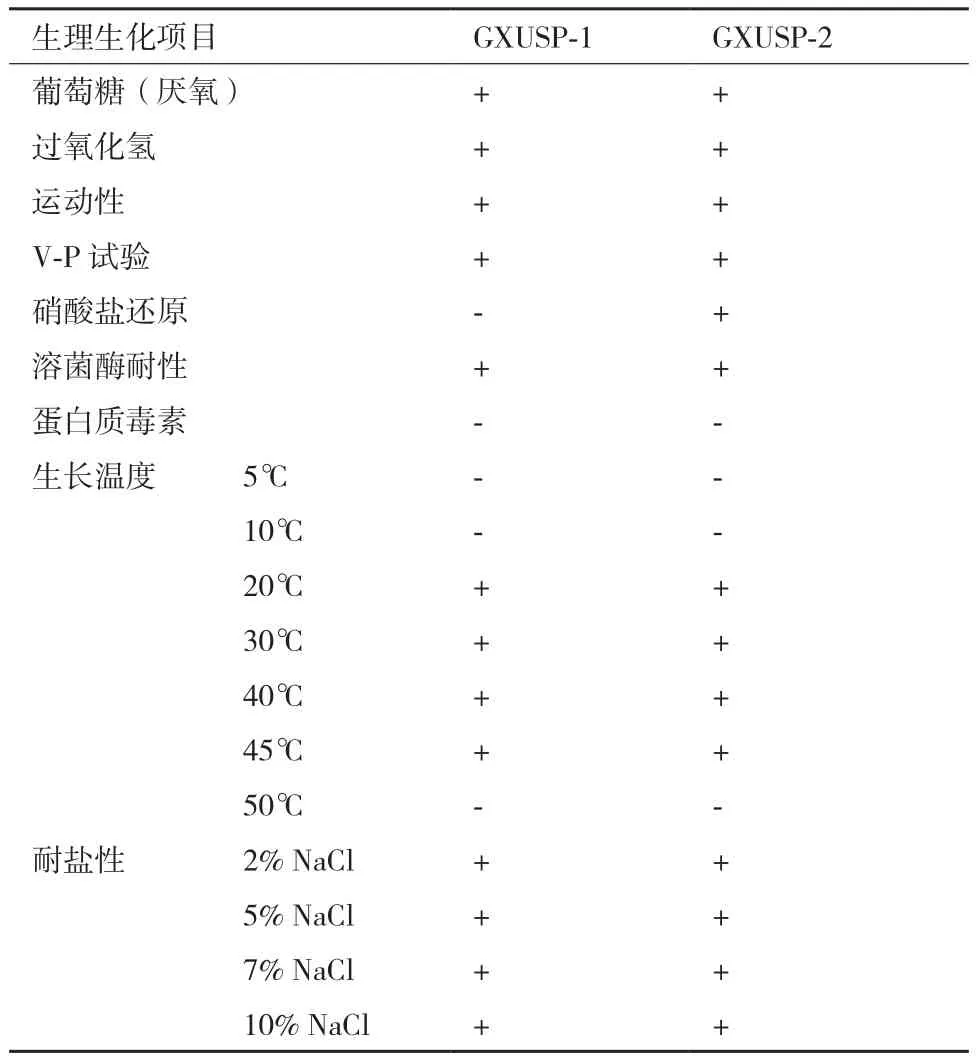
表2 生理生化实验结果表
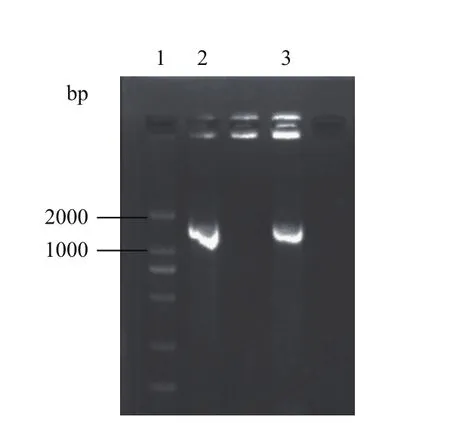
图4 16S rDNA PCR电泳图
2.2.4 酶的作用机制 GXUSP-1经过72 h发酵离心得到粗酶液。通过粗酶在纤维蛋白板与纤维蛋白板形成的溶解圈判断GXUSP-1菌株纤溶酶溶解纤维蛋白的作用方式。加热平板中的纤溶酶原由于受热而失活,仅能反映出酶的直接作用方式。未加热平板体现的是纤溶酶直接和间接作用于纤维蛋白的双重作用。结果表明,该酶在这两种纤维蛋白板均有溶解圈出现,未加热平板中的溶解圈直径15.3±0.02 mm显著高于加热平板13.8±0.06 mm;而尿激酶仅在未加热平板中出现溶解圈,说明其对纤维蛋白的降解是通过间接方式。从实验结果得出,GXUSP-1菌株纤溶酶与尿激酶的作用方式明显不同。
2.2.5 体外溶血实验 通过对实验性凝血块的溶血作用,探究GXUSP-1菌株的粗酶液对血栓的降解能力。同一温度下,凝血块的溶解率越高,说明其对血栓溶解效果更佳。结果(图6)可得知GXUSP-1菌株的粗酶液对血栓具有明显降解作用,经过37℃,6 h的作用后,凝血块的溶解率可达到39.64%。而0.9%的生理盐水对血栓溶解率低于13%。

图5 GXUSP-1 16S rDNA采用NJ法构建的系统进化树

图6 GXUSP-1菌株的粗酶液对血栓的溶解作用
3 讨论
我国的海洋生物资源丰富,海洋环境和陆地环境在含氧量、盐浓度、以及温度等方面都存在较大的差异。为了更好利用海洋微生物资源和寻找天然溶栓剂,许多研究以海洋中的不同物质作为载体筛选出能产生天然纤溶酶的微生物,如海泥[9]、海水[10],这些微生物大部分是细菌,如枯草芽孢杆菌[11],海洋假单胞菌[12]。光裸方格星虫具有可食用性,其自身结构简单且具有溶解蛋白的物质[13]。本研究从北海采集的光裸方格星虫体内筛选出5株产纤溶酶细菌,其中筛出的GXUSP-1菌株产纤溶酶酶能力(303.2 U/mL)最高。虽然GXUSP-1菌株纤溶酶活力低于张雪琴等[14]从蚯蚓中分离出的产纤溶酶的蜡状芽孢杆菌初始发酵酶活(538.64 U/mL),但GXUSP-1在含盐量10%的营养琼脂中生长繁殖良好,其菌株耐盐性强于蚯蚓蜡状芽孢杆菌。GXUSP-1菌株与海水来源的GXUSP-2菌株经生理生化鉴定以及16S rDNA PCR技术可初步认定均为蜡状芽孢杆菌,仅在硝酸盐还原性质上有差异,由此说明GXUSP-1菌株为光裸方格星虫与海水共生菌,但由于本次采样地点单一,不能说明GXUSP-1的菌株来自特定海域,后期将增加其他海域的采样点,分析光裸方格星虫附生微生物产纤溶酶能力与海域是否有关。大多数研究表明,具有溶解蛋白特性的野生型菌株初始纤溶酶活力一般在100-300 U/mL[15]。本研究筛出的野生型GXUSP-1菌株的产酶能力高于一般水平,后续可以通过基因测序及比对,运用生物信息学技术探讨来源不同的蜡状芽孢杆菌对酶表达的基因差异和相关性。
尿激酶作为一种激活剂,将纤维蛋白板中的牛血纤维蛋白酶原激活为纤溶酶,能间接降解纤维蛋白的作用[16]。本研究将GXUSP-1作用于加热前后的纤维蛋白板,并以尿激酶作为对照,发现GXUSP-1菌株纤溶酶能直接溶解血栓,并具有激活纤维蛋白原的作用,从而起到间接溶解血栓的目的。袁慎亮等[7]研究了从海泥中筛出沙福芽孢杆菌纤溶酶对血栓的特异性,发现沙福芽孢杆菌纤溶酶也可通过直接和间接作用溶解血栓,本研究结果与之相符合。GXUSP-1菌株纤溶酶在37℃条件下体外溶血实验中溶解率达到39.64%,远高于林芬等[8]从洒曲、酒糟、窖泥等原料中产纤溶酶菌株的血栓溶解率,该溶解率在25%左右。本实验为探究GXUSP-1菌株的产酶稳定性、酶的性质分析,扩大生产培养基优化提供基础,同时为研究和工业应用提供菌株来源。
4 结论
筛选来源于光裸方格星虫的产纤溶酶菌株,共获得5株具有产纤溶酶活性的菌株,其中GXUSP-1产酶能力较强,是一株可直接降解纤维蛋白的光裸方格星虫海水共生菌,具有显著的溶解血栓能力,其粗酶经过分离纯化后有望成为预防和治疗血栓的保健品。经鉴定GXUSP-1菌株与蜡状芽孢杆菌具有最近的亲缘关系,其代谢产酶的安全性分析以及菌株扩大发酵培养条件有待于进一步探索。

