NGAL、MCP-1水平对重症肺炎的诊断效能研究*
朱晓颖,张倩,刘聪辉,戈艳蕾,王红阳,陈前程,张海芳,张嘉宾
(华北理工大学附属医院 1.呼吸科,2.内分泌科,河北 唐山 063000)
重症肺炎作为呼吸科常见的危重病,多伴有心肺基础或附加危险因素基础上的肺部感染,或因特殊病原微生物引发严重炎症反应,其可出现严重低氧血症、呼吸及循环衰竭[1]。研究表明,血清单核细胞趋化蛋白1(monocyte chemotactic protein 1, MCP-1)与社区获得性肺炎的严重程度及预后有相关性[2]。大量资料表明,当感染加重时,中性粒细胞明胶酶蛋白(neutrophil gelatinase-associated lipocalin, NGAL)作为分泌蛋白被释放入血液清除感染源[3]。本文通过检测MCP-1及NGAL在重症肺炎患者血清中的表达水平,进一步研究2种因子与重症肺炎的相关性。
1 资料与方法
1.1 一般资料
回顾性分析2016年1月—2017年12月在华北理工大学附属医院呼吸内科及重症医学科住院的社区获得性肺炎患者89例。其中,普通肺炎者40例(普通肺炎组):男性22例,女性18例;年龄20~72岁,平均(60.13±9.74)岁。重症肺炎患者49例(重症肺炎组):男性23例,女性26例;平均年龄(65.08± 6.98)岁。重症肺炎诊断参照2007年美国胸科学会和美国感染病学会制定的重症肺炎诊断标准[1]。纳入标准:①需要有创机械通气;②感染性休克需要血管收缩剂治疗;③呼吸频率≥30次/min;④氧合指数(PaO2/FiO2)≤250;⑤多肺叶浸润;⑥意识障碍/ 定向障碍;⑦氮质血症(≥20 mg/dl);⑧白细胞减少(<4.0×109个/L),血小板减少(<10.0×109个/L);⑨低体温(<36℃),低血压,需要强力的液体复苏。符合上述≥3项可诊断为重症肺炎。普通肺炎诊断符合2016年中华医学会呼吸病学分会制定的《中国成人社区获得性肺炎诊断和治疗指南》诊断标准,需除外重症肺炎者。排除标准:①合并支气管哮喘、慢性阻塞性肺疾病、肺间质纤维化及肿瘤等其他肺部疾病;②结缔组织病;③长期应用免疫抑制剂或糖皮质激素; ④其他部位感染;⑤因创伤或外科手术感染;⑥合并肿瘤、甲状腺疾病。选取同期健康体检者55例作为对照组,其中,男性28例,女性27例;年龄35~80岁,平均(49.26±5.30)岁。
1.2 血清NGAL及MCP-1水平检测
采用酶联免疫吸附法检测重症肺炎组与普通肺炎组患者血清NGAL及MCP-1水平,试剂盒购于天津市灏洋生物制品有限公司。
1.3 肺炎严重度指数评分
按照美国胸科协会的肺炎严重度指数(pneumonia severity index, PSI)评分标准[4]对患者进行评分,其中包括3个人口学数据(年龄、性别及护理机构人员)、5种合并的基础疾病(肿瘤、肝脏疾病、充血性心力衰竭、脑血管疾病及肾脏疾病)、5项体格检查(精神状态、呼吸频率、收缩压、体温及脉搏)和7项实验室数据(动脉血气pH<7.35、血尿素≥11 mmol/L、血钠<130 mmol/L、血糖≥14 mmol/L、红细胞压积< 30%、PO2<60 mmHg及胸腔积液),加上年龄21个参数,计算出总分(女性患者减去10分)。
1.4 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,进一步两两比较用LSD-t检验;计数资料以率(%)表示,比较用χ2检验;相关分析用Pearson法,绘制ROC曲线,P <0.05为差异有统计学意义。
2 结果
2.1 重症肺炎组与普通肺炎组患者临床资料比较
重症肺炎组与普通肺炎组年龄、性别、冠状动脉粥样硬化硬化性心脏病(以下简称冠心病)、糖尿病、高血压、慢性肾病及脑梗死合并症比较,差异无统计学意义(P >0.05),具有可比性。见表1。
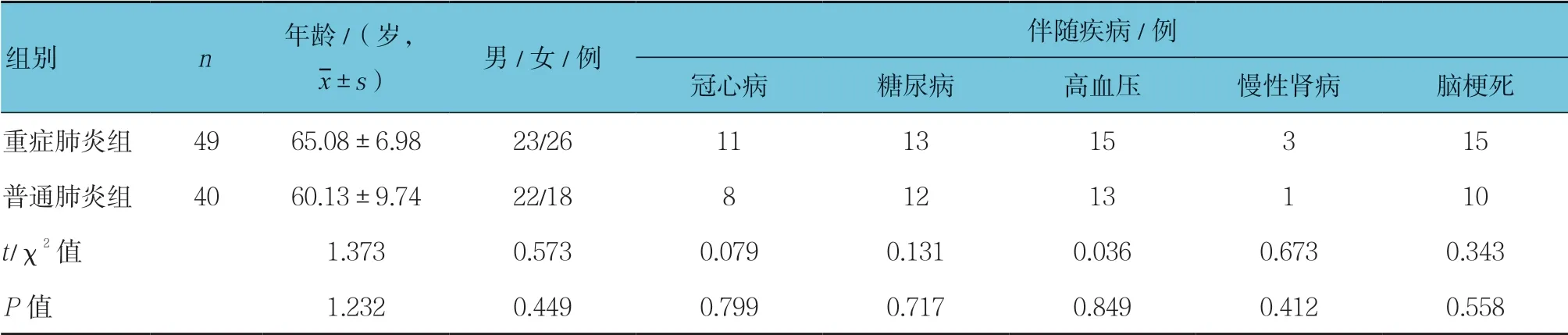
表1 重症肺炎组与普通肺炎组患者临床资料比较
2.2 3组血清NGAL、MCP-1水平及PSI评分 比较
3组血清NGAL、MCP-1水平及PSI评分比较,经方差分析,差异有统计学意义(P <0.05);重症肺炎组血清NGAL、MCP-1水平及PSI评分高于普通肺炎组和对照组(P <0.05)。见表2。
2.3 重症肺炎组患者血清NGAL、MCP-1水平与PSI评分相关性分析
重症肺炎组患者血清NGAL、MCP-1水平与PSI评分呈正相关性(r =0.701和0.762,P =0.002和0.008)。
2.4 血清NGAL和MCP-1对重症肺炎的诊断效能和预测重症肺炎的ROC曲线
NGAL预测重症肺炎临界值为269.81 ng/ml时约登值最大;MCP-1预测重症肺炎临界值为375.81 ng/ml时约登值最大;而NGAL和MCP-1二者联合预测重症肺炎的ROC曲线下面积为0.840,其预测重症肺炎的敏感性、特异性分别为93.5%和67.5%。见表3和 图1。
表2 3组血清NGAL和MCP-1浓度及PSI评分比较 (±s)
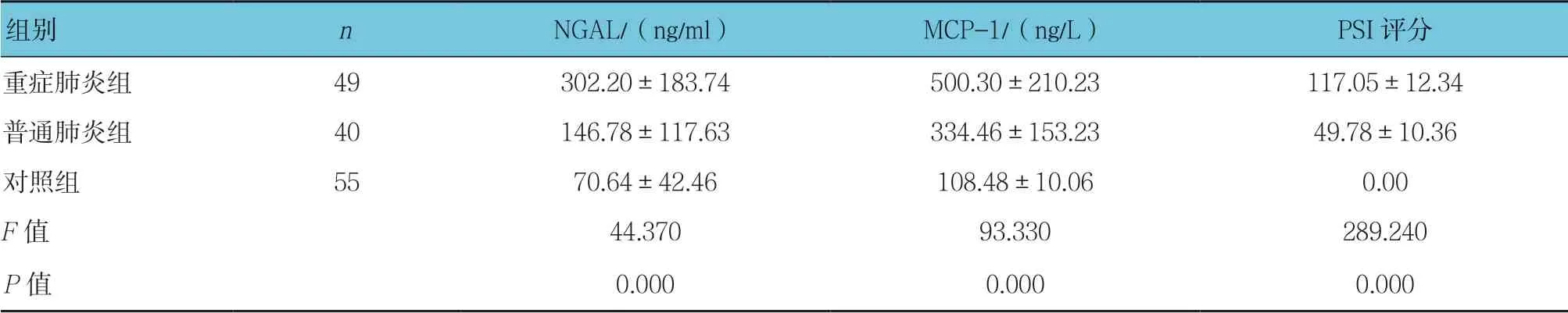
表2 3组血清NGAL和MCP-1浓度及PSI评分比较 (±s)
组别nNGAL/(ng/ml)MCP-1/(ng/L)PSI评分重症肺炎组49302.20±183.74500.30±210.23117.05±12.34普通肺炎组40146.78±117.63334.46±153.2349.78±10.36对照组5570.64±42.46108.48±10.060.00 F值44.37093.330289.240 P值0.0000.0000.000
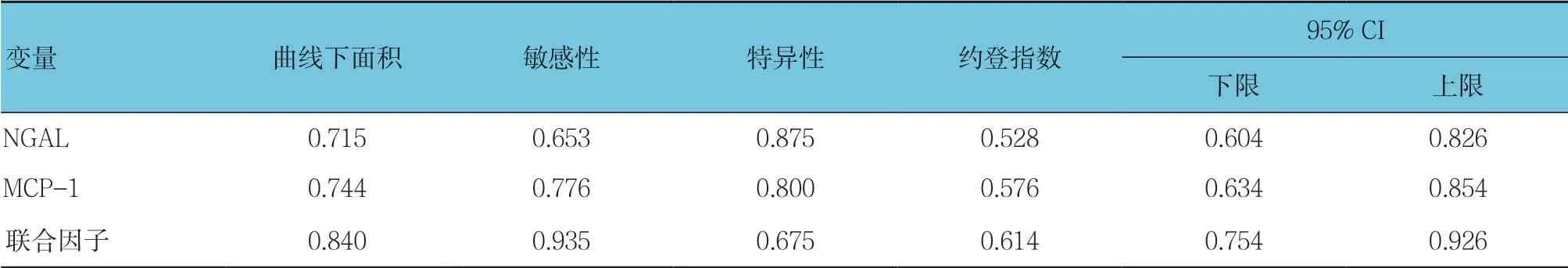
表3 血清NGAL和MCP-1对重症肺炎的诊断效能
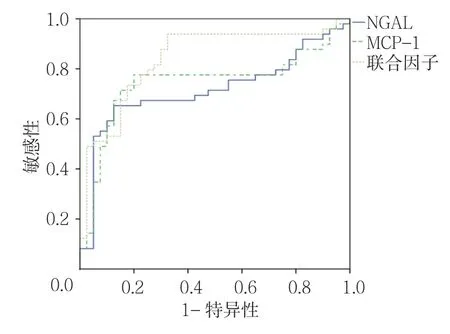
图1 NGAL、MCP-1及二者联合预测重症肺炎的 ROC曲线
3 讨论
重症肺炎是呼吸内科常见的危重症疾病之一,≥85%患者伴有各种严重的基础病变或处于严重的疾病状态。重症肺炎进展快,其扩展到肺部可引起呼吸衰竭,播散全身可引起脓毒症、感染性休克等,可迅速导致器官失代偿、多器官功能障碍及衰竭。
重症肺炎患者常合并多种病原菌的混合感染,当致病微生物侵入肺部造成感染后可激活炎症介质反应。例如其可通过释放组胺、缓激肽等引起内皮细胞收缩,血管通透性增加;亦可激活内皮细胞释放具有毒性的代谢产物和蛋白水解酶,造成内皮细胞损伤和脱落[5]。炎症反应的重要特征是白细胞的渗出,炎症的不同阶段游出的白细胞种类不同,在急性炎症早期多表现为中性粒细胞的增多[6]。相关研究表明,当人体发生感染、氧化应激及缺血等情况时,会导致人类组织中NGAL的基因上调,特别是在炎症早期阶段[7]。重症肺炎患者血清中NGAL表达高于普通肺炎组及健康对照组,分析其可能通过减弱中性粒细胞的趋化和附着能力,减弱白细胞的杀菌能力,从而加重炎症反应[8]。相关动物实验表明,NGAL基因缺陷的小鼠,其中性粒细胞不能清除入侵的细胞,且趋化和附着能力也较弱[9-10],进一步佐证此观点。国内外大量资料表明,NGAL亦可参与多器官损伤,尤其是肾脏,本文两组肺炎合并慢性肾病患者比较无差异,但重症肺炎患者也常一过性肾功能损伤,故可能引起研究误差。KANGELARIS等[11]研究发现,NGAL与急性呼吸窘迫综合征的联系与肌酐浓度无关,从而反映NGAL的高表达在肺炎诱发的肺损伤中发挥重要作用。
出现炎症反应时,白细胞可发生边集和滚动、黏附及游出。当白细胞游出血管后,可通过有趋化作用的化学刺激物亦称趋化因子将白细胞聚集到炎症病灶,而不同的趋化因子吸引的白细胞种类不用,MCP-1作为一种单核细胞趋化蛋白,主要有单核细胞、巨噬细胞及树突细胞分泌。当发生炎症反应时,可激活单核/巨噬细胞的趋化作用,激活白细胞黏附分子1的表达[12-13],诱导细胞因子白细胞介素1、白细胞介素6的生成并能调节单核细胞表面特异性黏附分子CDllc、CDllb的表达[14];此外,其亦可通过作用单核细胞,使细胞内钙离子浓度增加,引发细胞运动、分泌吞噬及一些神经递质分泌,从而引起呼吸爆发,参与免疫应答反应[15]。本文结果显示,重症肺炎患者MCP-1高于普通肺炎者,考虑与炎症反应驱动有关。当炎症反应较重时,MCP-1通过趋化作用将白细胞聚集到感染部位发生抗炎作用。大量文献表明,MCP-1在冠心病、类风湿性关节炎、神经系统疾病及肿瘤等患者中高表达[16-18],故临床重症肺炎患者MCP-1水平升高时,需警惕同时存在上述疾病,应积极进行相关筛查,以便做出精准治疗,同时也降低医疗风险。
PSI评分作为评价社区获得性肺炎严重程度的指标,目前被认可[19]。笔者认为,MCP-1及NGAL可一定程度上反映重症肺炎的严重程度。因此,当普通肺炎患者尤其对于老年患者,其肺部感染的症状常不典型,可能仅表现为乏力、食欲减退等,此时可通过监测MCP-1及NGAL水平来提前调整治疗方案,以减缓或避免其进展为重症肺炎,同时通过本研究也为临床预判增加实验室依据。

