4周有氧运动对Apelin基因敲除鼠糖耐量和骨骼肌糖代谢相关基因表达的影响
何诗依 李铁瑛 严露 侯影 张缨
北京体育大学运动人体科学学院(北京100084)
Apelin 是血管紧张素Ⅱ1 型受体相关蛋白——APJ的内源性配体,由77个氨基酸组成,含有前体多肽序列和分泌信号序列[1]。Apelin 广泛分布于中枢神经和外周组织器官中,如神经、心血管、骨骼肌和脂肪等[2,3]。以往的研究主要集中在Apelin 作为脂肪因子与肥胖、糖尿病,作为内皮因子与心血管和作为内分泌因子与神经、肺功能等方面的调节关系上[3,4]。研究发现,Apelin与机体糖代谢调节有着密切的关系[5]。Apelin基因缺失鼠的葡萄糖耐量和胰岛素耐量则明显降低[6]。
有氧运动在调节葡萄糖代谢中发挥关键性作用[7]。那么,Apelin缺失是否影响有氧运动对糖代谢的调节呢?骨骼肌作为机体的动力源,在运动维持血糖平衡中起着重要作用[8]。近年来的研究证明肌肉收缩可增加Apelin mRNA 表达[9]。胰岛素抵抗大鼠进行8 周的跑台运动后,胰岛素抵抗减弱,并且比目鱼肌和腓肠肌中Apelin 蛋白表达呈显著性增加[10]。张靓等对肥胖大鼠进行10周跑台运动干预的研究发现,运动后肥胖大鼠与未进行运动的肥胖大鼠相比,比目鱼肌中Apelin 表达增加,并且肌肉中毛细血管生成增多[11]。另有文献报道,喂食高脂饲料的Apelin 转基因鼠其骨骼肌葡萄糖氧化能力显著高于野生鼠[12]。然而,运动是否介导Apelin调控骨骼肌糖代谢,目前仍不清楚。
因此,本研究通过4周有氧运动训练,观察安静和运动两种状态下Apelin 敲除(KO)和野生(WT)小鼠葡萄糖耐量水平和骨骼肌糖代谢相关基因表达的变化,以探究运动调控糖耐量和骨骼肌糖代谢的可能机制。
1 研究对象和方法
1.1 实验动物和分组
健康8 周龄的成年C57BL/6J WT 和Apelin KO 鼠各40 只。进一步分为野生安静组、野生运动组、敲除安静组和敲除运动组4 组,每组20 只,每组10 只用于糖耐量实验(GTT),剩余10 只用来测量骨骼肌糖代谢相关基因mRNA 和蛋白表达。Apelin KO 鼠由美国Mutant Mouse Resource and Research 中心提供,并由中国医学科学院实验动物研究所保种繁殖,WT来自于北京维通利华实验动物技术有限公司。体重为22±2 g,每笼3~4只饲养,室温20~25℃,相对湿度50%~70%,每天光照12 h,自由进食和饮水。该动物实验方案被北京体育大学动物伦理委员会批准。
1.2 运动方案
运动组在正式实验开始前熟悉3天跑台运动。运动组进行持续4 周的跑台运动,每周训练6 天,运动组在训练前以及运动两周后采用实验动物呼吸检测系统(美国Columbus Instruments)测量最大摄氧量,调节运动强度为70%~75%最大摄氧量强度,即前两周的运动速度为15 m/min,后两周的运动速度为20 m/min,坡度为5°,每天运动1小时。
1.3 测试指标及方法
1.3.1 小鼠的基因型鉴定
取4周龄所有小鼠的尾尖组织,放入到装有75 μl碱液的离心管中,95℃孵育40 min。结束后加入75 μl中和液,常温静置5 min,得到提取的小鼠基因组DNA。进而,样品做PCR扩增,引物序列如下:
将以上所有引物混合成为混合引物。PCR反应体系为:2×EasyTaq PCR SuperMix12.5 μl,10 μmol/l,混合引物2.5 μl,模板DNA 2.5 μl,加ddH2O 7.5 μl补足25 μl。1%的琼脂糖凝胶电泳,溴化乙锭作为分子量标记物,做电泳鉴定。

表1 不同基因型引物序列(5’-3’)
1.3.2 葡萄糖耐量试验(glucose tolerance test,GTT)
运动组在最后一次运动后休息48 小时(自由进食),安静组和运动组小鼠禁食16 h后,腹腔注射浓度为100 mg/ml 的D-葡萄糖(1g/kg 体重)溶液。注射前(0 min)及注射后15、30、45、60、90 和120 min 共7 个时间点,采用三诺GA-6 血糖仪(Sinocare,中国)检测小鼠尾静脉末梢血糖水平;血糖曲线下面积(area under the curve,AUC)=(0 min血糖值+15 min血糖值)×15/2+(15 min 血糖值+30 min 血糖值)×15/2+(30 min血糖值+45 min 血糖值)×15/+(45 min 血糖值+60 min血糖值)×15/2+(60 min血糖值+90 min血糖值)×30/2+(90 min 血糖值+120 min 血糖值)×30/2。AUC 代表葡萄糖耐量水平,AUC值越大,代表葡萄糖耐量水平越差。
1.3.3 RT-PCR测定mRNA表达
运动组在最后一次运动后休息48 小时(自由进食),安静组和运动组小鼠脱颈处死,取小鼠小腿骨骼肌(混合肌)。800 μl 的Trizol 试剂(Invotrogen)中放入50 mg 骨骼肌,剪碎匀浆后,用三氯甲烷、异丙醇、75%酒精进行分离提纯总RNA,用Nanadrop 2000(Thermo Scientific,USA)测定RNA 的纯度和浓度,选用逆转录试剂盒(Toyobo,FSQ101)将RNA 逆转录成cDNA,随后放到-20℃保存,选用的仪器是PCR 扩增仪(A100;杭州朗基科学仪器有限公司,MG96+/Y)。
采用美国ABI7500荧光定量PCR仪和Toyobo公司生产的荧光染料反应体系(SYBR Green Realtime PCR Master Mix),以及德国QIAGEN 公司引物:Apelin (QT00111762),Glut4 (QT01044946),Hk2(QT00155582) ,Pfkm (QT00159754) ,Gbe1(QT00252924),Phka1 (QT00143514)和18S rRNA(QT01036875)。反应体系包括:SYBR Green Realtime PCR Master Mix 10 μl,引物2 μl,CDNA 模版2 μl,ddH2O 6 μl。目的基因表达结果用比较CT法相对定量,目的基因=2-△△CT[13]。
1.3.4 Western blot 测定蛋白表达
将骨骼肌组织放入RIPA中,剪碎匀浆,12000 rpm离心30 min 后提取总蛋白。采取BCA 比色方法测量胞浆蛋白浓度(BCA Protein Assay Reagent,23225,Pierce,Thermo Fisher Scientific,USA)。根据蛋白浓度调整上样体积,上样蛋白总量为20 μg。采用Bolt 4%~12% Bis-Tris Plus 凝胶,NuPAGE MES SDS 电泳缓冲液分离目的蛋白,随后将目的蛋白转移到NC膜上(采用美国Invitrogen 公司的iBot Gel Transfer System)。丽春红对NC 膜进行染色标记后,然后采用5%的BSA 进行封闭1 h;用相对应的一抗进行孵育,比例分别为Apelin(1∶1000;PA5-51077,Invitrogen );Glut4(1∶2000;ab654,Abcam);β-actin(1∶2000;sc-477778,Santa Cruz Biotechnology)。洗脱后与相对应的二抗反应1 h,洗脱后加发光液(ECL western blot substrate,piece,USA)到NC 膜上,放入BIO-RAD 仪器中进行图像分析。

1.4 数据处理
所有数据采用SPSS13.0 软件进行统计学处理。Apelin mRNA 和蛋白含量采用独立样本t检验分析。将鼠种(WT鼠、KO鼠)和运动方式(安静、运动)作为组间主效应,分别对小鼠GTT 的血糖和AUC、Glut4 表达及糖代谢相关基因mRNA相对含量进行双因素方差分析;若鼠种与运动方式两因素有交互作用,采用LSD简单效应检验;若无交互作用,则采用独立样本T检验分析数据。数据结果用平均数±标准差(±s)来表示。P<0.05表示差异有统计学意义。
2 结果
2.1 4周有氧运动对Apelin KO鼠GTT影响
由图1数据统计结果可知,除45 min 血糖值和血糖AUC 外,其余时间点血糖值在鼠种与运动方式之间没有交互作用,采用独立样本T检验。图1A的GTT 结果显示,敲除安静组在45 min、60 min、90 min、120 min 这4 个时间点的血糖值显著高于野生安静组(P<0.05)。野生运动组相比野生安静组各个点血糖没有显著性变化;敲除运动组在45 min和60 min这两个时间点血糖显著低于敲除安静组(P<0.05);敲除运动组和野生运动组相比,GTT 中各点的血糖值都没有出现显著性变化。血糖曲线下面积(AUC)分析表明,敲除安静组和野生安静组相比,AUC显著性增加(P<0.01);经过4周有氧运动后,敲除运动组和敲除安静组相比,AUC显著性降低(P<0.05)(图1B)。
2.2 Apelin KO 鼠基因型验证以及野生小鼠骨骼肌内Apelin mRNA和蛋白的表达量
图2A 为不同基因型小鼠鉴定结果,DNA 条带在331bp 的为Apelin KO 鼠,DNA 条带位于176bp 的为野生型鼠。野生型小鼠运动组和安静组相比,Apelin mRNA和Apelin蛋白表达没有出现显著性变化(图2B、图2C)。

图1 各组小鼠GTT血糖值和血糖曲线下面积图
2.3 4周有氧运动对Apelin KO鼠骨骼肌Glut4 mRNA和蛋白的影响
由图3数据统计结果可知,Glut4 mRNA 相对表达量和蛋白表达在鼠种和运动方式之间没有交互作用,采用独立样本T检验。如图3所示:敲除安静组和野生安静组相比,骨骼肌内Glut4 mRNA和蛋白表达都显著性降低(P<0.05)。经过4周有氧运动后,野生运动组和野生安静组相比Glut4 mRNA 和蛋白表达没有出现显著性变化;敲除运动组和敲除安静组相比,Glut4 mRNA 含量显著性增加(P<0.05),但是其蛋白表达没有明显变化。敲除运动组和野生运动组相比,骨骼肌内Glut4 mRNA和蛋白表达显著性减少(P<0.05)。
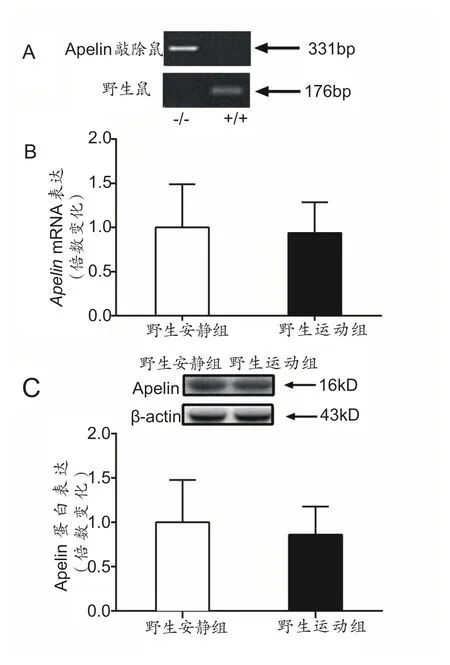
图2 Apelin KO鼠基因型验证以及各组骨骼肌Apelin mRNA和蛋白的表达
2.4 4 周有氧运动对Apelin KO 鼠骨骼肌糖代谢相关基因表达的影响
由图4数据统计结果可知,Gbe1,Phka1,Hk2 和Pfkm mRNA 相对表达量在鼠种和运动方式之间没有交互作用,采用独立样本T 检验。如图4所示,敲除安静组和野生安静组相比,骨骼肌内Gbe1,Phka1,Hk2和Pfkm 的mRNA 表达显著性减少(P<0.05)。经过4 周有氧运动后,敲除运动组与敲除安静组相比,Gbe1,Phka1和Hk2 mRNA表达显著性提高(P<0.05);同时敲除运动组和野生运动组相比,骨骼肌内Gbe1,Hk2 和Pfkm三个基因mRNA的表达显著性降低(P<0.05)。
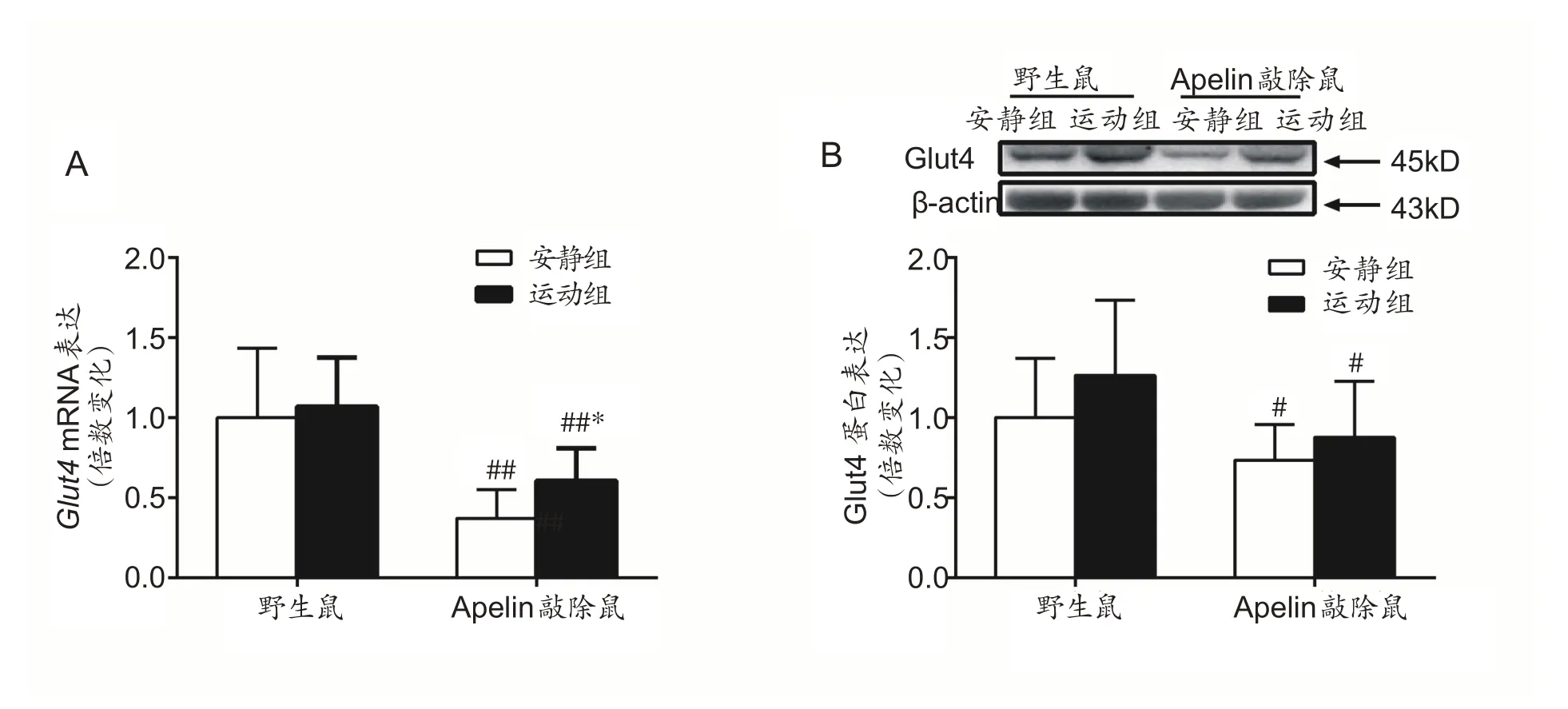
图3 各组Glut4 mRNA和蛋白表达变化
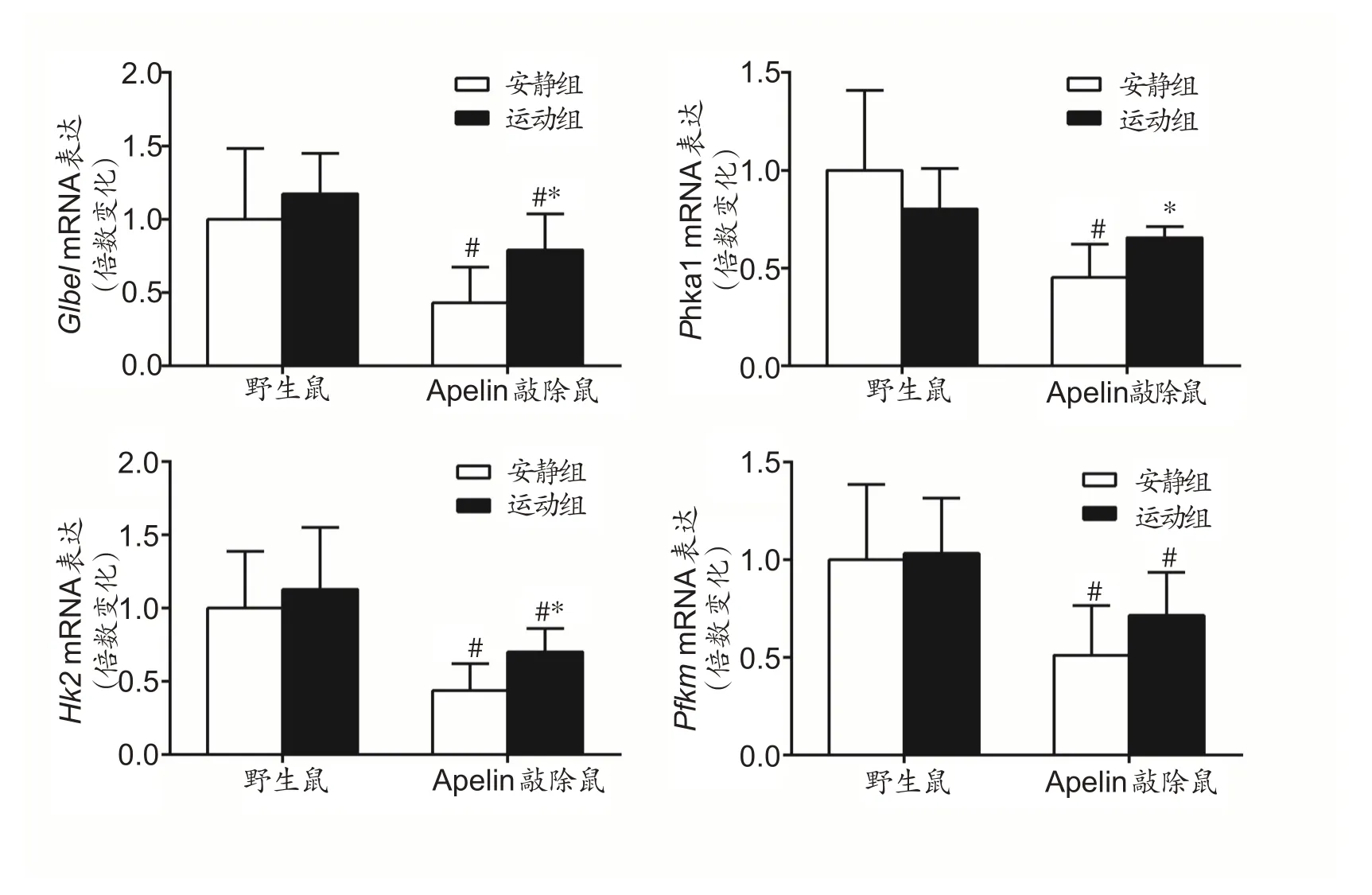
图4 各组糖代谢相关基因mRNA表达的变化
3 分析讨论
3.1 Apelin基因敲除对糖耐量和骨骼肌糖代谢的影响
葡萄糖耐量反映机体对血糖浓度平衡的调节能力。研究已发现Apelin KO 鼠的糖耐量和野生鼠相比显著性降低,呈现糖耐量受损现象[6],我们的实验结果与其相一致。骨骼肌占人体体重的40%以上,是摄取和利用葡萄糖的主要部位,在体内糖代谢平衡中发挥着重要作用。Apelin 与骨骼肌葡萄糖代谢密切相关,骨骼肌成肌细胞C2C12中加入Apelin能够促进其吸收葡萄糖的能力[6]。葡萄糖转运蛋白4(Glucose Transporter-4,Glut4)作为葡萄糖进入肌细胞的重要转运体,其表达水平可影响组织细胞对葡萄糖的摄取,2型糖尿病人慢肌纤维中Glut4 蛋白表达量降低是造成其骨骼肌摄取葡萄糖能力下降的重要原因[14]。Gbe1和Phka1分别是编码糖原分支酶(Glycogen branching enzyme 1,Gbe1)和磷酸激酶调节亚单位a1(Phosphorylase b kinase regulatory sbunit alpha 1,Phka1)的基因。Gbe1 主要参与合成糖原α-1,6-糖苷键从而促进糖原分支的形成[15];Phka1 促进糖原的分解[16]。骨骼肌内Gbe1和Phka1基因表达的增加能够增加骨骼肌对于葡萄糖的吸收[17]。而糖酵解是葡萄糖能量代谢的重要途径。Hk2和Pfkm可分别编码骨骼肌中糖酵解途径中重要的限速酶己糖激酶(Hexokinase 2,Hk2)和磷酸果糖激酶肌同工酶(phosphofructokinase muscle isozyme,Pfkm)。有研究报道2 型糖尿病大鼠的骨骼肌内Hk2表达水平显著下降[18]以及糖耐量受损小鼠骨骼肌Pfkm表达也显著降低[19]。在本研究中,Apelin KO鼠骨骼肌Glut4 mRNA 和蛋白以及糖代谢相关基因Gbe1,Phka1,HK2 和Pfkm 的mRNA 表达与野生鼠相比显著下降。以上表明,Apelin 缺失会影响骨骼肌转运和葡萄糖的利用。而骨骼肌葡萄糖摄取和代谢能力的下降可能是导致Apelin KO鼠糖耐量受损的重要原因。
3.2 4 周有氧运动对WT 鼠糖耐量和骨骼肌Apelin 及糖代谢相关基因表达的影响
运动的方式、时间以及强度不同会影响机体糖代谢对运动的适应,引起运动干预后不同的糖耐量变化。MacDonald 等对假性手术对照SD 大鼠进行为期4周递增强度的运动后,其GTT 的AUC 显著减少[20]。而Bradley等对WT鼠进行6周自主转轮运动后,发现糖耐量的变化不大[21]。同样,在我们的研究中,WT鼠经过4周有氧运动后GTT的AUC水平没有发生显著变化。这可能是由于正常的WT 小鼠自身的糖代谢处于稳态状态,而本实验的运动强度和运动时间没有打破其自身的稳态,因此,4周运动训练对其糖耐量水平影响较小。
骨骼肌作为内分泌器官,研究已发现,运动可促进人体[9]、胰岛素抵抗大鼠[10]和肥胖大鼠[11]骨骼肌Apelin表达,Apelin 被认为是运动可诱导产生的一个新的肌肉因子[9]。但是,也有文献发现6 周运动可抑制Zucker肥胖大鼠红肌纤维中Apelin 蛋白的表达,对白肌纤维内Apelin蛋白表达没有影响[22]。以上表明运动强度、时间、种属以及肌纤维类型等都可能影响骨骼肌的Apelin 表达。在我们的实验中,4 周有氧运动并没有引起WT 骨骼肌(混合肌)Apelin mRNA 和蛋白表达的显著性变化,也没有引起骨骼肌Glut4,Gbe1,Phka1,HK2和Pfkm mRNA和Glut4蛋白表达发生显著性变化。结果提示该运动训练方案对正常WT 鼠Apelin 表达以及骨骼肌糖代谢的调节作用不大。
3.3 4 周有氧运动对Apelin KO 鼠糖耐量和骨骼肌糖代谢相关基因表达的影响
有氧运动可促进糖代谢,调节能量代谢[23,24],是糖尿病、肥胖预防和治疗的基石[25,26]。大量的研究证明有氧运动能够改善因不同原因导致的糖耐量下降。高脂饮食可导致WT 鼠的糖耐量下降,而10 周有氧跑台运动显著提高糖耐量水平[27]。6 周跑轮运动可显著降低饮食诱导的肥胖小鼠的糖耐量水平,并提高其胰岛素敏感性[21]。我们的实验结果显示,4周有氧运动能够显著改善Apelin 缺失造成的糖耐量下降,可使其糖耐量水平达到WT鼠水平。
另外,4周有氧运动可显著提高Apelin KO 鼠骨骼肌内Glut4,Gbe1,Phka1 和Hk2 mRNA 表达,表明该运动训练在一定程度上促进了骨骼肌葡萄糖摄取能力、糖原或葡萄糖代谢,可能对改善因Apelin 缺失造成的小鼠糖耐量受损起到积极作用。但是,4周运动训练后Apelin KO 鼠糖代谢相关基因表达的变化与同样训练的WT 鼠相比,仍然存在显著性下降的差异,这说明在骨骼肌中Apelin的缺失仍然会影响有氧运动对骨骼肌糖代谢的调节作用。在本实验中,有氧运动除了对骨骼肌糖代谢有一定改善作用外,对其他组织器官,如肝脏、胰脏等可能也有积极的调节作用,这些因素共同促进了Apelin KO鼠糖耐量的改善,使得Apelin KO鼠的糖耐量水平达到正常WT 鼠水平。关于其具体的分子机制仍有待于进一步研究。
本研究发现有氧运动训练可有效改善Apelin缺失造成的糖耐量受损。但在实验中我们没有按照肌纤维类型进行取材,对骨骼肌糖代谢的研究也不够全面,存在着一定的局限性。在今后的研究中,将进一步深入研究Apelin在有氧运动训练对骨骼肌糖代谢的调节作用。
4 结论
Apelin KO鼠的糖耐量受损,骨骼肌葡萄糖代谢相关基因的表达显著降低;4周有氧运动可明显改善Apelin KO 鼠的糖耐量降低,对骨骼肌糖代谢相关基因表达有一定的积极促进作用。

