土壤氮激发效应及其微生物机理研究进展
刘少文 殷敏 褚光 徐春梅 王丹英 章秀福 陈松
土壤氮激发效应及其微生物机理研究进展
刘少文 殷敏 褚光 徐春梅 王丹英 章秀福 陈松*
(中国水稻研究所,杭州 311401;*通讯联系人, E-mail: chensong02@caas.cn))
土壤氮激发效应是土壤养分释放、植物养分吸收过程中的关键机制。对土壤氮素激发的深入了解,不仅有助于农业生产上更加合理制定氮肥运筹,从而提高氮肥的利用率,也有利于评估和控制环境污染并提供有效的治污方法。本文在介绍土壤氮素激发效应概念和机制的基础上,评估目前土壤氮素激发效应的主流测定方法及其在实际应用中的优劣,重点阐述了外源添加物(无机氮肥、有机物料和根系分泌物)对土壤氮素激发效应的作用效果及其微生物机理。土壤氮激发模式中,外源添加物对土壤C/N比的影响可能是土壤氮激发效应作用的关键。当系统中有效C冗余时,施用无机氮肥,促进土壤有机氮的分解,从而表现正的激发效应;反之,有效C不足但有效N富集时,则表现为固氮微生物活性相对增强,从而出现负的激发效应。微生物是激发效应的推动者。本文通过共代谢理论、微生物热区理论和微生物能量与物质转化理论三个理论假说解析了微生物在土壤氮激发过程中可能的作用机制,从而深化对激发效应的认识,为进一步明确土壤激发效应的微生物机制、因素之间的互作效应及通过激发效应为提高氮肥利用效率提供有效途径。
土壤;激发效应;氮肥;有机物料;微生物;根系分泌物
氮是植物生长发育的重要营养元素,土壤中氮的供应和转化,与作物的产量和品质形成密切相关[1]。土壤中的氮主要以有机氮的形态存在,通过微生物作用矿化为无机氮。同时,土壤中的氨或铵盐也会被微生物固持,进而转化为土壤中的有机态氮。充分了解土壤中氮素的种类、丰度、相互间转化以及作物的吸收特性是氮素高效利用的基础[2]。在土壤有机/无机氮的转化过程中,外源物质(有机/无机)的加入,往往会改变土壤中微生物的种类和数量[3],进而“激发”土壤固有有机氮的分解或者固持。因此,外源物质添加所导致的 “激发效应”,对于土壤-作物系统中氮素转化和作物利用具有重要的意义。通过对土壤“激发效应”的研究,不仅在农业上可以为合理施用氮肥提供科学依据,也为评估和控制环境污染提供基础理论。
激发效应最早发现于1926年,Lohnis[4]发现添加新鲜外源植物体可以促进土壤固有有机N(C)的矿化;1950年左右,Broadbent等[5]利用15N的同位素示踪技术确证了Lohnis的研究结果;Bingeman等[6]初步将这种现象命名为“激发效应”,但对这个现象出现的原因和给予的解释一直存在着争议。激发效应的定义主要以外源有机物料的加入改变了土壤有机碳/氮的矿化或固定为主。因此,Kuzyakov等[7]正式将“激发效应”定义为“外源有/无机物质的添加引起土壤固有有机物质周转率变化的表现”。关于激发效应的研究,国内起步较晚,且相关研究大多集中在氮肥[8]、有机物料[9]和根系分泌物[10]等对激发效应的表观作用。吕殿青等[11]研究发现相对于高肥力土壤,低肥力土壤添加外源物质后激发效应更显著。外源有机物料不仅增加了土壤中有机质含量,也提高了土壤氮含量[12]。激发效应对有机物料的响应机制与其生物量有关,一般认为,添加高生物量有机物料(C/N比高)产生负激发,低生物量有机物料(C/N比低)则相反[13];另一方面,氮肥施用对土壤氮激发效应的影响目前尚未有一致的结论,一些研究认为外加氮肥促进土壤氮的矿化,从而产生正激发[14];另有研究认为会促进微生物的固持,从而产生负激发[8]。而增施氮肥本身又会影响外源有机物料的分解及其土壤C和N的转化过程,目前关于不同属性有机物料与氮肥水平对土壤氮激发的互作效应研究报道较少,尤其对外源物质添加后的微生物机理的研究亟待深入。本文在介绍了土壤氮素激发效应含义的基础上,重点阐述了激发效应的几种测定方法以及它们的优劣,影响氮素激发效应的几个重要因素及激发效应的微生物机理,以期能够在一定程度上更好地了解激发效应的内在机制。
1 激发效应的概念及发生机制
土壤激发效应是指外源有机或无机物质的添加引起土壤固有有机质周转率变化的表现。Dalenberg和Jager[33]把外源添加物分成两类:一类物质产生正激发效应,如谷氨酸和天冬氨酸等;另一类物质产生负的激发效应,其代谢物有助于土壤有机碳的形成或者降低有机碳的分解,如葡萄糖、纤维素、麦秸、污泥等。关于激发效应的发生机制目前尚未形成一致结论,但是一般认为土壤氮激发效应的产生是外源添加物、土壤微生物与土壤三者相互作用的结果[15]。由微生物驱动,加快或者降低土壤固有有机氮分解或者固持速率,从而产生正或者负激发效应。微生物是激发效应的驱动者,在自然条件下,大部分微生物处于休眠或潜在活跃状态[16],土壤微生物推动激发效应发生的同时,基数量和活性亦受到土壤中有效氮含量的影响。研究表明,土壤中有效态氮含量受限会促进微生物分泌更多的胞外酶,从而加速土壤有机质的分解,产生正的激发效应[17];反之,在氮富集的土壤体系中,微生物活性降低、数量减少,同时产生胞外酶也减少,抑制有机氮的分解,产生负的激发效应[18-20];在土壤氮激发效应中,外源物主要包括有机物料、无机氮肥以及根系分泌物。加入外源有机物料,为微生物的生长繁殖提供了大量的碳源和能源,当然,不同的有机物料会刺激土壤中不同微生物种群的生长[21],有机物料的组分和性质差异,将导致土壤微生物数量及其活性的差异,激发效应的表现也就不同。无机氮肥的施用,能够直接改变土壤中有效态氮的结构与含量,显著抑制土壤微生物的增殖,进而干扰土壤氮激发。植物根系分泌物以及植株凋落物也会影响微生物的组成及数量[15],进而影响土壤氮激发效应。
2 氮激发效应的研究方法
目前常用的评估土壤氮激发效应的培养方法主要有通气培养和淹水培养等,根据培养过程中产生的可利用氮含量评估土壤供氮能力和激发效应;此外,激发态氮的测定方法通常有差值法、15N示踪法等。这些方法各有优缺点,适用于不同的条件。
2.1 培养方法
2.1.1 通气培养法
1972年,Stanford等[22]提出间歇淋洗通气培养法,通过向土壤中加入石英砂或蛭石,改善土壤通气状况,用加压抽气控制含水量。采用该方法模拟旱地作物实际氮素周转环境,可以客观地反映土壤氮素的矿化潜势。通过比较加外源物和不加外源物的土壤培养后矿化氮的差值,可以一定程度上反映添加外源物后引起的土壤氮激发效应。但是,由于通气过程中土壤有机氮的矿化产物和无机氮肥中铵态氮的挥发损失、硝态氮的反硝化损失等原因,无法准确量化土壤中各个矿质氮组分的变化量[23-24],从而导致实际测定过程繁琐,结果不稳定等问题,因此在实际中较少采用。
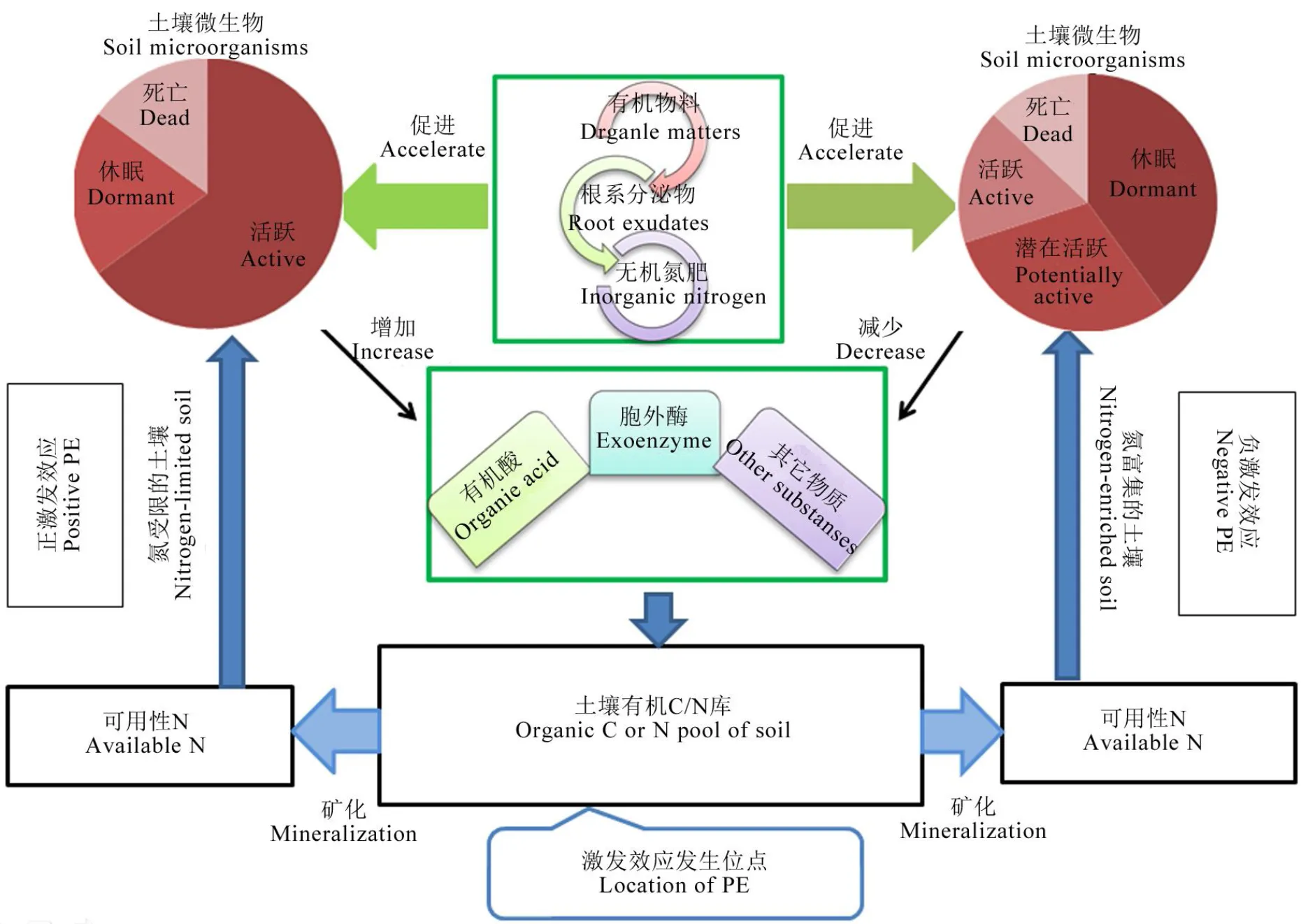
土壤中有效态氮含量受限会促进微生物分泌更多的胞外酶,从而加速土壤有机质的分解,产生正的激发效应;反之,在氮富集的土壤体系中,微生物活性降低、数量减少,同时产生胞外酶也减少,抑制有机氮的分解,产生负的激发效应。
Fig. 1. Mechanism of soil nitrogen priming effect.
2.1.2 淹水培养法
淹水培养法是由Waring和Bermner[25]最早提出的。具体实验方法如下:取风干土样(18目筛)进行淹水培养(35℃恒温),有机物料和(NH4)2SO4添加量按200 mg/kg(以纯N计)添加。在培养前先测定土壤起始铵态氮和非交换铵态氮的含量。然后,在培养特定时间再浸取铵态氮和非交换铵态氮的含量。该方法利用淹水培养条件下,硝化作用被抑制,且密闭条件下氨挥发较少的特点,将待测氮组分仅剩铵态氮,从而简化了测定流程和方法。通过测定培养前后添加与不添加外源物处理下土壤铵态氮的净增加量的差值,即为添加外源物质引起的土壤激发效应。该方法的应用主要受温度影响。因此,Bodelier等[25]在测定水稻土壤矿化氮时,引入了有效积温概念,将矿化量与有效积温关联。研究发现不同处理土壤矿化量的差异主要集中在培养后14 d内(相当于有效积温420℃),之后的矿化趋势基本相同。该方法适用于以水稻为代表的水田作物土壤,操作简单,测定指标较少,是目前评估土壤氮激发效应的主要培养方法之一。
2.2 测定方法
2.2.1 差值法
差值法主要通过比较添加与不添加外源物处理下,土壤中有效态铵的差异,从而评估土壤的激发效应。以加入外源无机氮肥为例,加入无机氮肥淹水培养后,测定的交换和非交换性铵态氮之和减去不加氮肥土壤在相同条件下培养后测定的交换、非交换性铵态氮及残留的肥料之和,即为由氮肥引起的激发效应(△NPF),写成公式则为△=[NH4−N(s+f)+NH4−N(s+f)]−[NH4−N(s)+NH4−N(s)+NH4−N]式中NH4−N(s+f)N及NH4−N(s+f)F分别为施氮土壤经过培养后测定的交换性和非交换铵态氮;NH4−N(s)N及NH4−N(s)F分别为不加氮对照土壤的交换和非交换铵态氮,NH4−NA为肥料加入土壤后,立即浸取回收的肥料氮,是加入肥料土壤测定值与不加肥料土壤测定值之差。该方法亦同样适用于添加其他外源物料造成的土壤氮激发差异。
2.2.215N标记法
在评估无机氮肥添加对土壤的氮激发效应时,还可以采用15N标记法,即用15N标记无机氮肥添加到土壤中,进行培养。通过测定激发前后15N丰度的差异变化,从而计算土壤氮激发效应。15N标记法,可以根据15N的走向,明确肥料氮在土壤中的分布状态,很容易区别外加肥料氮和土壤氮,可以比较清晰地反映由外加肥料氮引起的土壤激发效应。由培养过后进行差值法计算,虽然不能区别肥料氮和土壤氮,但能准确测定施氮与不施氮处理的矿化氮的净增量与加入铵态氮的差值。但该方法对于其他外源物添加引起的土壤激发效应并不适用。
3 土壤氮素激发效应的外源添加物
3.1 无机氮肥
外源氮素是农田系统重要的土壤氮激发引物。施用氮肥对土壤氮激发效应的研究已有大量报道。大量研究认为,增施无机氮肥有利于激发土壤固有氮[11]。Jenkinson等[27]通过增施15N标记的肥料,发现土壤中的非标记无机氮含量显著增加,表明外源氮的施入促进了土壤中固有氮的激发。Jansson[28]也发现,利用15N肥料,与不施肥相比,施肥处理下土壤释放非标记氮显著增加。但是,也有研究认为这种固有氮的激发实质上是一部分肥料氮被土壤固有氮置换。即土壤固有氮的激发只是由于测定角度导致的一种“表观”效果,外源氮添加并不能增加土壤中有效氮的含量。沈善敏[14]研究发现,添加外源氮肥不能引起土壤有机氮的加速分解,但是却能显著增加土壤对外源氮的生物固定,有鉴于此,有人提出氮肥的正激发效应只是一种表观现象,是加入的标记肥料氮与非标记氮之间固定和矿化转化的结果[27,29],标记的肥料氮部分地被生物所固持,其固持量与土壤氮矿化量的增量之差接近于零或者两者相当[28,14]。吕殿青等[11]进一步研究发现,土壤有机质矿化氮的增量与添加外源标记氮生物固定量之间的关系不一定是完全相等的,不同处理条件下,土壤有机质矿化氮的增量与添加外源标记氮生物固定量之间存在很大差异性。综上,无论是固有氮的净激发还是无机氮对固有氮的替换,大部分研究均认可添加外源无机氮后,土壤中的“氮周转”的确被激发,而激发效应则存在很大差异。
而这种激发效应的差异与什么相关呢?目前相关土壤氮周转研究表明,土壤氮矿化和固持的相互转化(MIT)特性可能是影响其效应的关键因素[30]。外源无机氮肥的投入影响土壤矿化和固持的相对强弱进而影响激发效应。土壤氮的微生物固持与矿化是同时发生在土壤氮循环中的两个重要过程,而土壤微生物既是这两个过程的执行者,又是植物营养元素的活性库[31]。当土壤固持与矿化处于动态平衡时,土壤氮激发效应的表观表现为零;当土壤矿化大于固持,土壤氮激发表现为正激发,反之,为负激发。鉴此,笔者认为仅用土壤净矿化氮的增量来表示土壤氮激发量不够准确,忽略了微生物激发效应。当向系统中投入无机氮肥后,一方面能够促进与土壤矿化相关微生物的增长繁殖,增强对土壤有机碳/氮的快速分解和矿化;另一方面土壤原有的微生物和新繁殖的微生物又能够利用原有的和矿化出的无机氮进行自身的代谢。因此,净矿化氮激发效应只是氮激发效应的一部分并非全部,两者的总和,才能表现土壤氮激发效应的实质。
3.2 有机物料
添加外源有机物料是农艺栽培上的重要措施,同时也是影响土壤氮激发效应的因素之一。大量研究表明,有机物料添加,不仅增加土壤有机质含量,而且提高土壤全氮含量[32]。但是,添加有机物料种类不同,所引发的激发效应却不尽相同。Dalenberg等[33]通过用14C标记葡萄糖添加到土壤中进行培养,发现土壤产生正的激发效应;另有研究证明[21]添加丙氨酸也发现类似的现象。而添加纤维素和麦秆等进行培养,产生负的激发效应。这可能与有机物料的分解等级有关,从有机秸秆逐渐分解,直至含碳小分子化合物,其激发效应由负逐渐转正。这说明,添加有机物料的氮激发差异主要与每一步分解所需的微生物有关。而相关微生物量及其活性的差异则可能与有机物料的组分和性质的特异性有关[34]。Hamer[21]研究发现添加不同的有机物料会刺激土壤中不同微生物种群的生长,如与土壤有机质分解有关的真菌、革兰氏阳性细菌、革兰氏阴性细菌的活性会随着有机物料的增加而增强[35,36]。Falchini[37]研究发现,加入谷氨酸和葡萄糖后土壤中的菌群变化是不同的;加入纤维素[38],相关真菌的活性会增强。另一方面,微生物本身对有机物料具有选择性分解。外加易分解的有机物料比加难分解的有机物料更能促进土壤有机质矿化的激发效应,如加入葡萄糖比加入麦秆更易被土壤微生物分解吸收,从而加快微生物的繁殖,加速土壤有机质的矿化[39]。外源有机物进入土壤,参与土壤N(C)循环并影响微生物的周转。由此可见,土壤微生物是土壤氮激发效应的“发动机”,加入外源有机物料可促进或者抑制土壤原有机质的分解,其激发效果与添加外源有机物料后所引起的微生物活性、数量和组成的改变有关。
根据C/N比将有机物料分为三类:1)C/N<25,水溶性物含量高,木质素含量低,如紫云英,豆科类作物,能源物质相对较少,易矿化有机氮多。施入后,有助于有机氮的矿化,氮肥表现为正激发效应,如李世清等[8]通过加入大豆茎叶(C/N=19.2)到土壤中进行淹水培养,两种土壤的激发值都为正,Hauck和Jenkinson[30]的研究也证明加入C/N较小的有机物料促进土壤固有氮的矿化。2)C/N=25~40,包括绿萍、怪麻等,既能为当季作物提供适当的矿质氮,同时提高土壤有机质积累量。有研究认为机物料C/N比约为25时,固定与矿化达到平衡,净矿质氮增加量为零。3)C/N>40,包括稻草、麦草等,能源物质丰富,微生物对矿质氮的固定作用强,因而氮肥的激发效应出现负值,这些有机物料在腐解初期夺取一定量的有效氮,因此直接施入土壤中需配施一定量的氮肥,如李紫燕等[13]通过淹水培养的方法,向土壤中加入长毛草(C/N=43.3)进行培养发现,在培养期间均表现出负激发效应。另外,廖中建等[40]研究也认为高C/N比外源有机物料的矿化速率较低,土壤微生物生长受氮素的限制而处于缺氮状态,矿化出的氮素将被迅速固持。由此可见,在研究氮肥的激发效应时,外源添加物中有机物料的种类、组成及数量的多少[8,10],对作物土壤氮利用与吸收起着至关重要的作用。
3.3 根系分泌物及根际效应
根系分泌物,是指植物生长过程中根系不同部位向生长介质中分泌或释放的种类繁多的物质。主要包括碳水化合物、有机酸、激素和维生素等[10]。根系分泌物不仅为根际提供了大量的碳源和能源,同时还促进了土壤微生物的繁殖,增加了微生物的数量和多样性[19]。根际是土壤中根系周边的狭小区域,距离根系表面1~3 mm[41,42],这个区域由于植物根系生长和生理代谢,使其周围土壤环境中的物理、化学、生物学特性都不同于原土体,从而形成一个特殊微域环境,它是植物-土壤-微生物与其环境条件相互作用的场所。根际区域土壤微生物数量通常是非根际区域的19~32倍以上[43]。与裸土相比,根系会促进或抑制土壤原有机质的分解,称为根际激发效应[29]。据Kuzyakov[44]研究,根际激发效应可增加3~5倍或降低10%~50%的土壤有机质的分解速率,根际是土壤激发效应最重要的发生部位。
根际激发是一个复杂的过程,与根系分泌物及土壤中微生物的种类和数量密切相关,如根系分泌有机酸(甲酸、乙酸和草酸等),会降低土壤pH值,一定程度上加速了有机质的分解速率[44]。植物为适应复杂多变的土壤环境,通过根系分泌物影响根际微生物的活性,反过来,微生物通过改变植物代谢中细胞的渗透性和酶的活性等进而影响根系分泌有机物。另外,根际效应还受到作物生育期的影响,Kuzyakov[44]提出,不同的生育期根系分泌物的种类和数量都有差异,对根际激发效应的影响也就不同,在生长初期,对营养的需求量少,根系分泌物也少,往往出现负的根际激发效应;而在生长盛期,对营养的需求量大,植物分配较多的产物到根际,根际表现正激发[45,46]。Sallih和Bottner[47]用多种类型的土壤进行试验,仅在一种土壤中观察到小麦根系能明显促进土壤有机质的分解,表明根际激发效应也受土壤类型的影响。从某种意义上来说,根际效应是植物为适应复杂多变的土壤环境和自身的生理状态而产生的生理及形态反应。总之,根际效应受多种因素的影响,是植物根系及其分泌物和微生物以及土壤有机质之间相互作用的结果,由微生物推动,通过改变微生物的活性来实现的。
4 土壤激发的微生物机理
土壤微生物是土壤生物中最活跃的部分,包括细菌、真菌、藻类、原生动物、病毒及类病毒等。微生物作为土壤激发效应的推动者,在土壤养分循环中起着至关重要的作用。关于微生物是如何影响激发效应,目前还没有形成一致的结论,目前被广泛认可的理论主要有以下三个。
4.1 共代谢理论
微生物可能通过共代谢途径影响激发效应[48]。共代谢是指微生物从其他底物获取大部分或全部碳源和能源后,通过分泌酶或有机酸等将同一介质中有机化合物降解的过程。土壤微生物的一个重要特点是其酶的特异性,即微生物会产生不同的酶来降解不同的物质。微生物的生长和伴随酶的产生而促进SOM降解,从而触发激发效应。Asmar等[49]研究发现向土壤中添加葡萄糖后,土壤固有有机氮矿化与胞外酶活性(特别是总蛋白酶和可溶性蛋白酶)显著相关。此外,Schmitt等[50]指出当土壤中有效氮富集时,脱氢酶活性增加,氨化细菌和原生菌数量也增加,而土壤中总有机碳(TOC)数量减少。增加微生物底物的有效性可诱导酶的产生或增加酶的活性,从而导致土壤有机物的共代谢分解。因此,外源添加有机物料的多样性越高,微生物产生的胞外酶的种类也就越丰富,激发效应也更明显。
4.2 微生物热区(MHS)理论
MHS是激发效应发生的重要场所[51]。MHS是指与土壤平均状态相比,微生物周转率更快及微生物-环境因子相互作用更强的一小块区域[51]。MHS主要指根际(rhizosphere)、碎屑周际(detritusphere)和动物通道(drillosphere)等区域[52]。尽管MHS只占土壤体积的一小部分(通常在1%~5%),但微生物代谢速率却比区域外高两个数量级,因此系统中的生物化学过程大部分发生在MHS[53]。热点的发生是短暂而迅速的。与微生物平均代谢速率相比,其发生会导致微生物周转率加快,由此可见激发效应和热点的发生密不可分。微生物的丰度与活性受到土壤中有效C或N的制约,外源有机物料的输入激活土壤中微生物活性并产生MHS[54]。MHS的产生和形成需要将有效C或N或其他限制性物质传递到微生物细胞中,或者将微生物运输到底物附近。一般来说,可溶性C转运到微生物的潜在机制有三种[53]:1)在已存在的热区直接投入有机物;2)平流聚集(advection-mass flow, AMF)对水中溶解有机物的输送;3)扩散传输。微生物对C或N的利用远远快于C或N的扩散输送。因此,AMF成为C或N运输到MHS的主要方式。微生物向底物的转运主要与形成丝状物的微生物有关(主要包括真菌、一些蓝藻、链霉菌和其他放线菌)[11];与细菌相比,真菌能够更有效到达C或N富集区域,因为真菌菌丝能够释放疏水蛋白降低表面张力,从而具有穿透土壤孔隙中水膜的能力[55]。外源物质输入土壤后,微生物会优先利用易分解的有机物质,但不易分解的有机物质依然存在[56]。因此,由于底物数量(质量)的下降,热区内微生物活性也降低。这就导致在热点结束时剩余微生物之间的竞争加剧。Feng等[57]研究已经证实热点结束时根际区域PLFA含量(磷脂脂肪酸,几乎所有活体细胞膜的主要成分)下降4.0%~28.6%。另外,真菌和格兰氏阴性细菌的PLFAs比革兰氏阳性细菌减少更为强烈[58],这可能是由于后者在热点结束时具有更高的竞争能力。外源底物耗尽和热点结束时的微生物竞争加剧经常会触发激发效应[59]。
4.3 微生物能量与物质转化理论
微生物增殖与激活需要底物和能量,而土壤中有机碳(SOC)和有机氮(SON)的生物可利用性是影响土壤微生物活性的重要限制因子。外源物质通过影响土壤中微生物可利用碳/氮和能量,驱动SOC/SON在矿化与固持间转化,进而影响激发效应[60]。土壤中SOC和SON及其动态变化主要取决于土壤原有有机碳、氮的分解以及外源有机质输入、降解之间的平衡[61]。外源物质进入土壤后为微生物的繁殖提供大量的碳/氮源和能源,并通过激发效应改变土壤结构、养分含量以及微生物活性,进而引发原位土壤有机碳/氮的周转改变[62]。当新鲜有机物料进入土壤后导致微生物群落显著变化,并使以前处于休眠状态的微生物大量增殖[63]。但微生物对能源的利用存在显著的竞争关系,当有充足的有机物料时,采用生存策略的微生物首先利用能源物质进行快速生长和繁殖[64]。随着资源的快速消耗,r生存策略的微生物活性降低,而k生存策略的微生物数量增加、活性增强。因为k生存策略的微生物主要是真菌,它们是影响土壤有机质分解的最主要类群[65]。它们可以通过菌丝从非热点区域获取养分[66],还可以分泌胞外酶分解难以被r生存策略的微生物利用的有机质[67]。无机氮肥的添加所导致的激发效应,可能与氮肥添加后微生物代谢的有效SOM的组成与数量发生变化有关[68],从而影响微生物的生存能力和活性[69]。但无机氮肥添加对SOM的影响存在分歧[70-72]。这可能与土壤中碳/氮利用效率(CUE/NUE)、被激发的碳/氮组分属性以及外源有机物料组成有关。此外,无机氮肥输入后导致土壤有效氮富集,对高氮需求的微生物大量繁殖,如放线菌、变形杆菌和某些与N相关微生物[73,74];而在营养贫瘠的土壤中则以疣微菌门起主导作用,其丰度与难降解C化合物循环呈正相关,与N代谢呈负相关[75]。系统中C/N相对含量对激发效应的响应机制,则可能与某些酸杆菌门丰度变化有关[76]。无机氮肥及有机物料种类的添加会影响系统中有效C/N的相对含量,也是决定特异性土壤微生物矿化与固持的关键因子。Finn等[77]研究土壤C/N比与施肥的关系,发现与不施氮相比,低SOC含量和高C/N比的土壤施入氮肥后氮素正激发且SOM含量减少,而高SOC含量和低C/N比的土壤则相反。鉴此,笔者认为土壤氮激发模式中,外源添加物对土壤C/N比的影响可能是土壤氮激发效应作用的关键,当系统中有效C冗余时,促进土壤有机氮的分解,从而表现正的激发效应;而有效C不足但有效N富集时,固氮微生物活性相对增强,从而出现负的激发效应。
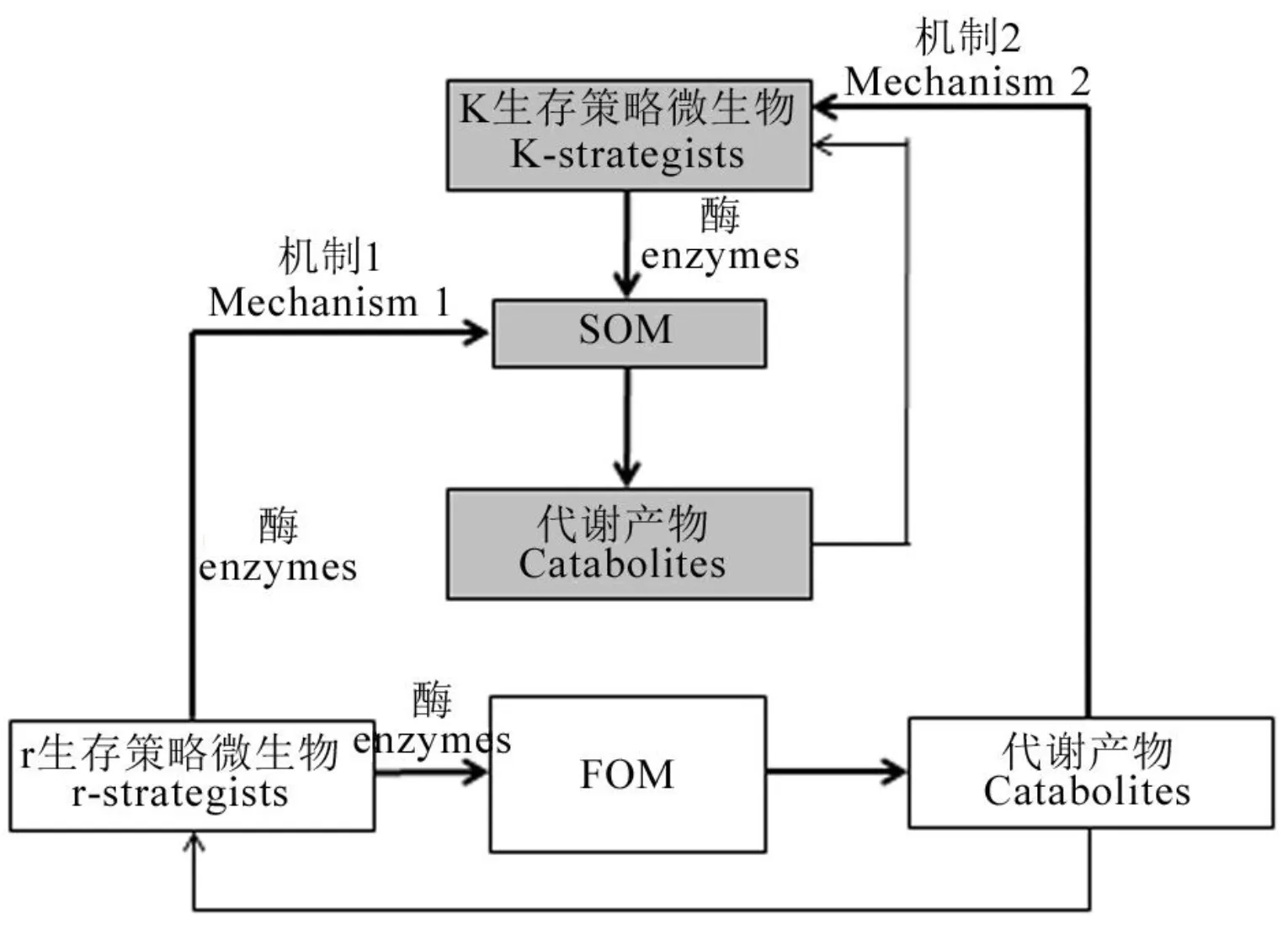
机制1:r生存策略微生物为分解外源有机物料(FOM)而产生的胞外酶同时一定程度有效降解土壤固有有机质(SOM)。这种机制的强度取决于FOM和SOM之间的生化相似性。FOM的化学多样性越高,产生的酶的多样性和激发效应发生的概率就越高。机制2:SOM分解酶的产生触发了激发效应。这种机制的强度依赖于r和k生存策略微生物之间对FOM的竞争。
5 问题与展望
过去的许多研究着重探讨某些单一因子的激发效应,只是单纯考虑到氮肥的施用对土壤有机物质矿化的影响,往往忽略了影响因子之间互作效应,随着对激发效应慢慢深入的研究,人们也开始意识到氮肥与外源添加有机物料相互作用进而影响土壤有机氮矿化而对植物吸氮量或者生物量的影响;在以往的研究中,对于种植植物土壤中的激发效应研究也较少,对于根际激发效应及根系分泌物对激发效应的影响,国内的报道则少之又少。另外一点,生产中,关于激发效应对作物产量的影响及如何利用激发效应,合理运筹氮肥,提高氮肥利用效率,保证作物高产高效,目前还没有明确的观点及相关报道。
鉴此,笔者认为以下几个方面研究仍有待进一步开展:
1)明确大田种植条件下,土壤-植物的根际激发效应及其微生物学机制。目前大量的研究仍基于在实验室单独培养的独立试验,在实际种植条件下,植物生长、根际发育、田间气候等因子对于土壤激发效应的综合效应仍未明确;哪些因子对于土壤激发效应具有主导效应,多因子条件下,是否对于激发作用具有互补效应,土壤中哪些微生物参与了激发效应,是如何影响激发效应,这对于深化激发效应的认识及进一步探明激发效应的机制都具有重要意义。
2)明确激发效应与作物氮肥利用的关系,从激发的角度为合理施肥,提高氮肥利用效率和减少环境污染提供新的途径。氮是植物生长必不可少的营养元素,过去几十年,为了提高作物产量,氮肥施用量越来越大,造成肥料浪费和环境污染,关于从氮素转化相关酶的活性、氮素利用与光合作用及干物质积累与产量形成等方面研究氮素利用效率的较多,但是从土壤激发效应的角度考虑氮素利用效率的报道较少,因此,此研究内容具有一定的前瞻性。
3)加强激发效应与微生物机理研究,目前对C/N转化过程及其功能微生物的研究已有大量报道,但对外加有机物料或无机氮肥激发后相关功能微生物的种类和数量的变化却鲜有报道。一般认为,外加有机物料分为高生物量(高C/N)和低生物量(低C/N)两类,但是无机氮肥的投入会影响系统中C/N的相对含量。因此,微生物对有机物料类及其后续有机物分解种类的响应机制是否因添加无机氮肥而有所差异以及差异的原因都有待更深入的研究。
通过对以上问题的阐述,对进一步完善激发效应的测定方法,深化对激发效应的认识,明确不同外源添加有机物料和氮肥的合理配施,提高氮肥利用效率,实现作物高产高效,减少对生态系统的负面作用等具有一定的理论和实践意义。
[1] 马雪峰, 高旻, 程治军. 植物氮素吸收与利用的分子机制研究进展. 作物杂志, 2013, 25(4): 32-38.
Ma X F, Gao F, Cheng Z J. Molecular regulation for uptake and utilization of nitrogen in plant., 2013, 25(4): 32-38. (in Chinese with English abstract)
[2] Wang H Q, Chen J J. An united model and simulation of nitrogen transport, uptake and transformation in soil-crop system., 1998, 8(1): 2037-2046.
[3] 张超兰, 徐建民. 外源营养物质对表征土壤质量的生物学指标的影响. 广西农业生物科学, 2004, 23(1): 81-85.
Zhang C L, Xu J M. Effect of organic and inorganic fertilizer application on the bioindicators of soil quality., 2004, 23(1): 81-85. (in Chinese with English abstract)
[4] Lohnis F. Nitrogen availability of green manures., 1926, 22(4): 253-290.
[5] Broadbent, Francis E. Some factors affecting nitrogen transformations and organic matter decomposition in soils., 1948, 12(3): 246-249.
[6] Bingeman C W, Varner J E, Martin W P. The effect of the addition of organic materials on the decomposition of an organic soil., 1953, 17(1): 34-38.
[7] Kuzyakov Y, Friedel J K. Review of mechanisms and quantification of priming effects., 2000, 32(1): 1485-1498.
[8] 李世清, 李生秀. 淹水培养条件下铵态氮肥对土壤氮素的激发效应. 植物营养与肥料学报, 2001, 7(4): 361-367.
Li S Q, Li S X. Priming effect of ammonium nitrogen fertilizer on soil nitrogen under waterlogged condition., 2001, 7(4): 361-367. (in Chinese with English abstract)
[9] 黄文昭, 赵秀兰, 朱建国, 谢祖彬, 朱春梧. 土壤碳库激发效应研究. 土壤通报, 2007, 38(1): 149-154.
Huang W Z, Zhao X L, Zhu J G, Xie C W. Priming effect of soil carbon pools., 2007, 38(1): 149-154. (in Chinese with English abstract)
[10] 朱丽霞, 章家恩, 刘文高. 根系分泌物与根际微生物相互作用研究综述. 生态环境, 2003, 12(1): 102-105.
Zhu L X, Zhang J E, Liu W G. Review of studies on interactions between root exudates and rhizopheric microorganisms., 2003, 12(1): 102-105. (in Chinese with English abstract)
[11] 吕殿青, 张树兰, 杨学云. 外加碳、氮对土壤氮矿化、固定与激发效应的影响. 植物营养与肥料学报, 2007, 13(2): 223-229.
Lv D Q, Zhang S L, Yang X Y. Effect of supplying C and N on the mineralization, immobilization and priming effect of soil nitrogen., 2007, 13(2): 223-229. (in Chinese with English abstract)
[12] 娄燕宏, 诸葛玉平, 魏猛,晁赢, 刘安辉. 外源有机物料对土壤氮矿化的影响. 土壤通报, 2009, 40(2): 315-320.
Lou Y H, Zhuge Y P, Wei M, Chao Y, Liu A H. Effect of extraneous organic materials on the mineralization of nitrogen in soil., 2009, 40(2): 315-320. (in Chinese with English abstract)
[13] 李紫燕. 黄土高原典型土壤有机氮矿化及铵态氮对土壤氮素激发效应的研究. 杨凌: 西北农林科技大学, 2006.
Li Z Y. Study on the priming effect caused by ammonium and mineralization of organic nitrogen in the typical soils on loess plateau. Yangling: Northwest Agricultural and Forest University, 2006. (in Chinese with English abstract)
[14] 沈善敏. 无机氮对土壤氮矿化与固定的影响-兼论土壤氮的“激发效应”. 土壤学报, 1986, 23(1): 10-16.
Shen S M. The effect of mineral nitrogen on the minieralization and immobilization of soil nitrogen., 1986, 23(1): 10-16. (in Chinese with English abstract)
[15] 徐兴良, Kuzyakov Y, 孙悦. 根际激发效应的发生机制及其生态重要性. 植物生态学报, 2014, 38(1): 62-75.
Xu X L, Kuzyakov Y, Sun Y. Mechanisms of rhizosphere priming effects and their ecological significance., 2014, 38(1): 62-75. (in Chinese with English abstract)
[16] Talbot J M, Allison S D, Treseder K K. Decomposers in disguise: mycorrhizal fungi as regulators of soil C dynamics in ecosystems under global change., 2008, 22(6): 955-963.
[17] Fontaine S, Bardoux G, Abbadie L, Mariotti A. Carbon input to soil may decrease soil carbon content., 2010, 7(4): 314-320.
[18] Blagodatskaya E, Kuzyakov Y. Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure: critical review., 2008, 45(2): 115-131.
[19] Drake J E, Darby B A, Giasson M A, Kramer M A. Stoichiometry constrains microbial response to root exudation-insights from a model and a field experiment in a temperate forest., 2013, 10(2): 821-838.
[20] Fu S, Cheng W. Rhizosphere priming effects on the decomposition of soil organic matter in C4and C3grassland soils., 2002, 238(2): 289-294.
[21] Hamer U, Marschner B. Priming effects in different soil types induced by fructose, alanine, oxalic acid and catechol additions., 2005, 37(3): 445-454.
[22] Stanford G, Smith S J. Nitrogen mineralization potentials of soils., 1972, 36(3): 465-472.
[23] 刘小兰, 李世清. 土壤中的氮素与环境. 干旱地区农业研究, 1998, 29(4): 36-43.
Liu X L, Li S Q. Nitrogen and environment in soil., 1998, 29(4): 36-43. (in Chinese with English abstract)
[24] 赵琳, 李世清, 李生秀, 张兴昌, 吕丽红, 邵明安. 半干旱区生态过程变化中土壤硝态氮累积及其在植物氮素营养中的作用. 干旱地区农业研究, 2004, 22(4): 14-20.
Zhao L, Li S Q, Li S X, Zhang X C, Lv L H, Shao M A. Accumulation of soil nitrate nitrogen in the process of ecological and its effcts in plant nitrogen nutrition in semiarid areas., 2004, 22(4): 14-20. (in Chinese with English abstract)
[25] Waring S A, Bremner J M. Ammonium Production in soil under waterlogged conditions as an index of nitrogen availability., 1964, 201: 951-952.
[26] Bodelier P L E, Wijlhuizen A G, Blom C W P M, Laanbroek H J. Effects of photoperiod on growth of and denitrification by Pseudomonas chlororaphis in the root zone of Glyceria maxima, studied in a gnotobiotic microcosm., 1997, 190(1): 91-103.
[27] Jenkinson D S, Fox R H, Rayner J H. Interactions between fertilizer nitrogen and soil nitrogen-the so-called priming effect., 1985, 36(3): 425-444.
[28] Jansson S L. Use of15N in studies of soil nitrogen., 1971, 2(10): 129-166.
[29] Jansson S L, Persson J. Mineralization and immobilization of soil nitrogen// Stevenson F J. Nitrogen in Agricultural Soils. Madison, USA: ASA, 1982: 229-252.
[30] Hauck R D, Bremner J M. Use of tracers for soil and fertilizer nitrogen research., 1976, 28(23): 219-266.
[31] Singh J S, Raghubanshi A S, Singh R S, Srivastava S C. Microbial biomass acts as a source of plant nutrients in dry tropical forest and savanna., 1989, 338(6215): 499-500.
[32] 陈曦. 秸秆还田对土壤有机质元素组成及化学结构的影响. 合肥: 安徽农业大学, 2016.
Chen X. Effects of straw returning on the composition and chemical structure of soil organic matter. Hefei: Anhui Agricultural University, 2016. (in Chinese with English abstract)
[33] Dalenberg J W, Jager G. Priming effect of some organic additions to14C-labelled soil., 1989, 21(3): 443-448.
[34] 严德翼, 周建斌, 邱桃玉, 杨绒, 马勤安. 黄土区不同土壤类型及土地利用方式对土壤氮素矿化作用的影响. 西北农林科技大学学报: 自然科学版, 2007, 35(10): 103-109.
Yan D Y, Zhou J B, Qiu T Y, Yang R, Ma Q A. Effects of the different soil types and land use on nitrogen mineralization on the Loess Plateau., 2007, 35(10): 103-109. (in Chinese with English abstract)
[35] Bird J A, Herman D J, Firestone M K. Rhizosphere priming of soil organic matter by bacterial groups in a grassland soil., 2011, 43(4): 718-725.
[36] Nottingham A T , Griffiths H , Chamberlain P M , Stott A W, Tanner E V J. Soil priming by sugar and leaf-litter substrates: A link to microbial groups., 2009, 42(3): 183-190.
[37] Falchini L, Naumova N, Kuikman P J, Bloem J, Nannipieri P. CO2evolution and denaturing gradient gel electrophoresis profiles of bacterial communities in soil following addition of low molecular weight substrates to simulate root exudation., 2003, 35(6): 775-782.
[38] Martin T, Anderson L, Goates R. Influence of the chemical composition of organic matter on the development of mold flora in soil., 1942, 54(4): 297.
[39] Langer U, Rinklebe J. Priming effect after glucose amendment in two different soils evaluated by SIR- and PLFA-technique., 2011, 37(3): 465-473.
[40] 廖中建, 黎理.土壤氮素矿化研究进展. 湖南农业科学, 2007, 4(1): 56-59.
Liao Z J, Li L. Progress on mineralization of soil nitrogen., 2007, 4(1): 56-59. (in Chinese with English abstract)
[41] Jones D L, Hodge A, Kuzyakov Y. Plant and mycorrhizal regulation of rhizodeposition., 2004, 163(3): 459-480.
[42] Kuzyakov Y, Xu X. Competition between roots and microorganisms for nitrogen: mechanisms and ecological relevance., 2013, 198(3): 656-669.
[43] Bodelier P L E, Wijlhuizen A G, Blom C W P M, Haanbroek H J. Effects of photoperiod on growth of and denitrification by Pseudomonas chlororaphis in the root zone of Glyceria maxima, studied in a gnotobiotic microcosm., 1997, 190(1): 91-103.
[44] Kuzyakov Y. Review: Factors affecting rhizosphere priming effects., 2002, 165(4): 66-70.
[45] Kuzyakov Y, Cheng W. Photosynthesis controls of rhizosphere respiration and organic matter decomposition., 2001, 33(14): 1915-1925.
[46] Warembourg F R, Estelrich H D. Plant phenology and soil fertility effects on below-ground c arbon allocation for an annual (Bromus madritensis) and a perennial (Bromus erectus) grass species., 2001, 33(10):1291-1303.
[47] Cheng W, Johnson D W. Rhizosphere effects on decomposition: Controls of plant species, phenology, and fertilization., 2003, 67(20): 1418-1427.
[48] Kuzyakov Y, Bol R. Sources and mechanisms of priming effect induced in two grassland soils amended with slurry and sugar., 2006, 38(4): 747-758.
[49] Asmar F, Eiland F, Nielsen N E. Effect of extracellular-enzyme activities on solubilization rate of soil organic nitrogen., 1994, 17(1): 32-38.
[50] Schmitt L, Mueller K, Ahrens E. Chemical and microbiological changes in a Rigosole after mineral fertilization in long-term field experiments and short-term aerobic incubation trials., 1991, 41(84): 191-225.
[51] Kuzyakov Y. Priming effects: Interactions between living and dead organic matter., 2010, 42(9): 1363-1371.
[52] Nannipieri P, Ascher J, Ceccherini M T, Landi L, Pietramellara G, Renella G. Microbial diversity and soil functions., 2010, 54(4): 655-670.
[53] Kuzyakov Y , Blagodatskaya E . Microbial hotspots and hot moments in soil: Concept & review., 2015, 83(20): 184-199.
[54] Schimel J P, Weintraub M N. The implications of exoenzyme activity on microbial carbon and nitrogen limitation in soil: A theoretical model., 2003, 35(4): 549-563.
[55] Talbot, Nicholas J. Fungal biology: Coming up for air and sporulation., 1999, 398(6725): 295-296.
[56] Theuerl S, Buscot F. Laccases: toward disentangling their diversity and functions in relation to soil organic matter cycling., 2010, 46(3): 215-225.
[57] Feng X, Simpson M J. Temperature and substrate controls on microbial phospholipid fatty acid composition during incubation of grassland soils contrasting in organic matter quality., 2009, 41(4): 804-812.
[58] Pietri J C A, Brookes P C. Substrate inputs and pH as factors controlling microbial biomass, activity and community structure in an arable soil., 2009, 41(7): 1396-1405.
[59] Fontaine S, Mariotti A, Abbadie L. The priming effect of organic matter: a question of microbial competition?, 2003, 35(6): 837-843.
[60] Sørensen L H. Rate of decomposition of organic matter in soil as influenced by repeated air drying-rewetting and repeated additions of organic material., 1974, 6(5): 287-292.
[61] 刘德燕, 宋长春. 外源氮输入对土壤有机碳矿化和凋落物分解的影响. 土壤通报, 2008, 39(3): 675-680.
Liu D Y, Song C C. Effects of elevated nitrogen supply on soil organic carbon mineralization and litter decomposition., 2008, 39(3): 675-680. (in Chinese with English abstract)
[62] 葛晓改, 周本智, 肖文发, 王小明, 曹永慧. 生物质炭输入对土壤碳排放的激发效应研究进展. 生态环境学报, 2016, 25(2): 339-345.
Ge X G, Zhou B Z, Xiao W F, Wang X M, Cao Y H. Priming effect of biochar addition on soil carbon emission: A review., 2016, 25(2): 339-345. (in Chinese with English abstract)
[63] De Nobili M, Contin M, Mondini A C, Brookes P C. Soil microbial biomass is triggered into activity by trace amounts of substrate., 2001, 33(9): 1163-1170.
[64] Moore-Kucera J, Dick R P. Application of13C-labeled litter and root materials for in situ decomposition studies using phospholipid fatty acids., 2008, 40(10): 2485-2493.
[65] Fontaine S, Henault C, Aamor A. Fungi mediate long term sequestration of carbon and nitrogen in soil through their priming effect., 2011, 43(1): 86-96.
[66] Otten W, Hall D, Harris K, Pitz K, Young I M, Gilligam C A. Soil Physics, Fungal Epidemiology and the Spread of Rhizoctonia solani., 2001, 151(2): 459-468.
[67] Blagodatskaya E V, Blagodatsky S A, Anderson T H, Yuzyakov Y. Priming effects in Chernozem induced by glucose and N in relation to microbial growth strategies., 2007, 37(1): 95-105.
[68] Blagodatsky S A, Richter O. Microbial growth in soil and nitrogen turnover: A theoretical model considering the activity state of microorganisms., 1998, 30(13): 1743-1755.
[69] Sinsabaugh R L, Carreiro M M, Repert D A. Allocation of extracellular enzymatic activity in relation to litter composition, N deposition, and mass loss., 2002, 60(1): 1-24.
[70] Cusack D F, Torn M S, Mcdowell W H, Silver W L. The response of heterotrophic activity and carbon cycling to nitrogen additions and warming in two tropical soils., 2010, 16(9): 2555-2572.
[71] Khan S A, Mulvaney R L, Ellsworth T R, Boast C W. The myth of nitrogen fertilization for soil carbon sequestration., 2007, 36(6): 1821.
[72] Grandy A S, Salam D S, Wickings K, McDaniel M D, Culman S W, Snapp S S. Soil respiration and litter decomposition responses to nitrogen fertilization rate in no-till corn systems., 2013, 179(20): 35-40.
[73] Hartmann M, Frey B, Mayer J, Mader P, Widmer F. Distinct soil microbial diversity under long-term organic and conventional farming., 2015, 9(5): 1177-1194.
[74] Jimenez-Bueno N G, Valenzuela-Encinas C, Marsch R, Ortiz-Gutierrez D, Verhulst N. Bacterial indicator taxa in soils under different long-term agricultural management., 2016, 120(4): 921-933.
[75] Fierer N, Ladau J, Clemente J C, Leff J W, Owens S M, Pollard K S, Knight R. Reconstructing the Microbial Diversity and Function of Pre-Agricultural Tallgrass Prairie Soils in the United States., 2013, 342(6158): 621-624.
[76] Fierer N, Lauber C L, Ramirez K S, Zaneveld J, Bradford M A, Knight R. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients., 2012, 6(5): 1007-1017.
[77] Finn D, Page K, Catton K, Strounina E, Kienzle M, Robertson F, Dalal R. Effect of added nitrogen on plant litter decomposition depends on initial soil carbon and nitrogen stoichiometry., 2015, 91(3): 160-168.
Research Progress of Soil Nitrogen Priming Effect and Its Microbial Mechanisms
LIU Shaowen, YIN Min, CHU Guang, XU Chunmei, WANG Danying, ZHANG Xiufu, CHEN Song*
(,,;,:)
The soil nitrogen priming effect is the key mechanism in the process of soil nutrient release and plant nutrient absorption. The insight into soil priming effect will not only help make more reasonable nitrogen fertilizer operations in agricultural production, thus improving the utilization rate of nitrogen fertilizer, but also conduces to the assessment and control of environmental pollution, so as to provide effective pollution control methods. On the basis of the introduction of the concept and mechanism of soil nitrogen priming effect, we introduce the prevailing determination methods of the current nitrogen priming effect and its advantages and disadvantages of practical application. The effects of exogenous additives (inorganic nitrogen fertilizer, organic materials and root exudates) on soil nitrogen stimulation and their microbial mechanisms were emphatically expounded. The effect of exogenous additives on soil C/N ratio may be the key factor to soil nitrogen stimulation. When available C is redundant, the application of inorganic nitrogen fertilizer promotes the decomposition of soil organic nitrogen, thus showing a positive priming effect. On the contrary, when available C is insufficient but available N is enriched, the activity of nitrogen-fixing microorganisms is relatively enhanced, which results in a negative priming effect. Microorganisms are the promoters of priming effects. We also analyzed the possible mechanism of microorganisms in the process of soil nitrogen stimulation through three theoretical hypotheses: 1) co-metabolism theory; 2) microbial hotspots; 3) microbial energy and material transformation theory. Through the discussion, we can deepen the understanding of the priming effect, and provide an effective way to further clarify the microbial mechanism of the soil priming effect, the interaction effect between factors and the improvement of nitrogen use efficiency through the priming effect.
soil; priming effect; nitrogen; organic materials; microorganism; root exudates
S143.1; S181; S511.061
A
1001-7216(2019)04-0303-10
10.16819/j.1001-7216.2019.8091
2018-08-15;
2019-02-15。
国家重点研发计划资助项目(2016YFD0300507);国家自然科学基金资助项目(31671638,31671630)。

