基于基因多态性建立肾功能不全患者华法林稳态剂量的预测模型
刘艳丽,林蓉,冯永刚,许晓丽(.西安交通大学第一附属医院药学部,西安7006;2.西安交通大学医学部,西安 7006)
肾功能不全是冠心病患者心血管事件发生率和死亡率增加的独立危险因素[1],另外肾功能不全患者存在高凝状态,常需要预防性抗凝治疗,然而新型口服抗凝药物大部分经肾脏排泄,肾功能不全患者易在体内蓄积,增加药物不良反应,所以华法林仍然是长期抗凝患者的常用药物[2-3]。2012年改善全球肾病预后组织(KDIGO)临床实践指南建议:表现为肾病综合征的膜性肾病患者,如血浆白蛋白明显降低并伴有其他血栓危险因素时可口服华法林进行预防性抗凝治疗(证据等级2C)[4],但指南中对肾功能不全患者服用华法林的剂量和抗凝强度等未给出明确的建议。为了解华法林在西安交通大学第一附属医院(简称我院)肾内科患者中的应用情况,探讨肾功能不全患者服用华法林的稳态剂量,为临床在肾功能不全患者华法林抗凝治疗方案上提供依据,笔者通过回顾性分析,对我院肾内科服用华法林的肾功能不全患者进行调研。
由于华法林剂量个体差异大且受多种因素影响,其治疗窗窄,剂量过大导致出血风险,剂量不足达不到预防血栓形成的治疗目的。除年龄、体质量等影响因素以外,遗传因素如细胞色素P4502C9(CYP2C9)和维生素K环氧化物还原酶复合体1(VKORC1)基因多态性在华法林稳态剂量的变异中也起到重要的作用[5-6]。另外,就肾功能不全对华法林的稳态剂量是否有影响,国内未见报道。本研究采用多元回归的方法综合分析,初步建立了肾功能不全患者华法林稳态剂量的预测模型,以期为临床肾功能不全患者使用华法林提供用药参考。
1 资料与方法
1.1 研究对象
选取我院2016年6月-2018年6月肾内科服用华法林的肾功能不全患者,涉及疾病包括原发性肾小球肾炎、慢性肾盂肾炎、高血压肾小动脉硬化、糖尿病肾病、继发性肾小球肾炎、肾小管间质病变、遗传性肾脏疾病。入选标准:(1)汉族,18周岁以上,(2)国际标准化比值(INR)控制在1.5~3.0且稳态达标。排除标准:(1)使用华法林禁忌;(2)有出血倾向的患者、肿瘤患者、妊娠期患者、甲状腺功能亢进患者。
1.2 方法
1.2.1 华法林稳态剂量释义 患者服用华法林2~3 d后开始每日或隔日监测INR值,并根据INR值调整给药剂量,连续3次的INR值在1.5~3.0之间的华法林剂量,即为华法林的稳态剂量。达稳态剂量后,可每4周监测1次INR值。若需调整华法林剂量,则应重复上述步骤直至INR值再次稳定于控制范围内。
1.2.2 肾功能不全及分期 肾功能不全是指由多种原因引起的肾小球严重破坏,使身体在排泄代谢废物和调节水电解质、酸碱平衡等方面出现紊乱的临床综合征。主要病因有原发性肾小球肾炎、慢性肾盂肾炎、高血压肾小动脉硬化、糖尿病肾病、继发性肾小球肾炎、肾小管间质病变、遗传性肾脏疾病以及长期服用解热镇痛剂及接触重金属等。近年来,根据国际公认的K/DOQI指南[7],临床按照肾小球滤过率(eGFR)的水平将肾功能不全分为5期,1期:eGFR正常或升高[eGFR≥90 mL/(min·1.73 m2)],2期:eGFR轻度下降[eGFR=60~90 mL/(min·1.73 m2)],3期:eGFR中度下降[eGFR=30~59 mL/(min·1.73 m2)],4期:eGFR重度下降[eGFR=15~29 mL/(min·1.73 m2)],5期:肾衰竭[eGFR<15 mL/(min·1.73 m2)]。
1.2.3 资料收集 记录患者的年龄、性别、体质量、身高、体质量指数(BMI)、INR、华法林稳态剂量、CYP2C9*3(1075A>C)和VKORC1-1639G>A基因型、eGFR等。
1.2.4 基因检测 采用荧光染色原位杂交及染色体核型分析方法,取患者2 mL外周血置于EDTA抗凝管中避免凝血或溶血,检测CYP2C9*3(1075A>C)、VKORC1-1639G>A基因型。操作主要流程:样本DNA抽提-加样聚合酶链式反应扩增,然后将带生物素标记的扩增产物与固定在醛基基片上的CYP2C9*3(1075A>C)、VKORC1-1639G>A基因型检测探针进行特异杂交反应,使特异性杂交信号呈现出颜色,通过对芯片进行扫描,得到样品DNA扩增产物与每个基因位点的野生型和突变型探针杂交形成的杂交图像;经软件分析该图像,判断待检样品的基因型。
1.2.5 统计学方法 应用SPSS 20.0统计软件进行统计分析,所有数据先进行正态性检验。对正态分布样本,计量资料以±s表示,计数资料采用频数和百分比表示;组间计量资料的比较采用配对资料t检验,对非正态分布样本采用卡方检验或Fisher确切概率法,检验水准α=0.05。相关性分析采用Pearson相关性检验。遗传平衡的符合程度采用Hardy-Weinberg平衡检验,采用多元线性回归方法确立华法林剂量预测模型。P<0.05为差异有统计学意义。
1.2.6 验证试验 另按“1.1”项下方法选取25例患者,比较其预测模型剂量与实际稳态剂量的差异。
2 结果
2.1 入选患者的一般情况
共入选患者103例,大部分为肾功能不全的2、3期患者,其一般情况见表1。

表1 患者一般情况Tab 1 General situation of patients
2.2 患者基因型频率及等位基因分布
入选的103例患者中,CYP2C9*3(1075A>C)AA基因型95例(占总数的92.23%),CYP2C9*3(1075A>C)AC基因型8例(占总数的7.77%),CYP2C9*3(1075A>C)CC基因型0例,Hardy-Weinberg平衡检验χ2=0.995,P>0.05;VKORC1-1639G>AAA基因型81例(占总数的78.64%),VKORC1-1639G>A GA基因型21例(占总数的20.39%),VKORC1-1639G>A GG基因型1例(占总数的0.97%),Hardy-Weinberg平衡检验χ2=0.853,P>0.05。以上各基因型分布均符合Hardy-Weinberg遗传平衡定律,提示所选取的研究对象具有群体代表性,具有恒定性。患者基因型频率及等位基因分布见表2。
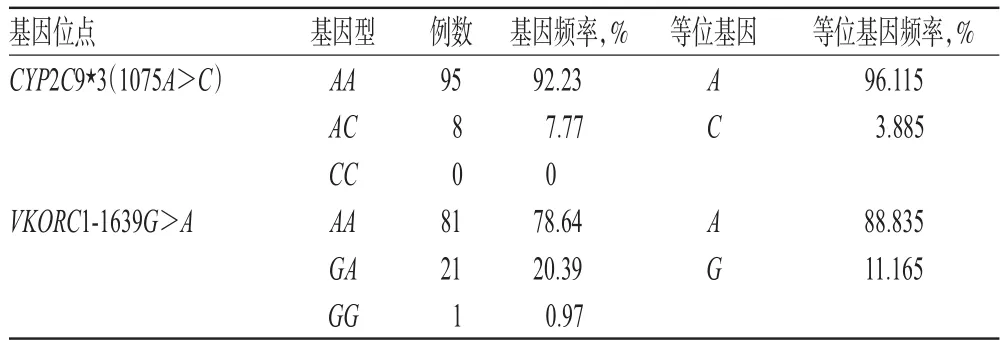
表2 患者基因型频率及等位基因分布Tab 2 Patient genotype frequency and allele distribution
2.3 华法林稳态剂量与基因型的相关性
CYP2C9*3(1075A>C)AA基因型患者的华法林平均稳态剂量(3.20±0.88)mg/d高于CYP2C9*3(1075A>C)AC基因型患者的华法林平均稳态剂量(2.17±0.13) mg/d,差异有统计学意义(P<0.05)。VKORC1-1639G>A AA基因型患者的华法林平均稳态剂量(2.89±0.08)mg/d低于VKORC1-1639G>A GA基因型患者的华法林平均稳态剂量(4.01±0.17)mg/d(P<0.05);由于VKORC1-1639G>A GG基因型患者只有1例,因此未列入统计。
2.4 华法林稳态剂量与性别的相关性
男性患者的华法林平均稳态剂量(3.16±0.11)mg/d,高于女性患者的华法林平均稳态剂量(3.07±0.13)mg/d,但差异无统计学意义(P=0.608>0.05)。
2.5 华法林稳态剂量与年龄、BMI、eGFR的相关性
通过Pearson相关性分析后显示,年龄与华法林稳态剂量呈负相关,R2=-0.482,P=0.000<0.05;eGFR与华法林稳态剂量呈正相关,R2=0.498,P=0.000<0.05;BMI与华法林稳态剂量无明显相关性,P=0.339>0.05,因此BMI未入选预测模型的因素变量。
2.6 华法林稳态剂量预测模型的建立
本研究对103例肾功能不全患者华法林稳态剂量与性别、年龄、CYP2C9*3(1075A>C)、VKORC1-1639G>A、eGFR等入选因素通过多元线性逐步回归法,得到最佳回归方程,多元线性回归结果见表3,回归方程汇总模型见表4。
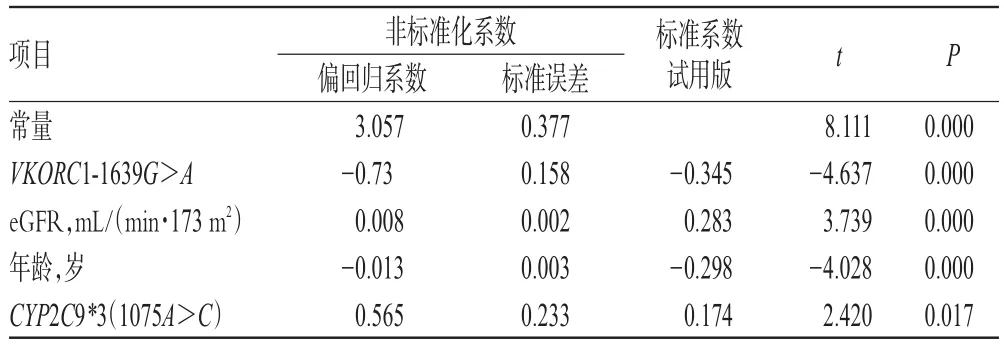
表3 多元线性回归结果Tab 3 Multiple linear regression results
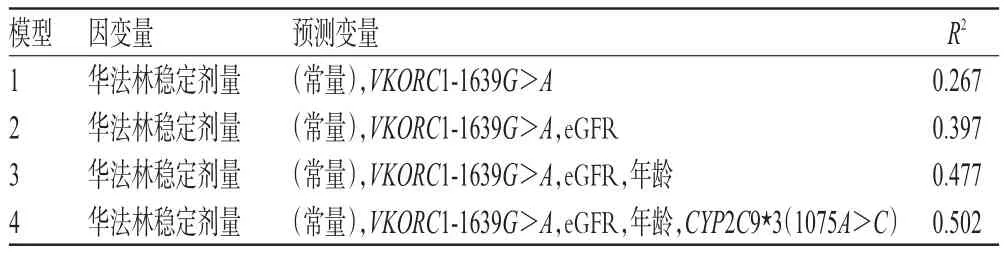
表4 回归方程汇总模型及其决定系数Tab 4 Related coefficient summary of the model
表3结果显示,华法林稳态剂量与年龄、eGFR、VKORC1-1639G>A、CYP2C9*3(1075A>C)有关,性别未进入预测模型。表4结果显示,华法林稳态剂量的最佳预测模型:华法林稳态剂量=3.057-0.73*VKORC1-1639G>A+0.08*肾小球滤过率-0.013*年龄+0.565*CYP2C9*3(1075A>C)(VKORC1-1639G>A:AA=1,GA=0,GG=0;CYP2C9*3(1075A>C):AA=1,AC=0;年龄为岁;eGFR单位为mL/(min·1.73 m2)(R2=0.502)。
2.7 验证结果
25例验证患者的预测模型剂量(3.12±0.56)mg/d与实际稳态剂量(3.06±0.93)mg/d差异无统计学意义(P>0.05)。
3 讨论
肾功能的衡量指标有很多,包括血尿素氮、血肌酐、eGFR等,其中血尿素氮受诸多因素影响,如蛋白质摄入量、发热及消化道出血等,所以血尿素氮不能单独作为衡量肾功能受损轻重的指标;血肌酐虽然比较稳定,但老年人、肌肉萎缩者的血肌酐水平偏低,不能很好地反映肾功能受损的程度,也不能单独作为衡量肾功能受损轻重的指标;近年来根据国际公认的K/DOQI指南[7],临床按照eGFR的水平作为肾功能不全分期的指标,将肾功能不全分为5期。
肾功能不全患者伴血浆白蛋白明显降低并伴有其他血栓危险因素时需预防性抗凝治疗[8]。然而新型口服抗凝药物存在价格昂贵、不适用于肾功能不全等患者、无特异性拮抗药等问题,故华法林仍然是目前长期抗凝患者的常用药物[9-10]。华法林在体内主要通过CYP2C9代谢,该酶主要由CYP2C9基因编码,其中CYP2C9*3是影响华法林代谢最主要突变型;VKORC1是催化氧化型维生素K向还原型维生素K转化的关键酶。国内外学者根据影响华法林的因素陆续建立各种华法林稳态剂量预测模型[11-12]。
本研究根据肾功能不全患者的临床特点和影响华法林使用剂量的因素,建立了华法林稳态剂量预测模型。在各因素中,BMI与华法林稳态剂量无明显相关性(P=0.339>0.05),因此BMI未入选预测模型的因素变量;年龄与华法林稳态剂量呈负相关(R2=-0.482,P=0.000<0.05);eGFR与华法林稳态剂量呈正相关(R2=0.498,P=0.000<0.05),与Ichihara N等[13]学者研究结果一致,基因多态性与华法林稳态剂量的相关性结果显示,CYP2C9*3(1075A>C)AA基因型患者华法林平均稳态剂量(3.20±0.88)mg/d显著高于CYP2C9*3(1075A>C)AC基因型患者华法林平均稳态剂量(2.17±0.13) mg/d,VKORC1-1639AA基因型患者华法林平均稳态剂量(2.89±0.08)mg/d显著低于VKORC1-1639GA基因型患者华法林平均稳态剂量(4.01±0.17)mg/d,与管文燕等学者[13]研究结果一致;性别对华法林稳态剂量的相关性结果显示,男性患者华法林稳态剂量(3.16±0.11)mg/d高于女性患者华法林稳态剂量(3.07±0.13)mg/d,但差异无统计学意义。综上所述,华法林稳态剂量的预测模型纳入了患者的年龄、eGFR、VKORC1-1639G>A和CYP2C9*3(1075A>C)。通过验证试验结果发现,该预测模型计算的预测剂量与实际稳态剂量无明显差异,对肾功能不全患者华法林抗凝治疗有一定指导作用。但本研究入选的患者大部分为肾功能不全的2、3期患者,所以该预测模型对肾功能不全的4、5期患者华法林稳态剂量的预测有待进一步商榷。本研究未分析不同年龄段以及不同肾病分期华法林稳态剂量的差异,样本量较少,后期还需进一步扩大样本量,并进行多中心研究。由于收集到验证数据较少,后期将增加患者进一步验证该模型,并分析不同年龄段以及不同肾病分期华法林稳态剂量的差异,使建立的模型更加精确,为临床在肾功能不全患者华法林抗凝治疗方案的选择上提供科学依据。

