HPLC法测定福多司坦原料药及其制剂中有关物质的含量Δ
郭志渊,赵欣庆,朱恒怡,袁 军(四川省食品药品检验检测院,成都 611731)
福多司坦于1988年由日本SS制药株式会社研发创制,1990年与同仁医药化工株式会社开展临床试验[1-2],2001年12月7日首次在日本上市[3]。福多司坦作为一类高效祛痰药物[4],应用前景较好。目前,国内制备福多司坦原料药的工艺有2种,一种是盐酸半胱氨酸与烯丙醇反应制得[5],另一种是盐酸半胱氨酸与3-卤代-1-丙醇反应制得[6]。国内上市的福多司坦口服固体制剂有片剂、胶囊剂及颗粒剂。
在福多司坦原料药及其制剂现行标准[7-9]中,有关物质检测方法虽各不相同,但均仅控制了未知杂质及福多司坦右旋异构体。然而,根据化学药物杂质研究的技术指导原则[10]要求,无论原料或制剂含量大于鉴定阈值的杂质都应进行鉴定,明确杂质的结构并对其限度进行研究。在2018年仿制药一致性评价中,为了区分福多司坦各仿制药工艺的差异及质量的优劣,笔者收集了相关文献[11-14]报道的福多司坦中的检测出的有关杂质,如半胱氨酸(杂质A)、胱氨酸(杂质B)、福多司坦亚砜(杂质C)、(2R,2'R)-3,3'-(丙基-1,3-二硫代)双(二氨基丙酸)(杂质E)、(-)-(R)-2-(3-羟丙基)氨基-3-(3-羟丙基硫代)丙酸(杂质F)、(-)-(R)-2-氨基-3-(3-氯丙基硫代)丙酸(杂质G),并采用高效液相色谱(HPLC)外标法及加校正因子的主成分自身对照法对福多司坦原料药及其仿制药生产企业生产的片剂、胶囊剂中的这些杂质进行定量分析,以期为福多司坦仿制药一致性评价提供参考。福多司坦及其杂质结构式见图1。

图1 福多司坦及其杂质结构式Fig 1 Structures of fudosteine and its impurities
1 材料
1.1 仪器
2695 HPLC仪(美国Waters公司);1260 HPLC仪(美国Agilent公司);CPA225D电子天平、A8000多参数测量酸度计(瑞士梅特勒-托利多公司)。
1.2 药品与试剂
福多司坦对照品(批号:100920-201802,纯度:99.5%)、杂质B对照品(批号:140632-200502,纯度:99.3%)均购自中国食品药品检定研究院;杂质A对照品(加拿大TRC公司,批号:2-MJJ-156-1,纯度:97.0%);杂质C对照品(美国CRTO公司,批号:C4X-14471-1709,纯度:98.7%);杂质E对照品(批号:WS-T170608X,纯度:95.9%)、杂质F对照品(批号:WS-T170110Z-1,纯度:95.6%)、杂质G对照品(批号:ES7818-4-P1,纯度:94.4%)均由本实验室自制;福多司坦原料药1(A企业,批号:FD160871,纯度:99.2%);福多司坦原料药2(批号:160806008,纯度:99.9%)、福多司坦胶囊2(批号:160910056,规格:0.2 g)均购自B企业;福多司坦原料药3(批号:H160404,纯度:99.4%)、福多司坦片1(批号:B160201161,规格:0.2 g)、福多司坦胶囊 1(批号:1607001,规格:0.2 g)均购自C企业;福多司坦原料药4(D企业,批号:160309-1,纯度:99.1%);福多司坦原料药5(批号:1610001,纯度:99.9%)、福多司坦片2(批号:057170101,规格:0.2 g)均购自E企业;福多司坦片3(F企业,批号:1607201,规格:0.2 g)、福多司坦片4(G企业,批号:160702,规格:0.2 g)、福多司坦胶囊3(H企业,批号:1606003,规格:0.2 g);己烷磺酸钠、乙腈为色谱纯,磷酸、磷酸二氢钾等为分析纯。
2 方法与结果
2.1 色谱条件
色谱条件1(用于检测杂质A、B、C):色谱柱为MGⅡC18(250 mm×4.6 mm,5 μm),流动相为0.12%己烷磺酸钠溶液(pH 2.0),流速为1.0 mL/min,检测波长为210 nm,柱温为35℃,进样量为20 μL。
色谱条件2(用于检测杂质E、F、G和其他未知杂质):色谱柱为Altech Altima C18(250 mm×4.6 mm,5 μm),流动相为0.05 mol/L磷酸盐缓冲液(A)-乙腈(B)-水(C),梯度洗脱,流速为0.5 mL/min,检测波长为200 nm,柱温为30℃,进样量为20 μL。梯度洗脱程序见表1。
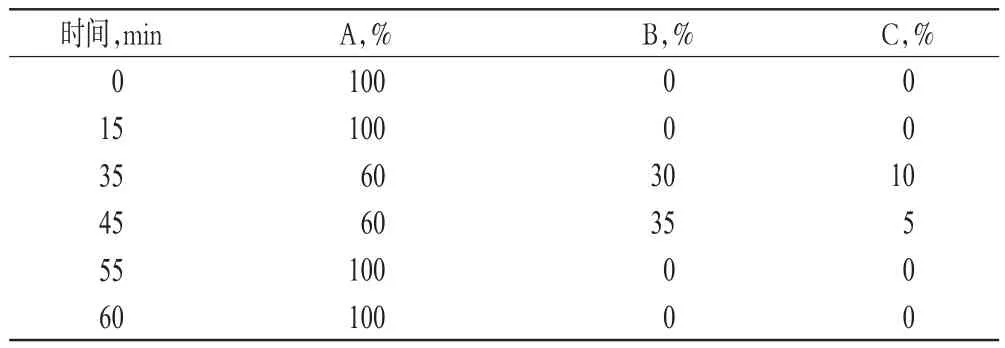
表1 梯度洗脱程序Tab 1 Gradient elution program
2.2 溶液的制备
2.2.1 杂质对照品溶液的制备 (1)杂质A、B、C混合对照品溶液:精密称取杂质A、B、C对照品适量,加0.12%己烷磺酸钠溶液溶解并稀释制成各杂质质量浓度均为100 μg/mL的对照品溶液。(2)福多司坦及杂质E、F、G混合对照品溶液:精密称取福多司坦对照品及杂质E、F、G对照品适量,加0.05 mol/L磷酸盐缓冲液溶解并稀释制成福多司坦及杂质E、F、G质量浓度均为100 μg/mL的对照品溶液。
2.2.2 供试品溶液的制备 精密称取福多司坦原料药或其制剂内容物100 mg,分别置于50 mL量瓶中,加0.12%己烷磺酸钠溶液或0.05 mol/L磷酸盐缓冲液稀释至刻度,摇匀,分别作为供试品溶液1、2。
2.2.3 自身对照溶液的制备 精密量取“2.2.2”项下供试品溶液0.1 mL,分别置于100 mL量瓶中,加0.12%己烷磺酸钠溶液或0.05 mol/L磷酸盐缓冲液稀释至刻度,摇匀,分别作为自身对照溶液1、2。
2.2.4 系统适用性试验溶液 取福多司坦及杂质A、B、C对照品适量,加0.12%己烷磺酸钠溶液制成每1 mL含福多司坦2 mg和杂质A、B、C各2 μg的溶液作为系统适用性溶液1;取福多司坦与杂质E、F、G对照品适量,加“2.1”项下0.05 mol/L磷酸盐缓冲液制成每1 mL含福多司坦2 mg和杂质E、F、G各2 μg的溶液作为系统适用性溶液2。
2.2.5 空白辅料溶液 将各厂家福多司坦片、胶囊的辅料按配方量混合,并称取相当于最大片质量1/2的辅料量置于50 mL量瓶中,分别用0.12%己烷磺酸钠溶液或0.05 mol/L磷酸盐缓冲液溶解作为空白辅料溶液1、2。
2.3 方法学考察
2.3.1 系统适用性试验 精密量取“2.2.4”项下的系统适用性溶液1、2,分别按“2.1”项下色谱条件1、2进样分析,记录色谱图。结果,空白辅料峰无干扰,福多司坦峰与各杂质峰间无干扰,分离度均>1.5,各杂质峰理论板数均>3 000,杂质E、F、G的相对保留时间为0.88、1.95、3.08。系统适用性色谱图见图2。
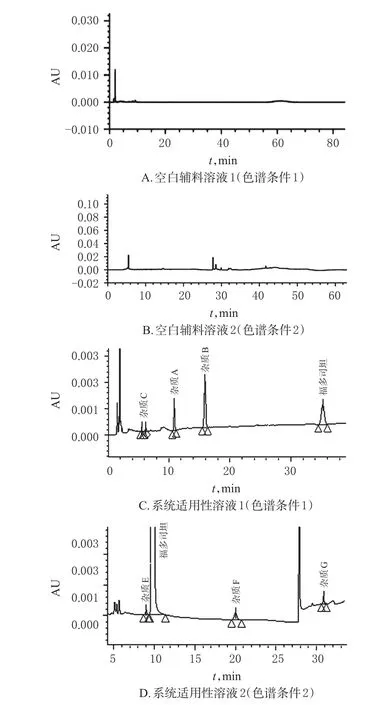
图2 系统适用性试验色谱图Fig 2 Chromatograms of system suitability test
2.3.2 专属性试验 取福多司坦片(批号:B160201161),研磨成细粉,取福多司坦粉末100 mg,分别置于50 mL量瓶中,共6份,一份为未破坏样品,另5份按以下条件进行破坏。(1)酸破坏:加1 mol/L盐酸溶液5 mL,水浴加热30 min,放冷后,加1 mol/L氢氧化钠溶液5 mL中和,然后用水稀释至刻度,摇匀,滤过,续滤液作为酸破坏样品。(2)碱破坏:加1 mol/L氢氧化钠溶液5 mL,水浴加热30 min,放冷后,加1 mol/L盐酸溶液5 mL中和,然后用水稀释至刻度,摇匀,滤过,续滤液作为碱破坏样品。(3)高温破坏:加水适量溶解后,置于105 ℃下加热30 min,然后用水稀释至刻度,摇匀,滤过,续滤液作为高温破坏样品。(4)光照破坏:加水适量溶解后,置于紫外灯(波长254 nm)下照射2 d后,用水稀释至刻度,摇匀,滤过,续滤液作为光照破坏样品。(5)氧化破坏:加10%过氧化氢溶液1 mL,立即用水稀释至刻度,摇匀,滤过,续滤液作为氧化破坏样品。取上述6种样品20 μL,按“2.1”项下色谱条件1、2进样分析,记录色谱图。结果,在不同破坏条件下,各降解产物峰均能与主峰完全分离,表明该方法专属性良好。专属性试验色谱图见图3。
2.3.3 线性关系及校正因子考察 分别取“2.2.1(1)”项下对照品溶液适量,加0.12%己烷磺酸钠溶液稀释制成每1 mL中含杂质A、B、C均为0.1、0.2、0.4、1.0、2.0、4.0、10.0、20.0 μg的系列溶液;另取“2.2.1(2)”项下对照品溶液适量,加0.05 mol/L磷酸盐缓冲液稀释制成每1 mL中含福多司坦和杂质E、F及G均为0.1、0.2、0.4、1.0、2.0、4.0、10.0 μg的系列溶液。精密吸取上述溶液20 μL,按“2.1”项下色谱条件1、2进样分析,记录峰面积。以福多司坦或各杂质质量浓度为横坐标(x)、峰面积为纵坐标(y)进行线性回归,并以方程斜率(K)计算杂质E、F、G的校正因子(校正因子=K福多司坦/K杂质E/F/G),线性关系及校正因子考察结果见表2。
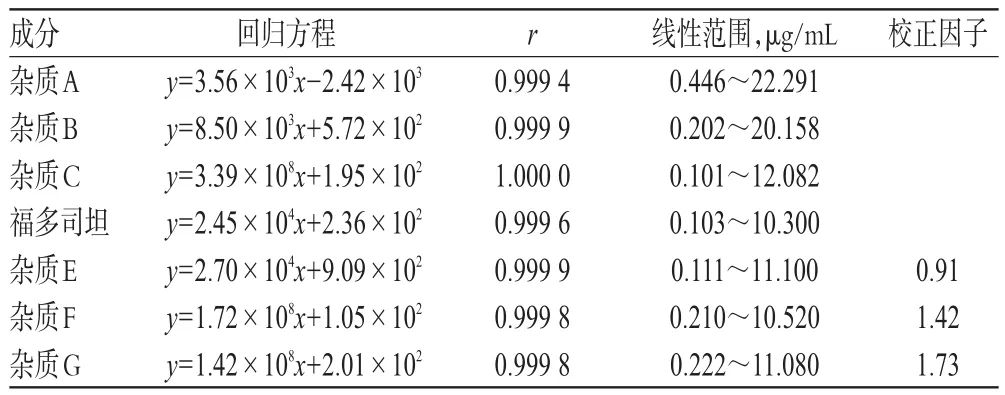
表2 线性关系及校正因子Tab 2 Linear relationships and correction factors
2.3.4 精密度试验 取“2.3.3”项下质量浓度为1.0 μg/mL的各杂质溶液,按“2.1”项下色谱条件1、2连续进样6次,记录福多司坦及各杂质的峰面积。结果,福多司坦及各杂质峰面积的RSD均小于1.2%(n=6),表明该方法精密度良好。
2.3.5 检测限与定量限考察 取“2.2.1”项下福多司坦及各杂质的对照品溶液,逐级稀释,按“2.1”项下色谱条件1、2进样分析。以信噪比为3∶1计算检测限,以信噪比为10∶1计算定量限。结果,福多司坦及杂质A、B、C、E、F、G的检测限分别为2.06、5.57、1.01、1.99、2.22、4.21、4.43 ng,定量限分别为4.12、11.14、2.02、3.98、4.45、8.42、8.85 ng。
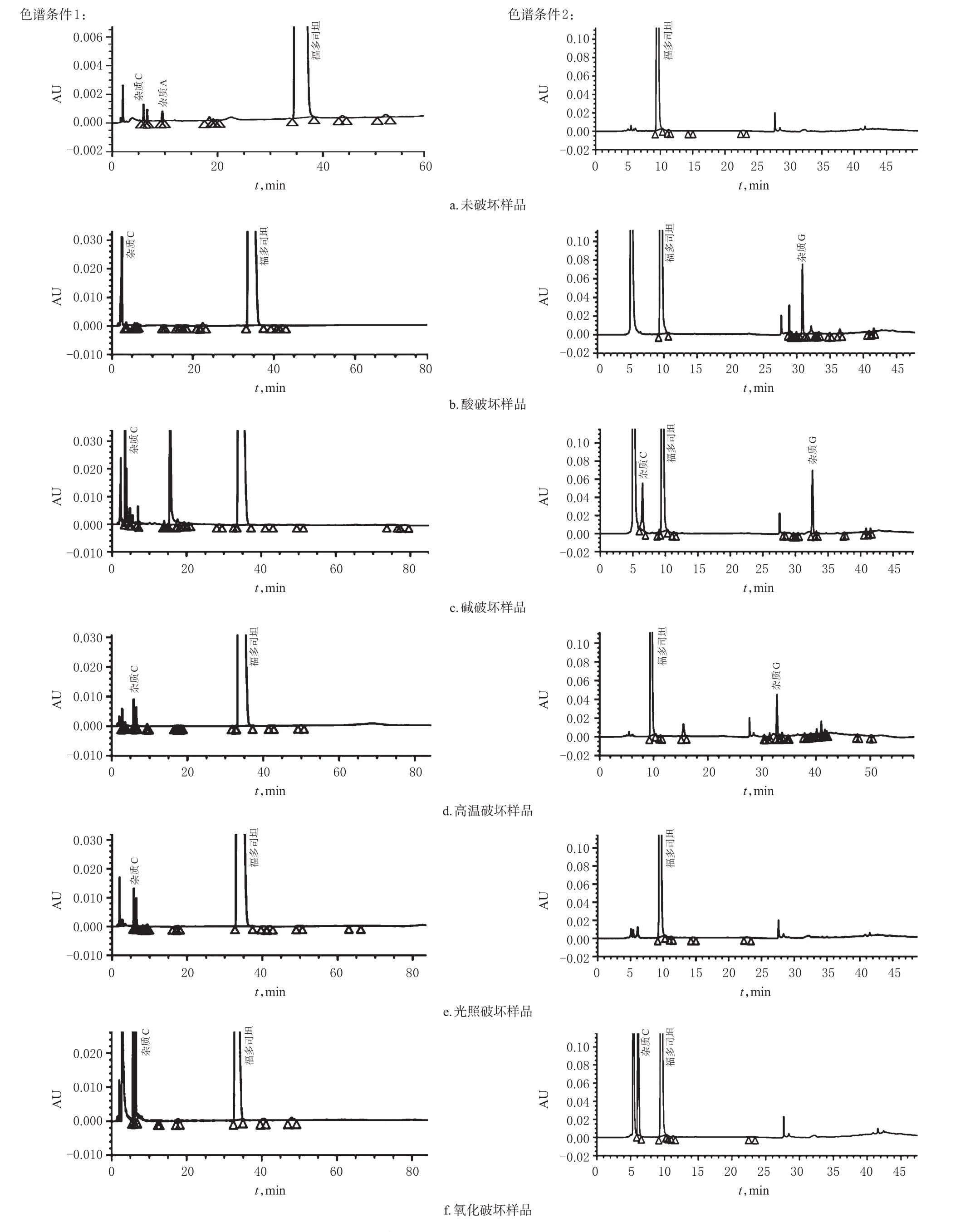
图3 专属性试验色谱图Fig 3 Chromatograms of specific test
2.3.6 稳定性试验 取“2.2.4”项下系统适用性溶液适量,分别于室温下放置0、2、4、6、8、10、24 h后按“2.1”项下色谱条件1、2进样分析,记录峰面积。结果,杂质A在4 h内峰面积的RSD<2.0%(n=3),福多司坦及杂质B、C、E、F、G在24 h内峰面积的RSD均<1.0%(n=7),表明该方法稳定性良好。
2.3.7 加样回收率试验 分别精密量取“2.2.1”项下各杂质混合对照品溶液适量,置于已称有一定空白辅料和福多司坦原料药5的量瓶中,制备相当于杂质含量20%、100%、150%的供试品溶液,每个浓度各3份,取上述供试品溶液适量,按“2.1”项下色谱条件1、2进样分析,记录峰面积,杂质A、B、C按外标法计算各杂质回收率,杂质E、F、G按加校正因子的主成分自身对照法计算各杂质加样回收率。结果,杂质A、B、C、E、F、G平均加样回收率分别为98.0%、97.3%、102.4%、99.4%、98.9%、96.4%,RSD分别为1.4%、1.5%、1.1%、0.9%、1.2%、0.5%(n=9)。
2.3.8 样品中各杂质含量检测 分别取各生产企业的原料药或制剂样品适量,按“2.2.2”项下制备样品溶液,然后取该样品溶液按“2.2.3”项下方法制备自身对照溶液,然后取上述溶液适量,分别按“2.1”项下色谱条件1、2进样分析,记录峰面积。杂质A、B、C按外标法计算其在样品中的含量,杂质E、F、G按加校正因子的主成分自身对照法计算其在样品中的含量,由于样品中还有其他未知杂质,因此,笔者采用自身对照法[15]对其他未知杂质含量进行测定。样品中各杂质含量检测结果见表3。
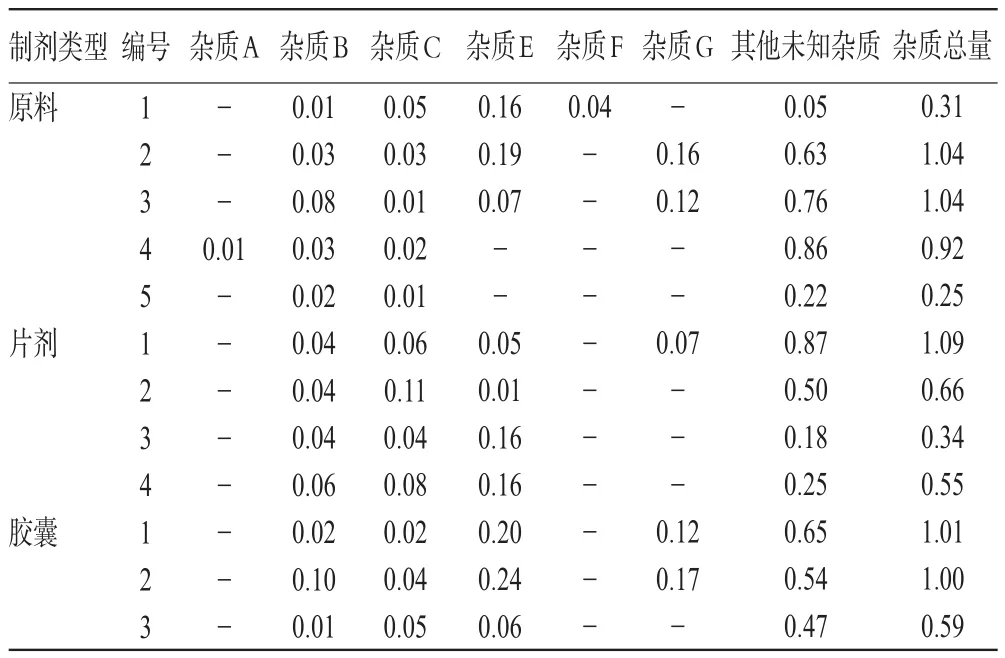
表3 样品中各杂质含量检测结果(%%)Tab 3 Results of content determination of the impurities in samples(%%)
3 讨论
3.1 色谱系统选择
福多司坦各杂质极性相差较大,其中杂质A、B、C的极性较大,在低pH的0.12%己烷磺酸钠溶液中能够得到良好分离,但在该色谱条件1下无法将极性较小的杂质E、F、G洗脱出来,故使用极性较小的色谱条件2对其进行分离。福多司坦右旋异构体在标准中有检测方法,因此,本文没有再进行研究。
3.2 杂质来源分析
福多司坦中杂质A为起始物料,杂质B为起始物料中的杂质或降解产物,杂质E、F、G为反应副产物,其中杂质G为盐酸半胱氨酸与3-卤代-1-丙醇反应的特定副产物,杂质C为福多司坦氧化降解产物。由强制降解试验可知,福多司坦的主要降解产物为杂质C,在碱降解中还发现了几个较大的未知降解杂质,但因样品中均未检出这几个杂质,且未制备有相应的对照品,所以此次试验未对这几个杂质进行定量研究。
3.3 杂质的限度
由试验结果可知,在福多司坦原料药及其制剂中,杂质C、E和G含量较高,约0.1%~0.2%。福多司坦制剂每日最大服用剂量为1.2 g,各杂质为非毒性杂质,根据国家食品药品监督管理局发布的化学药物杂质研究的技术指导原则[10],建议将工艺杂质A、B、E、F、G限度定为0.15%,降解杂质C可适当放宽限度,其他单个未知杂质限度定为0.1%,杂质总量限度定为1.0%。
综上所述,不同企业福多司坦原料药中杂质含量存在差异,从而使得其各制剂中有关物质的含量参差不齐。因此,建议仿制药企业完善福多司坦原料药有关物质的检测方法,为其仿制药一致性评价提供基础。

