HPLC-一测多评法测定黄精及其饮片中6种成分的含量Δ
左雅敏,李琛,彭兴春,卫荣华,伍庆,郑燕,邓雪华#(.湖北医药学院基础医学院,湖北十堰44000;.贵州师范大学山地环境信息系统与生态环境保护重点实验室,贵阳 55000;.湖北医药学院药学院,湖北十堰 44000)
黄精为百合科植物滇黄精(Polygonatum kingianumColl.et Hemsl.)、黄精(Polygonatum sibiricumRed.)或多花黄精(Polygonatum cyrtonemaHua)的干燥根茎[1]。现代药理学研究表明,黄精的化学成分主要有糖类、皂苷类、黄酮类、酚酸类及生物碱类等[2-4]。其中,皂苷类成分薯蓣皂苷元还可改善心血管功能、调节免疫等[5];黄酮类成分芦丁、槲皮素及山柰酚等可通过参与蛋白质磷酸化、氧化还原反应及自由基清除等在抗氧化、抗衰老方面发挥重要作用[6];酚酸类成分香草酸具有抗菌、消炎及抗血小板聚集等功能[7]。因生黄精有麻舌感且可刺激咽喉,故临床上多通过酒制法破坏黄精中黏液质以减少毒副作用[8-9]。而相关研究证实[10-11],黄精酒制前后多糖含量变化较大,在炮制过程中多糖会被大量水解成低聚糖和单糖,其中的5-羟甲基糠醛就是葡萄糖等多糖在高温或弱酸等条件下脱水产生的,可作为炮制过程黄精多糖成分变化的重要指标,且其具有抗炎和改善血液流变学的功效。以上6种成分均具有较好的药理作用,具有较大的研究价值和开发潜力。
一测多评(QAMS)法是以样品中某一典型组分为内参物,建立该组分与其他组分的相对校正因子(RCFs),以计算其他组分的量[12],该方法已成功应用于多种药材、饮片及中成药的质量控制中[13-14]。而王智民课题组成功建立的含淫羊藿成分的“药材-饮片-中成药”一体化QAMS质量评价模式为实现单味药材到复方的推广提供了示范和参考作用[15]。另有研究证实,使用紫外双波长切换可有效提高检测灵敏度,实现同时测定药材中不同成分含量的目的[16]。目前,2015年版《中国药典》(一部)[1]仅以黄精饮片中无水葡萄糖的含量不少于4.0%作为质量标准,虽有研究采用外标法对黄精中黄酮、生物碱等成分进行了测定[17-19],但未见QAMS法的报道。且已报道的研究多局限于探讨黄精多糖的药理作用,而同时测定多种类型化学成分的研究则报道较少。为体现中药黄精多成分、多层次和多靶点的特点,充分开发利用药用资源,本研究以黄精药材及其饮片为研究对象,以香草酸(酚酸类)作为内参物,建立黄精药材及其饮片中薯蓣皂苷元(皂苷类)、芦丁、槲皮素及山柰酚(黄酮类)和5-羟甲基糠醛(醛类)6种成分的QAMS法,并与高效液相色谱(HPLC)外标法进行对比,为全面建立黄精药材及饮片质量提供参考,同时为揭示黄精炮制机制提供数据支撑。
1 材料
1.1 仪器
Agilent 1100型HPLC系统,包括四元泵、自动进样器、二极管阵列检测器(DAD)及Agilent ChemStation B.04.02型工作站(美国Agilent公司);CH-250型超声波清洗机(北京创新德超声电子研究所);AL-204型电子天平(瑞士梅特勒-托利多公司);WG-43型数显电热鼓风恒温干燥箱(长春澳尔天派机电设备有限公司)。
1.2 药品与试剂
薯蓣皂苷元对照品(批号:111539-200001,纯度:>99%)、5-羟甲基糠醛对照品(批号:111626-201711,纯度:>99%)、香草酸对照品(批号:110776-201503,纯度:>99%)、芦丁对照品(批号:100080-201811,纯度:>98%)、槲皮素对照品(批号:100081-201610,纯度:>99%)和山柰酚对照品(批号:110861-201812,纯度:>99%)均购自中国食品药品检定研究院;黄精药材(批号:20181201~20181210)和黄精饮片(批号:20181211~20181220)各10批,均购自国药集团同济堂(贵州)制药有限公司,经贵阳中医学院魏升华教授鉴定均符合2015年版《中国药典》(一部)相关规定,属于多花黄精P.cyrtonemaHua的干燥块茎;甲醇、乙腈(天津科密欧化学试剂有限公司,色谱纯),水为自制超纯水,其他试剂均为分析纯。
2 方法与结果
2.1 HPLC法测定黄精药材及饮片中6种成分含量
2.1.1 各对照品溶液的制备 对照品贮备液:分别取薯蓣皂苷元、5-羟甲基糠醛、香草酸、芦丁、槲皮素及山柰酚对照品适量,精密称定,置于不同10 mL量瓶中,加80%甲醇溶解并定容至刻度,得质量浓度分别为0.62、3.34、2.15、1.65、1.13、1.08 mg/mL的对照品贮备液。混合对照品溶液:分别移取适量上述6种对照品贮备液,置于同一5 mL量瓶中,用80%甲醇制备成含有0.010 2 mg/mL薯蓣皂苷元、0.584 5 mg/mL5-羟甲基糠醛、0.003 2 mg/mL香草酸、0.012 5 mg/mL芦丁、0.010 2 mg/mL槲皮素及0.010 6 mg/mL山柰酚的混合标准对照品溶液;分别用80%甲醇将该混合对照品溶液稀释2、5、8、10及50倍,制成5个质量浓度的系列对照品溶液。各溶液均于4℃冰箱保存,备用。
2.1.2 供试品溶液的制备 (1)黄精药材供试品溶液:根茎去除根须,洗净,于40℃烘箱烘干,粉碎过50目筛,置于干燥器中。取黄精药材粉末约1 g,精密称定,置于50 mL具塞锥形瓶中,精密加入50%乙醇30 mL,称定质量,超声(功率:200 W,频率:53 kHz)处理30 min,放冷,再称定质量,用50%乙醇补足减失的质量,摇匀,过滤,取续滤液过0.22 μm微孔滤膜,即得。(2)黄精饮片供试品溶液:制备方法同黄精药材。
2.1.3 色谱条件与系统适用性试验 色谱柱为Diamonsil-C18(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-水(B),梯度洗脱(0~8 min,13%A;8~13 min,13%~19%;13~30 min,19%~25%A;30~45 min,25%~50%A;45~50 min,50%~60%A;50~60 min,60%~70%A;60~62 min,70%~90%A;62~65 min,90%~100%A;70~75 min,13%A);检测波长5-羟甲基糠醛、香草酸、芦丁、槲皮素及山柰酚为254 nm(0~60 min),薯蓣皂苷元为202 nm(60~75 min);流速为1.0 mL/min;柱温为30℃;进样量为10 μL。取“2.1.1”项下混合对照品溶液和“2.1.2”项下供试品溶液,按此色谱条件进样测定,记录色谱图。结果,各成分与相邻峰间的分离度均大于1.5,理论板数按香草酸峰计大于5 000,色谱图见图1。
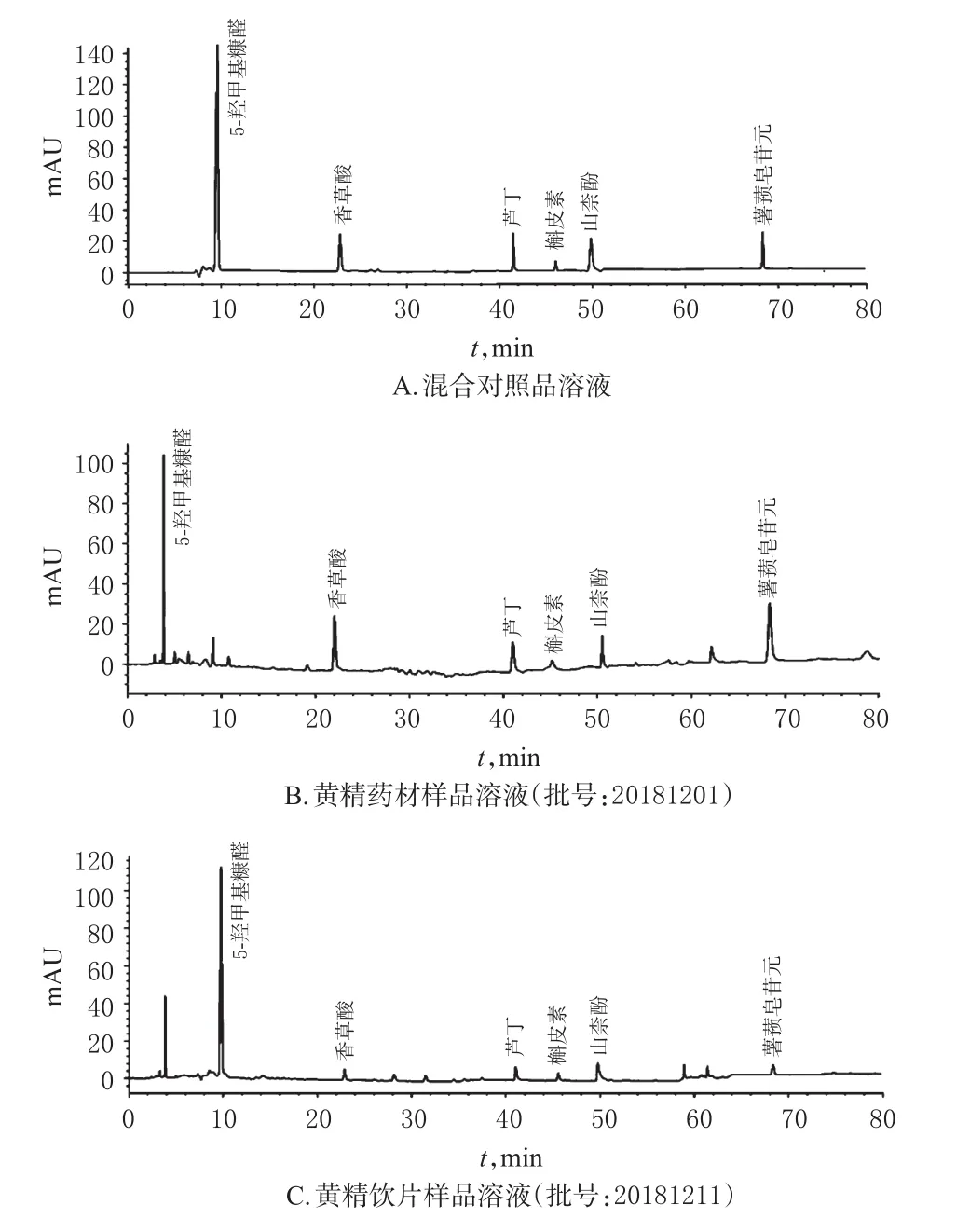
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.1.4 线性关系与检测限、定量限考察 分别吸取“2.1.1”项下制成的5个质量浓度的系列对照品溶液各10 μL,按“2.1.3”项下色谱条件进样分析,记录色谱图。每个质量浓度进样3次,取平均值,以进样质量(x)为横坐标、峰面积(y)为纵坐标进行线性回归,并求得信噪比(S/N)分别为3和10的对照品浓度,即为该对照品的检测限(S/N=3)和定量限(S/N=10)。结果表明,各组分在进样质量浓度范围内与其峰面积均呈良好的线性关系,结果见表1。
2.1.5 精密度试验 取同一混合对照品溶液,按“2.1.3”项下色谱条件连续进样6次,记录峰面积。结果显示,薯蓣皂苷元、5-羟甲基糠醛、香草酸、芦丁、槲皮素及山柰酚峰面积的RSD分别为1.2%、2.3%、1.9%、0.8%、2.5%和1.9%(n=6),说明仪器精密度良好。
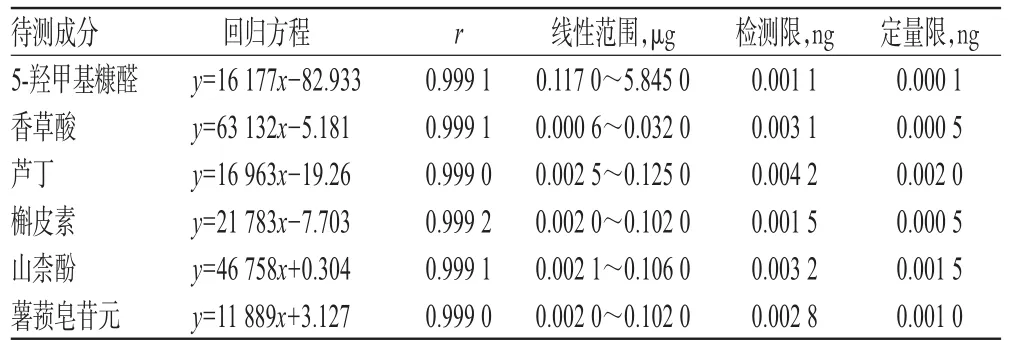
表1 6种成分的线性关系及检测限、定量限考察结果(n=3)Tab 1 Linear relationship,detection limit and limit of quantitation of 6 components(n=3)
2.1.6 稳定性试验 取同一份黄精药材供试品(批号:20181201)溶液,分别在放置0、2、4、6、8、10、12、24、36、48、72 h时按“2.1.3”项下色谱条件进样分析,记录峰面积。结果显示,溶液中薯蓣皂苷元、5-羟甲基糠醛、香草酸、芦丁、槲皮素及山柰酚峰面积的RSD分别为1.9%、2.8%、0.7%、1.6%、0.7%和2.3%(n=11),表明制备后的供试品溶液在72 h内稳定。
2.1.7 重复性试验 称取同一份黄精药材供试品(批号:20181201)粉末约1.0 g,共6份,按照“2.1.2(1)”项下方法制备供试品溶液,然后按“2.1.3”项下色谱条件进样分析,记录峰面积并计算各成分含量。结果显示,6份样品中薯蓣皂苷元、5-羟甲基糠醛、香草酸、芦丁、槲皮素及山柰酚含量的RSD分别为1.5%、0.9%、2.1%、0.5%、1.2%和1.9%(n=6),表明该方法重复性良好。
2.1.8 加样回收率试验 称取已知含量的黄精药材(批号:20181201)粉末共9份,每3份为1组,各约0.50 g,精密称定,分别按已知含量的80%、100%、120%精密加入薯蓣皂苷元、5-羟甲基糠醛、香草酸、芦丁、槲皮素及山柰酚对照品,然后按“2.1.2(1)”项下方法制成供试品溶液,再按“2.1.3”项下色谱条件进样分析,记录峰面积并计算加样回收率。结果显示,薯蓣皂苷元、5-羟甲基糠醛、香草酸、芦丁、槲皮素及山柰酚的平均回收率分别为99.8%、100.9%、101.1%、101.1%、99.9%和100.1%,RSD分别为 0.3%、2.4%、1.0%、1.4%、1.9%和1.7%(n=9),表明本方法具有较好的准确度,结果见表2。
2.2QAMS质量评价模式的建立
2.2.1 待测指标RCFs的计算 本研究比较了不同计算方法(斜率法、多点校正法)得到的RCFs。根据文献方法[20],以香草酸为内参物计算其他5个成分的RCFs:RCFs=(Wk×Am)/(Wm×Ak),其中,Ak为内参物峰面积,Wk为内标物质量,Am为待测组分m峰面积,Wm为待测组分m质量。

表2 回收率试验结果Tab 2 Results of recovery tests
斜率法即采用不同质量浓度的混合对照品溶液进样相同体积测定,记录峰面积与进样量,并计算RCFs,分别取“2.1.1”项下制备的5个系列对照品溶液(即“2.1.4”项下线性范围数据),每份样品平行测定3次,根据各样品的平均值计算各成分的平均RCFs值。多点校正法即采取同一质量混合对照品进样不同体积测定,记录峰面积与进样量并计算RCFs,取“2.1.2”项下混合对照品溶液,分别进样2、4、6、8、10 μL,平行测定3次。本研究结果显示,斜率法得到的RCFs的相对偏差较多点校正法小,故采用斜率法进行RCFs计算,结果见表3。
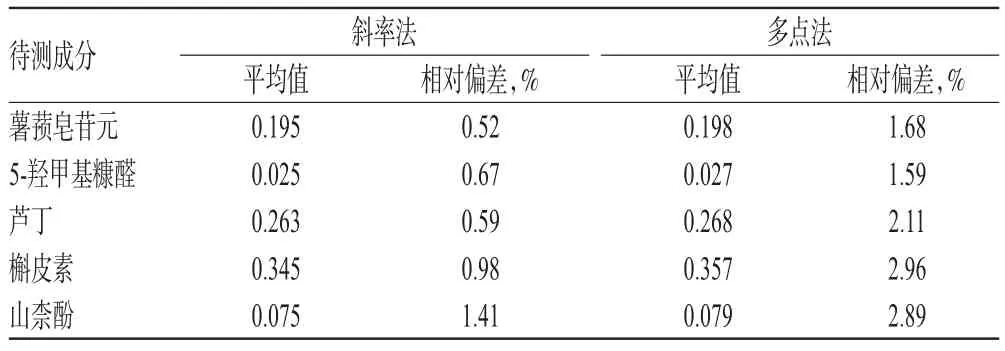
表3 不同计算方法的RCFs值比较(n=3)Tab 3 Comparison of RCFs calculated by different methods(n=3)
2.2.2 RCFs的耐用性考察 取黄精药材样品(批号:20181201)按“2.1.2(1)”项下制备供试品溶液,在不同色谱条件进样分析,记录峰面积及各成分含量,并以香草酸为内参物,按公式计算各成分的RCFs值,考察不同色谱条件对RCFs值的影响:(1)采用Agilent 1100型HPLC系统,考察3种色谱柱[Diamonsil-C18(250 mm×4.6 mm,5 μm)、Phenomenex Luna C18(250 mm×4.6 mm,5 μm)和Hypersil ODS2 C18(250 mm×4.6 mm,5 μm)]对RCFs值的影响,结果薯蓣皂苷元、5-羟甲基糠醛、芦丁、槲皮素及山柰酚RCFs值的RSD均<1.8%(n=3),表明RCFs在不同色谱柱具有较好的适应性。(2)采用Diamonsil-C18色谱柱(250 mm×4.6 mm,5 μm),采用考察3种不同品牌仪器(Agilent 1100、Waters 2996和岛津2010A)对RCFs值的影响,结果薯蓣皂苷元、5-羟甲基糠醛、芦丁、槲皮素及山柰酚RCFs值的RSD均<7.1%(n=3),表明在使用不同品牌仪器时需要进行波长校正,以获得更稳定的RCFs值。(3)采用Agilent 1100型色谱仪,Diamonsil-C18色谱柱(250 mm×4.6 mm,5 μm),考察柱温分别为20、25、30 ℃时对RCFs值的影响,结果RCFs的RSD<1.5%(n=3),表明在不同柱温下耐用性良好。(4)考察流速分别为0.8、1.0、1.2 mL/min时对RCFs值的影响,结果RCFs的RSD<2.1%(n=3),表明在不同体积流量时具有良好的耐用性。
2.3 待测组分色谱峰的定位
采用相对保留法RTRi/Rx=tRi/tRx,ΔtRi-Rx=tRi-tRx(RTRi/Rx表示待测成分Ri与内参物Rx的相对保留时间,ΔtRi-Rx表示待测成分Ri与内参物Rx的保留时间差,tRi表示待测成分Ri的保留时间,tRx表示内参物Rx的保留时间)。采用RCFs计算和耐用性考察时记录的色谱图,即测定相对保留值在不同品牌仪器、不同色谱柱、不同柱温和流速时的重现性,计算5种成分的RTRi/Rx和ΔtRi-Rx。结果表明,待测成分间的RTRi/Rx较稳定,RSD<2.0%(n=3);但待测成分间的ΔtRi-Rx波动较大。因此,该方法的RTRi/Rx适宜于薯蓣皂苷元、5-羟甲基糠醛、芦丁、槲皮素及山柰酚色谱峰的定位,结果见表4、表5。
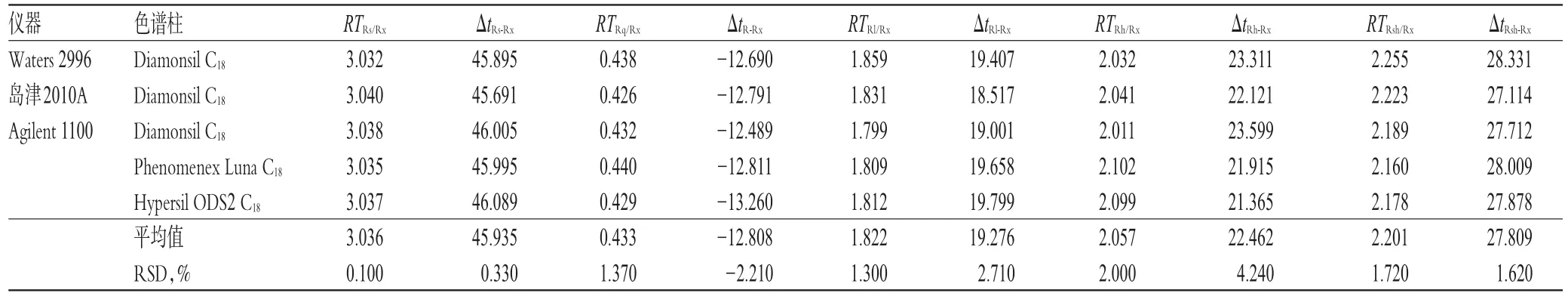
表4不同品牌仪器和色谱柱下待测成分间的RTRi/Rx和ΔtRi-Rx(n=3)Tab 4 RTRi/Rxand ΔtRi-Rxamong the components to be determined by using different brand instruments and columns(n=3)
2.4 黄精药材QAMS法和外标法测定结果的比较
分别取各批次黄精药材按“2.1.2(1)”项下制备供试品溶液,按“2.1.3”项下色谱条件测定。分别采用外标法和建立的QAMS法测定黄精药材中6种成分含量。结果表明,外标法和QAMS法测得的各成分含量值的相似度均大于0.9;相对偏差[(外标法-QAMS法)/QAMS法×100%]的RSD值均小于5%(n=3)。应用统计学软件SPSS 16.0对数据进行t检验分析,结果显示,2种方法测定下6种成分含量差异均无统计学意义(P>0.05),结果见表6。
2.5 黄精饮片含量测定方法再验证
本研究以黄精饮片中香草酸为内参物,采用建立的RCFs值计算饮片中其余5种成分的含量,并同时用外标法测定各成分含量进行结果验证。采用统计学软件SPSS 16.0对两组间数据进行t检验分析。结果显示,采用外标法和QAMS法测定的黄精饮片中薯蓣皂苷元、5-羟甲基糠醛、香草酸、芦丁、槲皮素及山柰酚含量的差异均无统计学意义(P>0.05),结果见表7。

表5不同柱温和流速下待测成分间的RTRi/Rx和ΔtRi-Rx(n=3)Tab 5 RTRi/Rxand ΔtRi-Rxamong the components to be determined by under different column temperatures and flow rates(n=3)
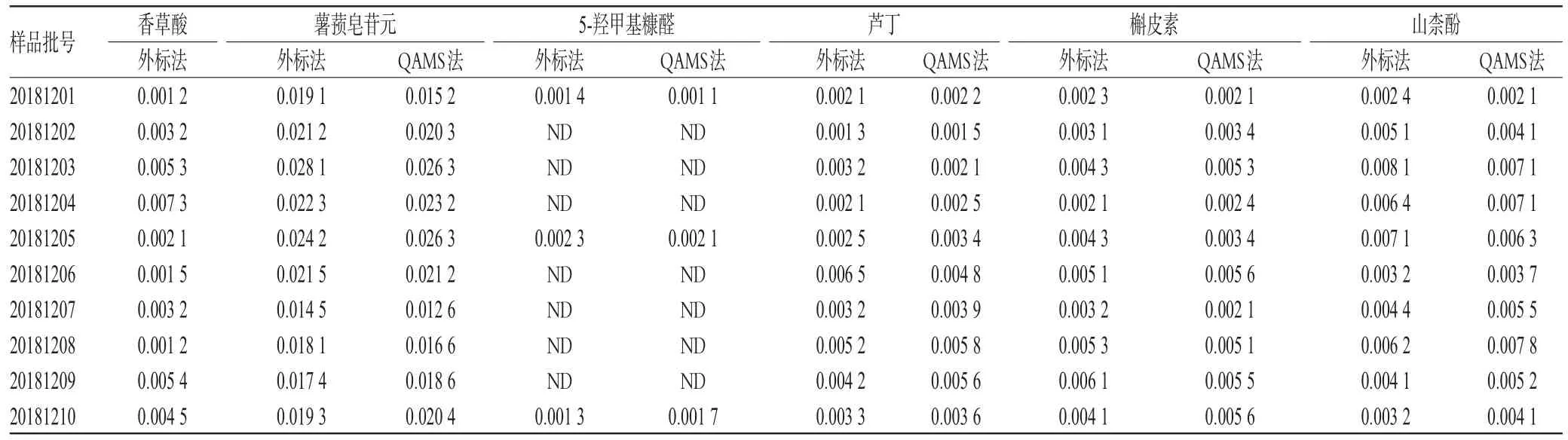
表6 2种方法测定黄精药材中6种成分的含量(%%)Tab 6 Content of 6 components in Polygonati Rhizoma determined by two methods(%%)
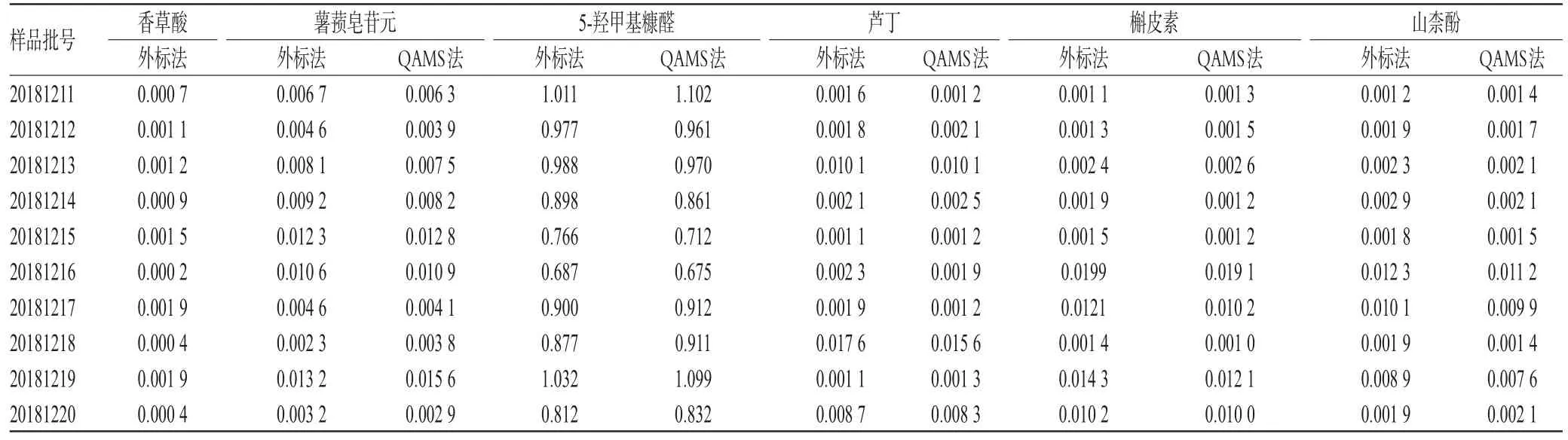
表7 2种方法测定黄精饮片中6种成分的含量(%%)Tab 7 Contents of 6 components in Polygonati Rhizoma decoction piece determined by 2 methods(%%)
3 讨论
在样品前处理方法上,根据待测成分的性质,本研究对不同提取溶剂及用量(甲醇、乙醇、无水乙醇等)、提取方法(超声、回流提取等)以及提取时间等分别进行了考察,结果表明以50%乙醇为提取溶剂,超声提取30 min测得的6种成分含量较高。在检测条件优化上,本研究比较了不同的流动相检测体系(甲醇-醋酸、乙腈-水和乙腈-0.03%磷酸),发现乙腈-水体系经梯度洗脱后所得各峰分离效果最佳,且配比简单。在检测波长的选择上,本研究采用DAD检测器,通过在线紫外吸收光谱对6种化学成分进行全波长扫描,最终确定检测波长(0~60 min,λ1=254 nm;60~65 min,λ2=202 nm)可兼顾6种化学成分的最大吸收。
本研究首次将QAMS法结合HPLC双波长法应用到黄精中酚酸类、皂苷类、黄酮类及醛类成分的多指标质量评价上,避免对照品不稳定、价格高等因素,选用价格低廉、性质稳定的香草酸为内参物。色谱峰的准确定位及RCFs值的确定是QAMS应用的关键。本研究采用相对保留时间结合色谱峰的全波长紫外吸收光谱对未知样品中待测色谱峰进行了准确定位。在对RCFs考察上,以香草酸为内参物,建立的薯蓣皂苷元、5-羟甲基糠醛、芦丁、槲皮素及山柰酚的RCFs具有较好的可信度,同时证实在对照品缺乏的条件下,其他成分均可为内参物。
本研究结果发现,不同黄精饮片批次间6种成分含量的差异较大,其中5-羟甲基糠醛含量最高,而在黄精药材中却多未检测到或含量极少,表明其可能在炮制工艺过程中产生,这为本课题组进一步探讨黄精炮制机制提供了数据基础。同时,不同来源和炮制工艺对黄精饮片化学成分具有较大影响,可为黄精资源开发及栽培种植提供参考。同时也提示,对黄精药材和炮制工艺生产过程的质量控制急需加强,以实现终产品的一致性和稳定性。
综上所述,本研究成功将建立的黄精中不同类成分的QAMS质量评价模式应用于黄精药材及饮片的质量评价中,实现了中药药材、饮片统一的多指标质量评价模式。通过建立黄精及饮片中6种成分的QAMS法,并比较其与外标法测定结果的差异,结果表明在线性范围内,本研究建立的QAMS法对黄精药材和饮片具有通用性,准确性高、可行性好,可为其他中药及相关产品质量控制提供方法参考。

