纤维蛋白原与多发性骨髓瘤患者预后的关系
翟红,赵国江,邹兴立,刘洋,魏锦
(1.川北医学院临床医学系,四川 南充 637000;2.攀枝花市中心医院血液内科,四川 攀枝花 617000)
多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞恶性肿瘤性疾病,其发病率占血液系统肿瘤的10%,仅次于淋巴瘤[1],居第二位。好发于中老年人,男性多于女性[2]。目前,该病没有有效办法可以治愈,其预后不一,生存期从数天到数十年不等。很多因素与骨髓瘤的预后相关,如年龄、血红蛋白水平、β2-MG水平、白蛋白水平、肌酐、ISS分期等。纤维蛋白原(fibrinogen,FIB),即凝血因子I,是一种由肝脏合成并分泌的糖蛋白,也是血浆中含量最高的凝血因子,正常人血浆中浓度为2~4 g/L。其在凝血酶的作用下转变为纤维蛋白,从而使血液凝固。研究[3-7]表明,FIB在多种恶性肿瘤中存在高表达,且与肿瘤的分期、治疗反应、预后等密切相关。刘瑞萍等[8]研究显示,与健康体检者对照组相比,骨髓瘤患者血浆中FIB水平明显升高,且I期、II期MM患者的血浆FIB水平显著低于III期患者,治疗有效者,血浆FIB水平较治疗前明显降低。但关于FIB与多发性骨髓瘤患者预后关系的研究较少。本研究拟通过分析多发性骨髓瘤患者血浆中FIB水平与预后相关因素的关系,探讨其在MM患者预后中的意义。
1 资料与方法
1.1 资料
选取2010年1月至2015年12月在川北医学院附属医院初诊的多发性骨髓瘤患者117例,诊断标准均符合《血液病诊断及疗效判断标准》。患者在治疗前均有完整临床资料并坚持随访,排除意义未明的单克隆丙种球蛋白病、无症状性骨髓瘤、严重感染、严重活动性出血、浆细胞白血病的患者。最终有84 例患者入组,其中男性53 例,女性31 例,年龄41~88 岁,中位发病年龄为60 岁。
1.2 方法
收集确诊为多发性骨髓瘤患者的初诊化疗前的Hb、β2-MG、Cr、ISS分期等指标,随访截止至2016年12月31日。总体生存期(overall survival,OS)指从确诊开始到死亡或者随访结束的时间。
1.3 统计学分析
2 结果
2.1 多发性骨髓瘤患者FIB最佳临界值及与患者临床指标的关系
84 例骨髓瘤患者FIB均值为3.51 g/L,标准差为1.10,符合正态分布。取均值3.51 g/L为临界值,将84 例患者分为高FIB组(FIB>3.51 g/L)和低FIB组(FIB≤3.51 g/L),其中高FIB组37例,低FIB组47例。低FIB与高FIB组患者在性别、β2-MG水平的差异有统计学意义(P<0.05),与低FIB组相比,高FIB组男性比例更高,β2-MG水平偏高。而在年龄、ISS分期、Hb、Cr、骨髓瘤类型、ALB水平、骨髓中瘤细胞比例、治疗方案等方面比较,差异无统计学意义。见表1。
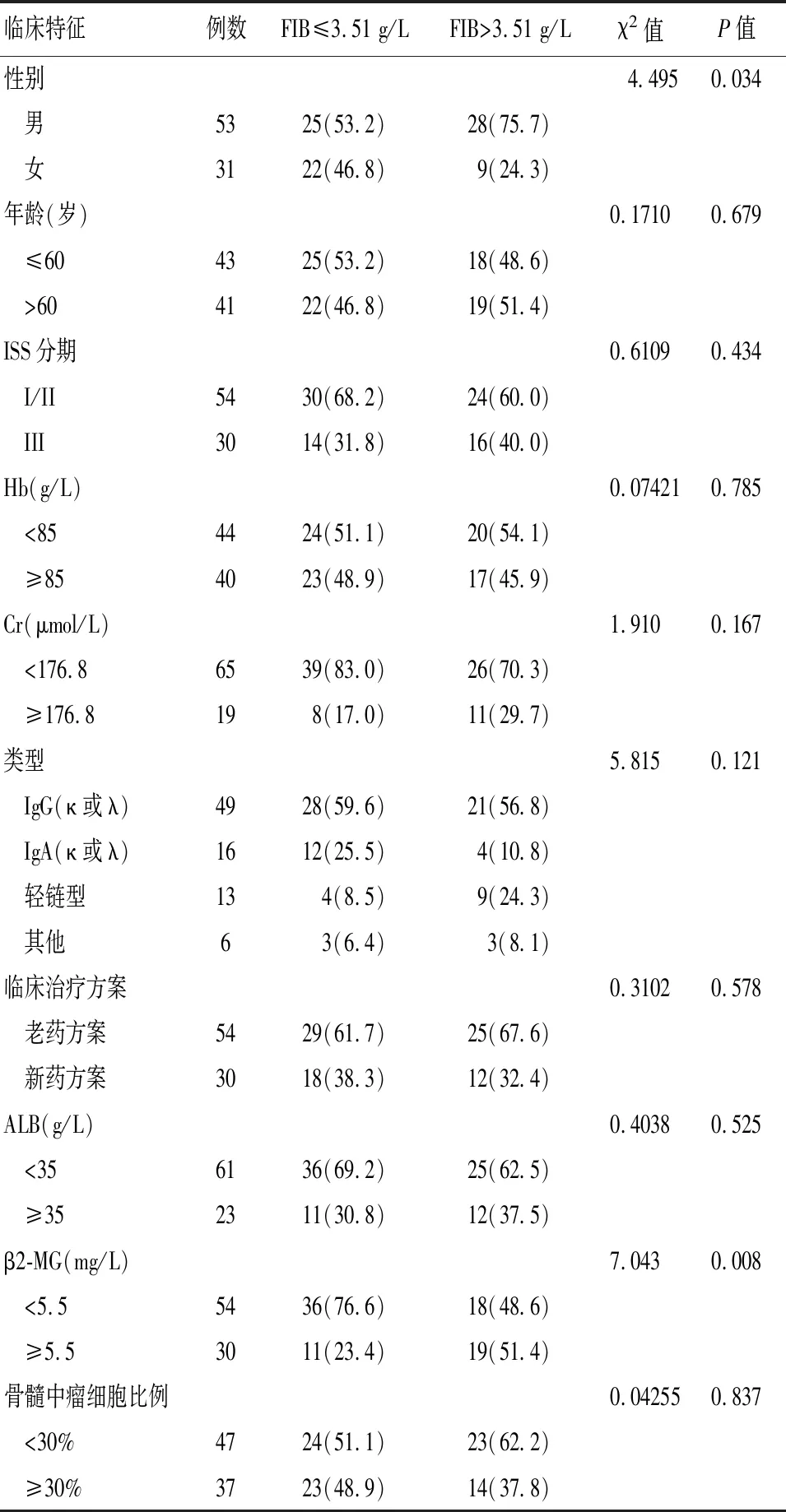
表1 MM患者FIB与其他临床指标的关系[n(%)]
2.2 多发性骨髓瘤患者FIB与生存期的关系
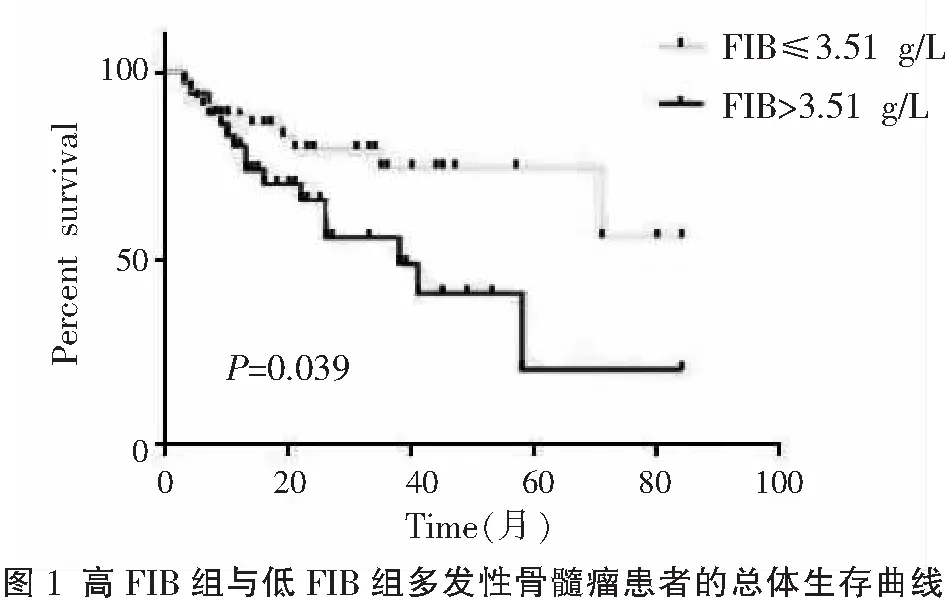
全程随访84 例患者,高FIB组其中位生存时间为38个月,低FIB组与高FIB组相比,其中位生存时间明显延长,差异有统计学意义(χ2=4.251,P<0.05)。见图1。
2.3 危险因素分析
利用Cox比例风险回归模型,将84 例MM患者进行单因素危险因素分析,结果表明,FIB>3.51 g/L、Cr、骨髓中瘤细胞比例升高是多发性骨髓瘤患者预后不良的危险因素(P<0.05)。见表2。进一步多因素分析表明FIB>3.51 g/L、Cr、骨髓中瘤细胞比例升高、ALB降低是影响MM患者预后的独立危险因素(P<0.05)。见表3。
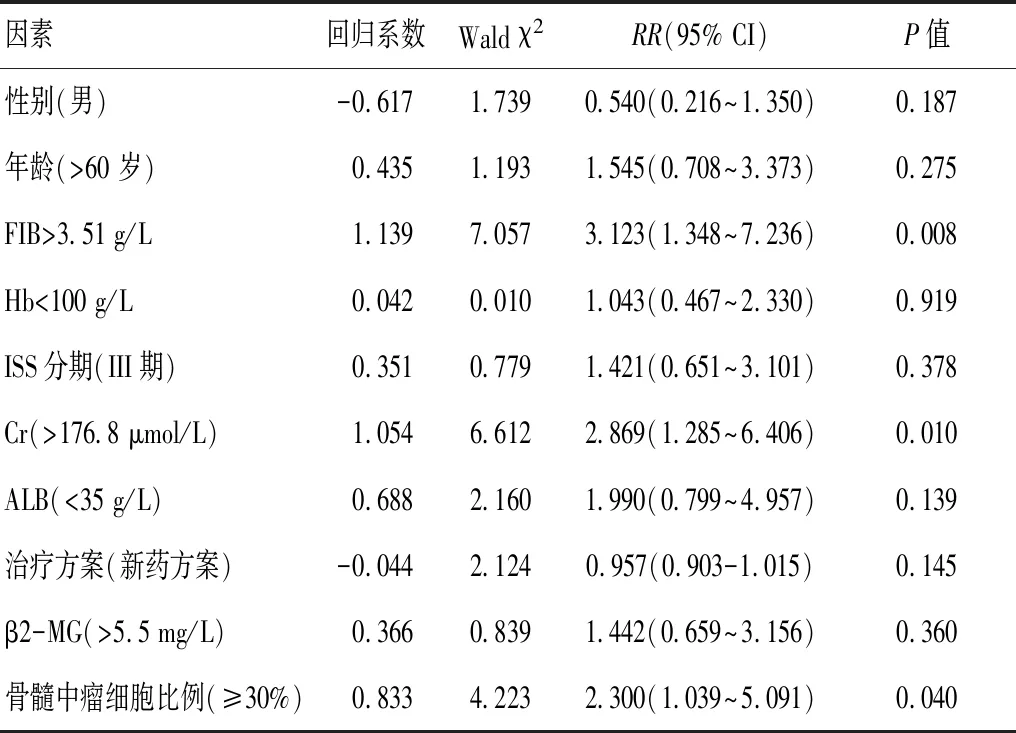
表2 多发性骨髓瘤患者总生存期单因素分析
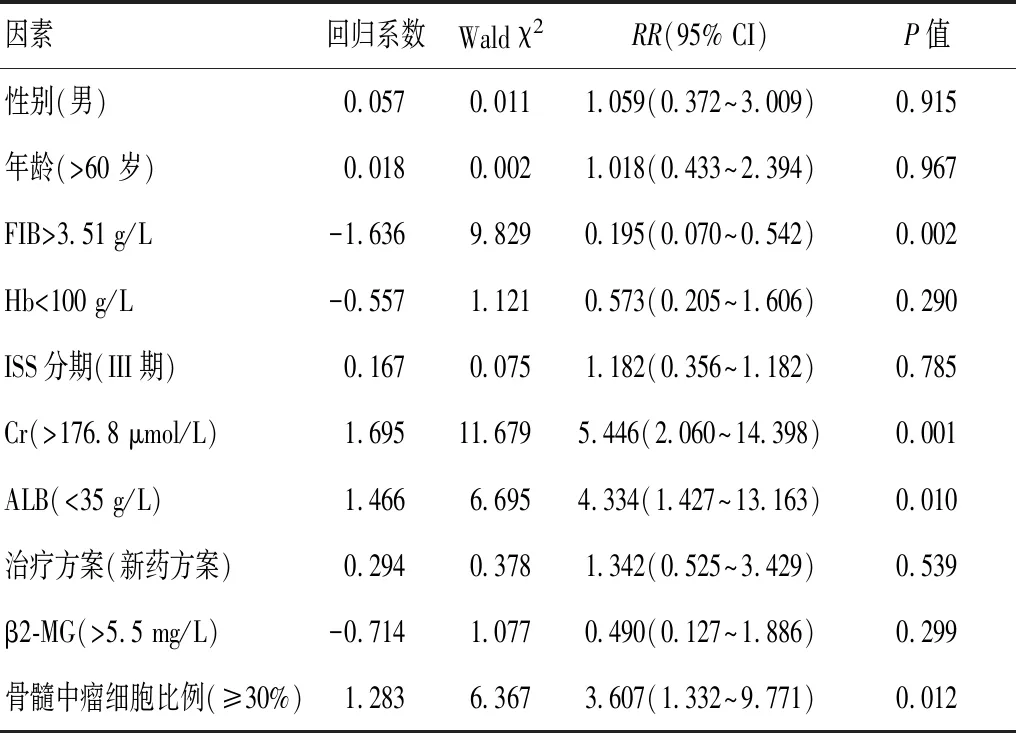
表3 多发性骨髓瘤患者总生存期多因素分析
3 讨论
多发性骨髓瘤是来源于浆细胞的恶性肿瘤,不同患者的预后存在显著差异,且影响患者预后的因素很多,主要包括β2-MG、血清ALB水平、Hb、Ca、M蛋白水平、Cr、骨骼破坏情况等。基于上述因素建立的两个分期标准Durie-Salmon分期标准(DS分期)和ISS分期标准目前在临床上广泛应用。但这两个分期标准均存在不足,如DS分期的影像学结果受主观影响较大;ISS分期中II、III期的分层效果不明显等[9]。细胞遗传学异常是影响多发性骨髓瘤患者预后的重要因素,1号染色体断臂(1p)缺失与骨髓瘤患者不良预后相关,进一步的研究通过荧光原位杂交技术(fluorescence in situ hybridization,FISH)证实, 1p21,1p22和1p32的缺失是不良预后的独立危险因素[10]。Larsen等[11]研究表明,骨髓瘤患者初诊时浆细胞标记指数是骨髓瘤患者独立的预后因素。但这些检查对实验室的要求较高,且价格昂贵,难以广泛开展。因此,寻找更为简便、经济、实用的指标用于判定骨髓瘤患者预后尤为重要。
近几年,越来越多的研究表明,治疗前FIB水平与多种实体肿瘤比如卵巢癌[12]、食管鳞癌[13]、阴茎癌[14]、小细胞肺癌[15]等的预后密切相关。研究[12]显示,在卵巢癌患者中,与FIB≤450.0 mg/dl,FIB>450.0 mg/dl的患者肿瘤分期偏晚,且术后残留更多肿瘤组织,无病生存期(disease-free survival,PFS)和总体生存时间均明显缩短。Ma等[14]研究表明,术前较高的FIB水平与阴茎癌患者不良预后密切相关,提示术前FIB水平可能是判断阴茎癌预后的独立指标。FIB与多发性骨髓瘤患者预后关系的研究尚较少。本研究显示,与低FIB组(FIB≤3.51 g/L)相比,高FIB组(FIB>3.51 g/L)中男性患者比例更高、β2-MG水平较高、中位生存时间缩短。单因素和多因素分析表明,FIB升高是影响多发性骨髓瘤患者预后的独立危险因素。FIB在多发性骨髓瘤患者中升高可能与其血液呈高凝状态有关。亦有研究认为[15-16],FIB升高可能与肿瘤细胞产生癌促凝物质,癌促凝物质可以不依赖凝血因子Ⅶ而直接激活凝血因子Ⅰ即FIB有关。FIB升高常常提示预后不良,但其机制尚未完全明确。另有研究认为[17],FIB可能参与肿瘤细胞与内皮细胞的粘附,从而参与肿瘤的血行转移。此外,FIB片段可能促进肿瘤新生血管形成,且FIB在肿瘤组织中沉积可作为肿瘤细胞粘附和转移的细胞外基质,促进肿瘤的侵袭和转移[18-19]。FIB-血小板微血栓可能还有保护肿瘤细胞对抗宿主免疫监视系统的作用,从而导致肿瘤细胞的生长和发展[20]。
本研究结果还显示,FIB与患者性别有关,这可能是由于样本数量较少所致。FIB与β2-MG相关,可能与肿瘤组织细胞破坏释放毒素对血管内皮损伤、肿瘤血管过度增生等导致其具有不同程度的凝血和纤溶异常,而β2-MG在恶性肿瘤中合成和释放增多有关[21]。单因素分析发现,FIB>3.51 g/L、Cr、骨髓中瘤细胞比例升高是多发性骨髓瘤患者预后不良的危险因素,但本研究未表明年龄、治疗方案、ISS分期与预后相关,可能也与样本量较少有关,进一步加大样本量,相关性可能会显现出来。
综上所述,FIB可以作为多发性骨髓瘤患者预后判断的一个独一危险因素,FIB升高提示预后不良,总体生存期缩短。凝血功能检测操作简单,费用较低,其联合血常规、肝肾功能、骨髓形态学等检查,对多发性骨髓瘤的早诊断、早治疗及判断患者预后具有重要价值,可广泛用于临床实践。

