血清IL-6、IL-8、TNF-α在COPD患者肺癌辅助诊断中的价值分析
李林,杨智晖,刘青,梁瑞凯,梁瑞景,冯海利,侯亮,林飞刚
(1.河北省老年病医院呼吸内科,河北 石家庄 050011;2.武安市第一人民医院病理科,河北 武安 056300)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种病情呈持续性进展的慢性呼吸系统疾病,具有较高的发病率和死亡率。根据世界卫生组织(WHO)的统计,目前COPD位居全球人口死因顺位的第4位,我国40岁以上成年人群的COPD患病率为9.9%,且发病率仍然在逐年上升[1]。作为另一种重要的致死性肺部疾病,肺癌的发病率与病死率也呈现逐年上升的趋势。目前肺癌病例占全球恶性肿瘤病例的12%以上,也是导致癌症患者死亡的首位原因[2]。在以往的研究中,学者通常是将COPD与肺癌作为两种独立的疾病进行研究,随着研究的深入,COPD与肺癌的相关性越来越受到重视,COPD已被视为导致肺癌的独立于吸烟之外的另一项危险因素。相关研究结果显示,COPD患者的肺癌发病风险比一般人群高2.76倍[3]。COPD稳定期患者是以胸闷、气促、咳嗽等不完全可逆性气流阻塞为主要临床表现,而肺癌的早期特征为咳嗽、咳痰、痰中带血、低烧、胸闷等,两者的临床症状十分类似,发生在COPD患者的肺癌在临床上易被忽视而且延误治疗[4],故对于COPD患者合并肺癌进行的有效早期诊断,具有十分重要的临床意义。相关研究结果[5]显示,在COPD和肺癌的发生过程中,存在着慢性炎症、氧化应激、免疫应答异常、基因遗传异常等多种共同机制,其中,炎症反应损害是核心环节,COPD的发病主要与气道和肺组织对有害气体或颗粒的慢性炎症反应增强有关,炎症反应导致了肺部及其它众多组织器官的损害,也是引发COPD各类并发症的病理基础[6],而肺癌的发生和发展同样与炎症反应的加剧具有密切的关系。因此,从炎症反应机制出发,通过检测COPD患者的血清炎症因子表达水平对于肺癌进行早期筛查和诊断,具有较为广阔的研究前景。但国内外的相关研究较为缺乏,基于这一研究现状,本研究选取了与COPD和肺癌关系较为密切的血清白细胞介素(IL)-6、IL-8、肿瘤坏死因子-α(TNF-α)作为研究指标,针对这3种血清炎症因子在COPD患者肺癌辅助诊断中的价值进行了分析,现报告如下。
1 资料与方法
1.1 临床资料
选取2014年12月至2015年12月河北省老年病医院收治的41例COPD合并肺癌患者作为研究组,选取41例COPD稳定期患者作为对照组。对所有患者的血清IL-6、IL-8、TNF-α水平进行分析。
纳入标准:COPD稳定期诊断标准参考中华医学会呼吸病学分会慢性阻塞性肺疾病学组制订的《慢性阻塞性肺疾病诊治指南(2013年修订版)》[7],肺癌的诊断标准参考卫计委制订的《原发性肺癌诊疗规范(2011年版)》[8],患者年龄均>18岁,临床资料完整。排除标准:(1)明确诊断为COPD急性加重期合并肺癌的患者;(2)合并有肺结核、哮喘、支气管扩张、慢性支气管炎、肺炎、肺部良性肿瘤等其它肺部疾病的患者;(3)明确诊断合并有其它部位原发性恶性肿瘤的患者;(4)入院前接受过手术、放疗、化疗、靶向治疗等抗肿瘤治疗的患者;(5)合并心脑卒中、自身免疫疾病、肝肾功能不全、血液系统疾病的患者;(6)妊娠期或哺乳期患者。所有患者均对本研究知情并签署知情同意书。
1.2 检测指标
于入院当日对两组患者的年龄、性别、COPD病程、吸烟史、合并症进行调查和分析,对两组患者的体质指数(BMI)、一秒用力呼出量(FEV1)、用力肺活量(FVC)进行检测和分析;于入院次日采集空腹外周静脉血样本3 mL,于常温下静置2 h后,以3 000 r/min的速度离心15 min后分离血清,置于-18 ℃冰箱中保存待测,采用酶联免疫吸附法(ELISA法)对血清IL-6、IL-8、TNF-α水平进行检测和分析,试剂购自美国R&D Systems公司,严格按照说明书步骤操作。
1.3 统计学分析
2 结果
2.1 两组患者临床资料的比较
两组患者在年龄、性别构成、病程、吸烟史、合并症、BMI、FEV1、FVC水平方面比较,差异均无统计学意义(P>0.05)。见表1。
2.2 两组患者血清IL-6、IL-8、TNF-α水平的比较
研究组的血清IL-6、IL-8、TNF-α水平均高于对照组,差异有统计学意义(P<0.05)。见表2。
2.3 血清IL-6、IL-8、TNF-α水平在COPD患者合并肺癌辅助诊断中的价值分析
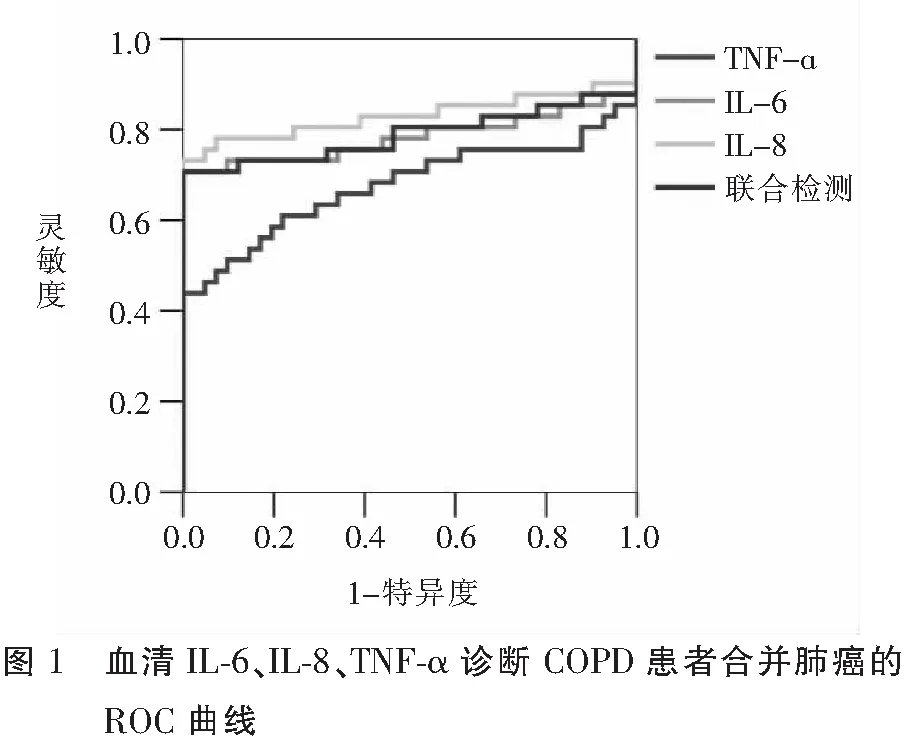
Logistic多元回归分析结果显示,COPD患者合并肺癌的发生与血清IL-6、IL-8、TNF-α水平均具有相关性(P<0.05)。见表3。ROC曲线分析结果显示,血清IL-6、IL-8、TNF-α水平诊断COPD患者合并肺癌的AUC分别为0.783、0.830、0.677(P<0.05),其中,以血清IL-8的AUC最高,在Cutoff值下,灵敏度和特异度分别为0.732和1.000,当将3种血清指标进行联合检测时,AUC未获得提高。见表4、图1。
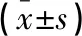
表1 两组患者临床资料的比较
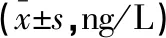

组别IL-6IL-8TNF-α研究组(n=41)57.10±26.9663.03±34.7939.31±13.48对照组(n=41)30.73±6.7123.65±5.6331.17±5.03t值6.0767.1553.623P值<0.001<0.0010.001
表3血清IL-6、IL-8、TNF-α水平与COPD患者合并肺癌相关性的Logistic多元回归分析

变量β值S.E.值Waldχ2值P值OR值OR值的95.0%置信区间下限上限IL-60.1150.03322.336<0.0011.9921.9272.057IL-80.0850.02314.368<0.0011.0891.0441.134TNF-α0.0640.01610.037<0.0011.2691.2381.300常数项-3.0370.72017.794<0.0010.048--

表4 血清IL-6、IL-8、TNF-α诊断COPD患者合并肺癌的价值分析
3 讨论
研究结果显示,COPD稳定期患者与COPD合并肺癌患者在人口学特征、病程、合并症、吸烟史、肺功能指标、消瘦状态等方面比较,差异均无统计学意义。相关研究[9]显示,COPD合并肺癌患者常见于中老年男性,特别是吸烟指数较高的患者,患者的临床症状以咯血、胸痛、消瘦、肺不张、胸腔积液、声音嘶哑、乏力为主,其中,以咯血、胸腔积液等症状比较严重,肺功能可出现显著的下降。然而,COPD稳定期患者(特别是病程较长、并发症较多的患者)也会出现类似的临床表现,故根据临床症状和体征进行鉴别诊断的难度较大,利用血清标志物对COPD合并肺癌进行有效的辅助诊断具有重要的临床意义。关于炎症因子在COPD合并肺癌发病中的机制研究已成为一项热门的课题,相关研究[10-11]已证实了IL-17A、IL-17F、IL-22、IL-23等辅助性T细胞(Th)17相关细胞因子及转化生长因子-β(TGF-β)等上皮-间质转换EMT相关调节因子的异常表达均与COPD合并非小细胞肺癌(NSCLC)发病具有相关性。但针对血清炎症因子标志物对于COPD合并肺癌的诊断研究并不充分,需要进一步的临床研究予以分析和讨论。
与COPD稳定期患者相比较,COPD合并肺癌患者的血清IL-6、IL-8、TNF-α水平出现了显著升高,特别是血清IL-6、IL-8水平在辅助诊断COPD合并肺癌中具有一定的价值。在一项针对COPD慢性炎症环境对肺癌生长、转移影响的动物模型研究中,研究者发现,IL-6、IL-8在COPD合并肺癌的动物模型肺组织及血清中的表达水平均高于单纯肺癌模型或单纯COPD模型,其中,IL-6的表达水平较单独COPD模型增加2倍以上,较空白对照模型增加5倍以上[12]。IL-6是一种由巨噬细胞产生的细胞因子,能够清除传染性病原体、诱导受损组织愈合、触发急性期免疫反应和凝血级联反应,可发挥多种生物保护功能[13]。IL-6的过表达已被证实是恶性肿瘤增殖和侵袭的重要机制,多项研究证实了在肿瘤患者外周血和肿瘤组织中IL-6均呈表达上调,IL-6可与其相应受体结合活化STAT3和Twist,从而上调E-cadherin表达并下调N-cadherin、Vi-mentin、Snail等表达,诱发癌细胞发生EMT,从而提升肿瘤细胞的侵袭力和远处侵袭能力,抗IL-6治疗也成为了肿瘤防治中的热点应用课题之一[14]。在针对肺癌的相关研究中发现,NSCLC患者的肺组织和外周血中均可观察到IL-6表达水平的上升,而且肺组织中的IL-6水平与肿瘤大小、组织分型、临床分期、分化类型等均具有一定的相关性。在接受手术、放化疗等抗肿瘤治疗后,可观察到患者血清IL-6水平的下降,且血清IL-6水平与治疗效果具有相关性[15-17]。IL-8是一种促趋化性细胞因子,主要由单核细胞、免疫细胞、上皮细胞等产生,在机体的炎症和免疫防御机制中发挥着重要的作用,当发生病原体入侵时,炎症组织表达的IL-8可与中性粒细胞表面的相关受体结合,对中性粒细胞发挥趋化作用,使之迁移至炎症部位发挥吞噬和杀灭病原体的作用。IL-8在肺癌等上皮源性恶性肿瘤的预后预测、肿瘤细胞耐药性评价、放射性肺损伤预测和细胞干性调控等方面均具有重要的作用[18-19]。相关研究[20-22]显示,初诊肺癌患者的血清IL-8水平高于健康人群,随着病情的加重,其水平也不断升高,与肿瘤的分化、是否淋巴结转移及肿瘤分期均有关,体外研究也证实了IL-8可通过调节Racl、Cdc42等蛋白的表达促进肺癌细胞增殖和迁移。可见,IL-6、IL-8的表达上调是与肺癌发病相关的重要表现之一,但血清炎症因子的过表达也是COPD患者的重要表现,较少的研究者针对两类患者的血清IL-6、IL-8水平进行对比分析。本研究认为,IL-6、IL-8的持续高水平表达可能参与了COPD合并肺癌的发生,此类患者的血清IL-6、IL-8水平相较COPD稳定期患者升高幅度更大,这两个指标可用于辅助鉴别诊断。
研究发现,在COPD合并肺癌患者中虽然也可观察到血清TNF-α水平的升高,但其在辅助诊断中的AUC较低,特别是在Cutoff值下的灵敏度较低,而且在将其与血清IL-6、IL-8进行联合检测时,也未能提升诊断效能,这提示了虽然TNF-α水平表达水平的上调可能参与了COPD合并肺癌的发生,但其变化趋势可能与IL-6、IL-8具有一定的差异。产生这一结果的原因可能是由于TNF-α是一种具有促进炎症反应和抗肿瘤双重生物学功能的细胞因子。TNF-α在与相关受体结合后,可激活多种信号通路,对炎性反应、免疫功能、细胞凋亡等发挥调节作用,相关研究[23-24]已证实了TNF-α的表达异常在胃癌等上皮源性肿瘤的发病、增殖、侵袭、转移、上皮间质转化、新生血管形成等多个病理过程中均发挥着重要的作用。与此同时,TNF-α可对肿瘤细胞发挥直接杀伤作用,可作为治疗恶性肿瘤的药物[25]。在针对肺癌患者的相关研究[26-28]证实了肺癌患者血清TNF-α水平呈现上升趋势,其水平与肺癌的发病及进展相关,在接受手术治疗后,其水平会逐渐降低,而且TNF-α特定位点基因多态性与中国原发性肺癌发病易感性显著相关。显然,血清TNF-α水平的升高提示着肺癌发生风险的上升,但它在COPD患者合并肺癌病理过程中的作用和变化趋势相对比较复杂,这需要进一步的研究予以讨论和分析,同时,临床医生在诊断应用中需要将其与其它肿瘤标志物协同考查。
综上所述,相对于COPD稳定期患者,COPD合并肺癌患者表现为血清IL-6、IL-8、TNF-α水平更加显著的上升,其中,血清IL-6、IL-8水平能够较好地用于COPD合并肺癌的辅助诊断,临床医生应对COPD患者的血清炎症因子水平进行有效监测,以提高肺癌的早期诊断效率。

