雷替曲塞pH敏感脂质体的制备研究
张彩丽 张亦斌 邓盛齐 张金霞 罗玉莹
(1 抗生素研究与再评价四川省重点实验室,成都大学,四川抗菌素工业研究所,成都 610052)
脂质体作为新型的药物传递载体,具有良好的靶向性和生物相容性[1]。然而常规脂质体在进入人体后,仍然会被肝和脾脏的网状内皮系统(reticuloendothelial system,RES)迅速识别和摄取,从而缩短药物的血浆半衰期[2]。此外,脂质体主要通过内吞小泡的方式进入细胞,随后进入溶酶体,最终脂质体和被包封的药物仍然无法避免被溶酶体降解的风险。
为解决这一问题,大量物理响应、化学响应和生物响应的纳米材料被用于脂质体药物传递系统[2-3],其中pH敏感脂质体被视为避免药物被溶酶体降解的最有效途径之一。由于较高的代谢速率,肿瘤组织的pH值(5.3~6.3)通常低于正常组织,亚细胞水平内涵体和溶酶体的pH值通常在4.5~5.5之间,这些不同组织和器官之间pH的差异为pH敏感脂质体的设计提供了思路[4]。通常pH敏感脂质体在中性和弱碱性条件下较稳定,而酸性条件下不稳定[5],当pH值从生理环境7.4变到肿瘤组织微环境5.3~6.3时,pH敏感脂质体的膜结构也将发生相应的改变,从而释放内容物[6],发挥抗肿瘤效果。因此,pH敏感脂质体对抗肿瘤药物的研发具有重要的研究价值。
雷替曲塞是一种胸腺嘧啶合成酶抑制剂,1996年在英国上市,目前国内外的上市制剂为注射用冻干粉针,已有16个国家将其作为治疗晚期结直肠癌的一线药物[7]。由于不能有效区分正常细胞和快速增长的肿瘤细胞,使得其到达肿瘤组织的药量较少、不良反应较大[8-9]。为进一步发挥其一线治疗的作用,做创新性的制剂改良非常必要。本研究制备雷替曲塞pH敏感脂质体,并对其处方和制备工艺进行优化,然后对所优化的pH敏感脂质体进行评价,以期望提高雷替曲塞抗肿瘤作用的靶向性,更好的发挥其抗肿瘤作用。为开发具有靶向作用的雷替曲塞新型药物传递系统提供相应的理论依据与实验基础。
1 仪器与材料
1.1 仪器
LC-20A型高效液相色谱仪(日本Shimadzu公司,LC-20AT泵、SIL-20A自动进样器、CTO-20A柱温箱、SPD-20A检测器、Chromato-Solution Light色谱工作站),pH酸度计(Mettler Toledo,型号:092ZY619),台式微量高速离心机(湘仪®,型号:H1650-W),超声波细胞破碎仪(沃信仪器,型号:VOSHIN92-Ⅱ),十万分之一电子分析天平(德国Sartorius公司,型号:CPA225D),旋转蒸发仪(上海亚荣生化仪器厂,型号:20151345)、激光粒度仪/Zeta电位分析仪(英国Malvern,zetasizer nano ZS90)、酶标仪(Biotek公司,型号:Bio-TekELX800)、细胞培养箱(Thermo公司,型号:HERAcell 2401)。
1.2 材料
雷替曲塞(北京迈劲医药科技有限公司,纯度>99%),雷替曲塞对照品(北京迈劲医药科技有限公司,纯度99.3%),甲醇、乙腈(国药集团化学试剂有限公司,色谱纯),葡聚糖凝胶G-50(瑞典Pharmacia公司)、磷脂酰乙醇胺(DOPE,瑞士Corden公司)、胆固醇半琥珀酸酯(CHEMS,Sigma公司)、HSPC(日本精化株式会社)、PC-98T(日本精化株式会社)、Na3PO4、NaH2PO4、Na2HPO4等试剂(成都科龙试剂有限公司,分析纯)、胎牛血清(Gibco公司)、10%FBS培养基(Gibco公司)、CCK8试剂(七海生物)、HCT-116细胞(ATCC)。
2 方法与结果
2.1 pH敏感脂质体的制备
采用冻融法制备脂质体。精密称取处方量的脂质材料DOPE和CHEMS溶于氯仿中,在40℃条件下通过减压旋蒸法除去氯仿使形成均匀的脂质体薄膜,真空干燥过夜;加入含处方量雷替曲塞的磷酸盐缓冲液5mL;40℃水化1h,得雷替曲塞pH敏感脂质体混悬液;经超声波细胞破碎仪破碎2min(破碎2S,间隔3S)后,-20℃/40℃条件冻融3次,即得雷替曲塞pH敏感脂质体。
2.2 包封率的测定
采用SephadexG-50凝胶柱对游离药物进行分离,测定脂质体的包封率。精密移取雷替曲塞pH敏感脂质体0.5mL,上样,用0.05mol/L NaH2PO4(pH8.0)溶液进行洗脱(流速为3mL/min),收集50mL游离药物洗脱液,测定并计算脂质体中游离药物的质量W游离。另精密移取雷替曲塞pH敏感脂质体0.5mL于50mL量瓶中,加入一定量10% triton X-100溶解脂质体,并用洗脱液定容至刻度,测定并计算脂质体中总药物的质量W总,按包封率公式(包封率(EE/%)=(1-W游离/W总)×100%)计算脂质体包封率。
2.3 含量测定
本实验采用HPLC法测定雷替曲塞pH敏感脂质体中药物的含量。色谱条件及系统适用性实验:色谱柱:ZORBAX Eclipse Plus C18(4.6mm×250mm,5μm);流动相为pH7.25乙腈-磷酸盐缓冲液(含0.25%磷酸二氢钠和0.25%磷酸氢二钠)=14:86;流速1.0mL/min;柱温:40℃;进样量20μL;检测波长227nm。
2.4 单因素处方筛选(图1)
2.4.1 磷脂种类对雷替曲塞pH敏感脂质体粒径和包封率的影响
磷脂双分子层是组成脂质体膜的主要成分,因此本实验选用了3种不同的磷脂(HSPC、DOPE和PC-98T)制备pH敏感脂质体,以考察磷脂种类对pH敏感脂质体包封率的影响。结果表明磷脂种类对雷替曲塞pH敏感脂质体的粒径和包封率都有较大的影响,其中,采用DOPE制备的雷替曲塞pH敏感脂质体粒径最小,且包封率最高。因此选用DOPE制备雷替曲塞pH敏感脂质体。
2.4.2 DOPE与CHEMS比例对雷替曲塞pH敏感脂质体粒径和包封率的影响
DOPE和CHEMS是组成pH敏感脂质体的主要成分,因此考察了DOPE与CHEMS比例(3:1、3:2和4:3,摩尔比)对雷替曲塞pH敏感脂质体包封率的影响。结果表明,二者的比例对脂质体的粒径影响不大,当DOPE:CHEMS为3:2时所制备的雷替曲塞pH敏感脂质体包封率最高。经查阅文献和前期预实验知[10],当DOPE:CHEMS为3:2时所制备的pH敏感脂质体pH敏感效果最好,所以选用摩尔比为3:2的DOPE和CHEMS制备雷替曲塞pH敏感脂质体。

图1 磷脂种类(A)、DOPE与CHEMS比例(B)、药脂比(C)、水相pH(D)、缓冲液浓度(E)和超声功率(F)对pH敏感脂质体粒径和包封率的影响(n=3,±s)Fig.1 Effect of the kind of lipid(A),mass ratio of DOPE to CHEMS(B),mass ratio of drug to lipid(C),the pH of aqueous(D),concentration of lipid(E),the energy of ultrasonic(F)on particle size and entrapment ef ficiency(n=3,±s)
2.4.3 药脂比对雷替曲塞pH敏感脂质体粒径和包封率的影响
考察了药脂比(3:10、1:10和1:20)对雷替曲塞pH敏感脂质体的影响,结果表明药脂比对脂质体的粒径影响较小,对包封率的影响较大。因此,选择药脂比1:10~1:30用于后续多因素考察实验。
2.4.4 水相pH对雷替曲塞pH敏感脂质体粒径和包封率的影响
因为制备脂质体的膜材对pH较为敏感,所以水相(磷酸盐缓冲液)pH对雷替曲塞pH敏感脂质体的包封率影响较大。本实验考察了不同pH值磷酸盐缓冲液(pH7.4~8.5)对pH敏感脂质体粒径和包封率的影响。结果显示水相pH越小时脂质体越容易聚集且粒径会变大,随pH增大包封率也将变大。所以选择水相pH值在8.0~9.0之间。
2.4.5 缓冲液浓度对雷替曲塞pH敏感脂质体粒径和包封率的影响
考察了不同浓度的磷酸盐缓冲液(0.01、0.02和0.05mol/L)对脂质体粒径和包封率的影响,结果表明,随缓冲液浓度增大,脂质体包封率逐渐增大而粒径变化不明显。因此选择磷酸盐缓冲液0.02~0.05mol/L用于后续多因素实验。
2.4.6 超声功率对雷替曲塞pH敏感脂质体粒径和包封率的影响
考察了超声功率/能量(10%~30%,总功率为650w)对pH敏感脂质体包封率的影响,结果表明随超声功率变大,pH敏感脂质体的粒径和包封率将逐渐减小,可能超声功率过大将导致部分脂质体破坏泄露出被包封的药物。因此选择超声能量在10%~20%之间。
2.5 正交设计法优化最佳处方
单因素考察实验结果表明,在保证pH敏感和粒径适当的前提下,药脂比(A)、水相pH(B)、缓冲液浓度(C)和超声能量(D)为影响pH敏感脂质体包封率的主要因素,因而选取这4个因素作为考查对象,采用L9(34)正交表设计实验,以包封率为指标进行评价,得到优化的pH敏感脂质体处方。结果见表1所示。
根据表1中极差R分析:A>B>D>C,表明缓冲液浓度对雷替曲塞pH敏感脂质体的包封率影响最小。以表1中R值最小的因素作为误差估计,对正交试验结果进行方差分析,结果见表2。

表1 雷替曲塞pH敏感脂质体制备工艺参数优化Tab.1 Optimization of preparation parameters of raltitrexed pH-sensitive liposome
通过上述制备工艺参数的优化,得到雷替曲塞pH敏感脂质体的最优制备处方条件,即以DOPE和CHEMS的摩尔比为3:2,药脂比为1:20,水相为0.05mol/L NaH2PO4缓冲液(pH8.5),超声波细胞破碎仪的超声能量为10%制备雷替曲塞pH敏感脂质体。
2.6 pH敏感脂质体的工艺确认
按最优处方制备3批雷替曲塞pH敏感脂质体(批号:052401、052402和052403),以外观性状、粒径及分布、多分散指数(PDI)、Zeta电位和包封率为评价指标对制备的3批pH敏感脂质体进行质量评价。052402批样品的粒径分布和微观形态如图2所示,所制备的3批pH敏感脂质体为白色泛蓝色乳光的混悬液体,透射电镜下观察到所制备pH敏感脂质体大小均一圆整,平均粒径为(227.0±21.4)nm,PDI为0.223±0.061,Zeta电位为(-44.2±3.6)mV,包封率为(58.3±2.1)%。结果表明,按最优处方制备的3批样品,各项特性指标均符合要求,质量均一,工艺重现性较好。

表2 方差分析表[F0.05(2,2)=19.00]Tab.2 Variance analysis table[F0.05(2,2)=19.00]

图2 雷替曲塞pH敏感脂质体的透射电镜图及粒径分布Fig.2 The TEM and size distribute of raltitrexed pH-sensitive liposome
2.7 体外释放度考察
分别配置pH值为5.0、6.0和7.4的磷酸盐缓冲液各25mL作为体外释放介质,取所制备的载药脂质体1mL于透析袋(截留分子量1000Da)中,将其置于上述释放介质内,采用恒温振荡法,分别于0.5、1、2、4、6、8、12、24和48h取样1mL,补液1mL,计算累积释放度,结果如图3所示,载药脂质体在不同pH介质中释放规律不同,在肿瘤组织的酸性环境即pH5.0和pH6.0的释放介质中,释放较快,在正常组织液环境即pH7.4的释放介质中,释放缓慢,pH敏感作用明显。
2.8 细胞毒性试验
取对数生长期的HCT-116细胞悬液接种于96孔板,每孔100μL(约2000个细胞),至于细胞培养箱内培养24h。采用倍比稀释法配制药物浓度分别为16、8、4、2、1、0.5、0.25、0.125和0.0625μg/mL的脂质体溶液作为载药脂质体组,空白脂质体组为相对应的脂质体浓度的溶液。每孔加入100μL,每个浓度平行5孔,培养72h。培养结束后每孔加入10μL CCK-8溶液,在细胞培养箱内继续培养2h,用酶标仪测定在450nm处的吸收值,计算其细胞存活率。结果表明在一定浓度范围内,空白脂质体无毒性,而载药脂质体抗结肠癌细胞的效果明显(图4)。
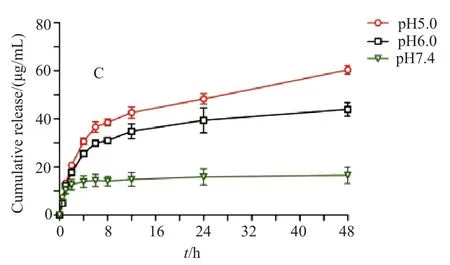
图3 雷替曲塞pH敏感脂质体在pH=5.0、6.0和7.4条件下的体外释放度曲线(n=3,±s)Fig.3 In vitro release pro file of raltitrexed pH-sensitive liposome in PBS(pH=5.0,6.0 and 7.4)(n=3,±s)
3 结论与讨论
雷替曲塞pH敏感脂质体能够在肿瘤组织微环境(pH5.0~6.5)中快速释放,有较好的pH敏感作用。本研究通过处方条件的筛选和优化,成功制备了负载雷替曲塞的pH敏感脂质体。所制备的pH敏感脂质体具有适宜的理化性质,体外释放具有pH敏感的作用,体外细胞毒性试验证明了空白脂质体载体的安全性,载药脂质体制剂对HCT-116细胞的毒性较高。
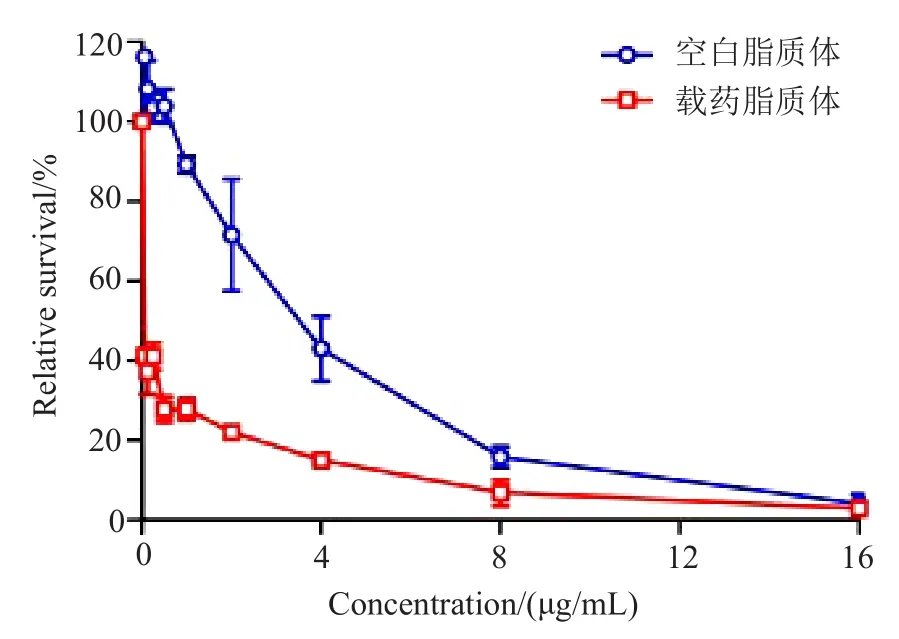
图4 雷替曲塞pH敏感脂质体的细胞毒性(n=5,±s)Fig.4 The cytotoxicity study of raltitrexed pH-sensitive liposome(n=5,±s)
对雷替曲塞药物进行理化性质研究,发现雷替曲塞为水溶性药物。由于水溶性药物的油水分配系数受介质的pH和离子强度影响较大、包封率条件不易控制,所以水溶性药物的包封效果往往不如脂溶性药物。除此之外,水溶性药物可同时分布在脂质体的内水相和外水相,外水相体积通常比内水相体积大得多,基于外水相的亲和力和分散作用,药物更趋向于分布在外水相中。因此,常常采用主动载药法和逆相蒸发法等方法来制备包载水溶性药物的脂质体。通过前期预实验发现,由于pH敏感膜材料的存在,采用主动载药法制备雷替曲塞pH敏感脂质体较为困难;而逆相蒸发法所制得的雷替曲塞pH敏感脂质体包封率明显低于薄膜法所制备的pH敏感脂质体;所以最终确定雷替曲塞pH敏感脂质体的制备方法为冻融法。但是,采用冻融法制备的雷替曲塞pH敏感脂质体的包封率依旧只有60%左右。为了得到具有更高包封率的雷替曲塞pH敏感脂质体,本研究采用葡聚糖凝胶色谱柱或动态膜透析法,对所得雷替曲塞pH敏感脂质体中的游离药物进行分离,最终所得包封率可达到90%。