载硫化铋叶酸靶向相变型超声/光声双模态对比剂体外寻靶及显像研究
周頔,王志刚,文明,吕发金,李咏梅*
1.重庆医科大学附属第一医院放射科,重庆 400016;2.重庆医科大学超声影像学研究所,重庆 400010; *通讯作者 李咏梅lymzhang70@aliyun.com
目前,靶向相变型多功能纳米粒以其能实现液气相变而增强多模态显像以及高度特异性识别靶标而备受关注[1]。全氟己烷(perfluorohexane,PFH)是相变型分子探针最常用的核心材料,当其受外界条件一定的刺激时,介质受热局部温度升高超过液态氟碳相变阈值,发生液-气相转变,从而增强超声显影[2]。近年来,一种新兴的无创医学成像方法光声成像成为研究热点,它兼具了声学成像和光学成像的优点,对靶区具有更高的穿透深度和图像分辨率[3]。硫化铋(bismuth sulfide,Bi2S3)是一种新型的纳米生物材料,在近红外光波长激光作用下能吸收光能实现光声显像[4],展示了作为光声成像增敏剂的潜能。此外,多数上皮源性恶性肿瘤细胞表面高表达叶酸受体,肿瘤组织特异性高。当叶酸分子与肿瘤细胞表面的叶酸受体特异性结合时,能实现多功能分子探针在肿瘤组织的靶向递送,增加分子探针在肿瘤部位富集量,实现多模态成像引导下的精准治疗,提高治疗效果[5]。因此,本研究设计偶联叶酸的乳酸/羟基乙酸共聚物高分子材料包裹PFH及Bi2S3,制备叶酸靶向相变型载 Bi2S3纳米粒(folate receptor-targeted phase-shift nanoparticles carrying bismuth sulfide,FPBS-PFHNPs),探讨其体外寻靶、相变及超声/光声双模态显像能力。
1 材料与方法
1.1 主要试剂及设备 叶酸靶向乳酸/羟基乙酸共聚物(poly lactic-co-glycolicacid-folate,PLGA-FA,重庆浦诺维生物科技有限公司)、PFH(美国Avanti公司)、乳酸/羟基乙酸共聚物(PLGA,重庆浦诺维生物科技有限公司)、Bi2S3(中国科学院上海硅酸盐研究所)、聚乙烯醇(PVA,美国Sigma公司)、DiO荧光染料(上海碧云天生物技术有限公司)、DiI荧光染料(上海碧云天生物技术有限公司)、电子天平(上海精天电子仪器有限公司)、超声声振仪(美国SONICS & MATERIALS公司、高速分散均质机(FJ300-SH,上海)、高速冷冻离心机(德国Ependorf公司)、倒置荧光显微镜(日本Olympus公司)、激光粒径仪(美国Malvern公司)、JC型高强度聚焦超声治疗系统(重庆海扶技术有限公司)、Vevo laser光声成像系统(加拿大VisualSonics公司)。
1.2 FPBS-PFH-NPs的制备 将50 mg PLGA-FA与500 µl Bi2S3溶于 10 ml三氯甲烷中,再加入 200 µl PFH后冰浴环境下声振60 s,再加入5 ml 4% PVA溶液,高速分散均质机均质5 min,然后加入20 ml 2%异丙醇,旋蒸1~2 h,离心洗涤2次(5000 r/min,5 min),弃上清液和底层未包裹的Bi2S3,得到载Bi2S3叶酸靶向相变型纳米粒(FPBS-PFH-NPs),保存于4℃冰箱备用。在声振之前的连续相中加入少量DiI则可制备带荧光的FPBS-PFH-NPs。按照上述方法分别制备载Bi2S3非靶向相变型纳米粒(non-folate receptortargeted phase-shift nanoparticles carrying bismuth sulfide,NPBS-PFH-NPs)组、未载Bi2S3叶酸靶向相变型纳米粒(folate receptor-targeted phase-shift nanoparticles,P-PFH-NPs)组,以双蒸水作为对照组。
1.3 FPBS-PFH-NPs基本特性检测 用光学显微镜及倒置荧光显微镜观察其表面形态,Malvern激光仪测量其粒径大小、表面平均电位,采用紫外分光光度法检测Bi2S3及FPBS-PFH-NPs的吸收光谱。
1.4 体外细胞寻靶实验 宫颈癌Hela细胞在37℃、5% CO2恒温培养箱中培养,消化对数生长期的Hela细胞接种于激光共聚焦培养皿中,培育24 h,实验分为靶向组和非靶向组,分别在各组加入100 µl经DiI标记的FPBS-PFH-NPs和NPBS-PFH-NPs。孵育2 h,加入DiO(1 mg/ml)对Hela细胞染色,孵育20 min后,弃DiO,PBS冲洗2~3次,在激光共聚焦显微镜(×400)下观察FPBS-PFH-NPs、NPBS-PFH-NPs组与Hela细胞结合情况。用上述同样的方法观察FPBSPFH-NPs和NPBS-PFH-NPs与正常人肝L02细胞的结合情况。
1.5 体外热致相变实验 吸取一滴稀释后的 FPBSPFH-NPs置于载玻片上,将载玻片置于倒置荧光显微镜配套的电加热板中调整光镜聚焦后逐渐升温加热板,观察纳米粒的大小及形态变化。
1.6 体外声致相变及超声显像实验 取5 ml双蒸水稀释的FPBS-PFH-NPs装入EP管中,固定于高强度聚焦超声(HIFU)治疗仪中,再用不同声功率60 W、90 W、120 W、150 W、180 W HIFU辐照,时间2 s,以脱气水为对照,采集FPBS-PFH-NPs相变前后二维及造影模式超声图像,用DFY定量分析仪(重庆医科大学超声影像学研究所研制)测量其回声强度变化。
1.7 体外光致相变及光声显像 分别取适量双蒸水、P-PFH-NPs、FPBS-PFH-NPs溶液注入空洞凝胶模型中,置于光声成像仪平台上,以一定波长激光辐照各组样品2 min,记录各组激光辐照前后的二维及造影模式超声图像和光声图像。
1.8 统计学分析 采用SPSS 21.0软件,计量资料以±s表示,采用独立样本t检验比较FPBS-PFH-NPs与双蒸水的回声强度差异,P<0.05表示差异有统计学意义。
2 结果
2.1 FPBS-PFH-NPs纳米粒的基本特性 FPBS-PFHNPs呈圆形,形态规则,分布均一(图1A)。倒置荧光显微镜观察载DiI的FPBS-PFH-NPs散发红色荧光(图1B)。FPBS-PFH-NPs粒径为(439.7±93.7)nm(图1C),Zeta电位值为(-15.5±5.8)mV(图1D)。紫外分光光度法测得FPBS-PFH-NPs与单纯Bi2S3吸收光谱吸收峰相对应,在近红外光波长处均有广泛的吸光能力(图1E)。

图1 FPBS-PFH-NPs基本性能检测。A.光镜下观察FPBS-PFH-NPs;B.荧光显微镜下观察DiI标记的FPBS-PFH-NPs;C.FPBSPFH-NPs的粒径;D.FPBS-PFH-NPs的电位;E.紫外分光光度法检测FPBS-PFH-NPs与Bi2S3吸收光谱
2.2 体外细胞寻靶实验 激光共聚焦显微镜下观察叶酸靶向组 FPBS-PFH-NPs见大量红色纳米粒紧密地、特异性地结合在Hela细胞周围,表明FPBS-PFHNPs有主动靶向宫颈癌Hela细胞的能力。而非靶向组NPBS-PFH-NPs未见明显红色纳米粒与Hela细胞结合。而在负性细胞正常人肝L02细胞中,无论是靶向组还是非靶向组均未见纳米粒与 L02细胞特异性结合(图2)。
2.3 体外热致相变 当加热板温度为 60℃、64℃、66℃、68℃、70℃、73℃时,光镜下FPBS-PFH-NPs的变化见图3。
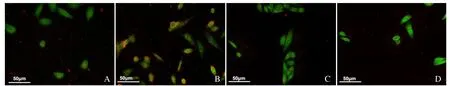
图2 激光共聚焦显微镜观察体外寻靶结果,各组纳米粒与细胞分别散发红色和绿色荧光。A.非靶向组NPBS-PFH-NPs与Hela细胞未见明显结合;B.叶酸靶向组FPBS-PFH-NPs大量结合在Hela细胞周围;C.非靶向组NPBS-PFH-NPs与肝L02细胞未见明显结合;D.叶酸靶向组FPBS-PFH-NPs与肝L02细胞未见明显结合

图3 FPBS-PFH-NPs热致相变光镜图。A.60℃时FPBS-PFH-NPs未发生明显变化;B.64℃开始出现微气泡;C.66℃时微气泡数量逐渐增多;D.68℃时微气泡体积和数量继续增加;E.70℃时部分微气泡破裂,部分融合为更大的气泡;F.73℃时更多微气泡破裂
2.4 体外声致相变及超声成像 不同功率HIFU作用于FPBS-PFH-NPs后,超声回声强度较作用前增加,当功率从60 W增加到180 W时,其回声强度逐渐增强,而双蒸水组在高达180 W功率作用后的回声强度无明显变化,两者差异有统计学意义(P<0.05),见图4。
2.5 体外光致相变及超声/光声成像 激光辐照后,FPBS-PFH-NPs(图5I~L)与P-PFH-NPs组(图5E~H)二维、造影模式回声强度高于双蒸水组(图5A~D),而双蒸水组辐照前后未见明显变化;而 FPBS-PFHNPs组(图6E~F)光声信号明显高于P-PFH-NPs(图6C、D)与双蒸水组(图6A、B),而后两者辐照前后均无明显变化。

图4 声致相变后的超声成像。A、I.HIFU作用前双蒸水的二维及造影模式;B、J.HIFU作用(180 W)后双蒸水的二维及造影模式;C、K.HIFU作用前FPBS-PFH-NPs的二维及造影模式;D~H.HIFU作用后FPBS-PFH-NPs的二维模式,功率依次为60 W、90 W、120 W、150 W、180 W;L~P.HIFU作用后FPBS-PFH-NPs的造影模式,功率依次为60 W、90 W、120 W、150 W、180 W;Q.不同功率HIFU作用FPBS-PFH-NPs与双蒸水组相变前后的回声强度;与双蒸水组比较,*P<0.05


图5 激光辐照前后光致相变的二维及造影模式超声成像。A、B.双蒸水组辐照前;C、D.双蒸水组辐照后;E、F.P-PFH-NPs组辐照前;G、H.P-PFH-NPs组辐照后;I、J.FPBS-PFH-NPs组辐照前;K、L.FPBS-PFH-NPs组辐照后,FPBS-PFH-NPs与P-PFHNPs组二维、造影模式回声强度明显高于双蒸水组,而双蒸水组无明显变化

图6 激光辐照前后的光声成像。A、B.双蒸水组,C、D.P-PFH-NPs组,E、F.FPBS-PFH-NPs组;FPBS-PFH-NPs组光声成像信号明显高于P-PFH-NPs与双蒸水组,而后两者辐照前后均无明显变化
3 讨论
目前研究的靶向分子探针具有抗原性、与靶点结合率低、产量低、制备繁琐等缺点,因此,寻求一种制备简单、靶向特异性及灵敏度高的靶向分子探针成为研究热点[6]。叶酸分子具有质量小、免疫原性低、易于修饰、高度特异性、达靶点时间短等优点,当叶酸与高表达叶酸受体的肿瘤细胞特异性结合时,能够开启受体介导的主动靶向策略,实现真正意义上的肿瘤细胞分子显像及治疗,是理想的靶向分子探针[7]。叶酸受体在乳腺癌、卵巢癌、宫颈癌、鼻咽癌等多数上皮源性恶性肿瘤细胞表面高表达,却几乎不表达于正常组织细胞表面,具有良好的肿瘤组织特异性[8]。本研究体外寻靶实验显示,靶向组见大量FPBS-PFHNPs紧密结合在 Hela细胞周围,而非靶向组未见NPBS-PFH-NPs与Hela细胞结合,表明FPBS-PFHNPs具有良好的主动靶向宫颈癌Hela细胞的能力。由于L02细胞是正常人肝脏细胞,几乎不表达叶酸受体,故FPBS-PFH-NPs、NPBS-PFH-NPs与L02细胞作用后均未见明显特异性结合,证实FPBS-PFH-NPs对靶标的高度特异性。
FPBS-PFH-NPs的核心相变材料是PFH,沸点为56℃,室温下呈液态,不容易气化,具有良好的稳定性及低毒性,其保存或制作乳剂相对容易。当温度升高超过沸点或外界压力减小至气化压力阈值时,PFH能够由液态转变为气态,即液气相变[9],增强超声成像效果。同时包裹的Bi2S3纳米颗粒也能改变组织声阻抗,协同增效背向散射能力,增强超声显影[10]。在体外相变实验中,FPBS-PFH-NPs随着加热板的升温,核心PFH达到气化阈值而发生液气相变成微气泡,当升温到一定程度时,微气泡就会破裂,证明PFH被成功包裹入纳米粒中并具有相变能力。当一定能量的 HIFU辐照FPBS-PFH-NPs后,其超声回声强度较作用前明显增加,随着功率增大,其回声强度逐渐增强,而双蒸水组在HIFU辐照前后均无明显变化,其原因为HIFU产生的热效应等促使PFH发生液气相变,相变的纳米粒协同增强HIFU的空化效应,发生相变的FPBS-PFH-NPs数量增多,形成更多的微气泡,气泡与周围环境声阻抗的差异明显更大,从而增强背向散射及超声显影。
光声成像利用宽束短脉冲激光辐照生物组织,组织内吸光子吸收光能后转化为热能,引起周围介质温度升高,产生热弹性膨胀,进而散发出声波信号,经传声器及图像处理系统接受并重建出光声图像,其光声信号强弱与光源及生物组织中的吸光成分密切相关[4,11]。本实验构建的FPBS-PFH-NPs在激光作用后检测到明显的光声信号,而P-PFH-NPs与双蒸水组均未见到明显变化。由于FPBS-PFH-NPs成功包裹Bi2S3后在近红外光作用下与单纯Bi2S3吸收光谱接近,具有较强的光吸收属性,能吸收近红外波段的激光能量,对靶区组织行光声成像,是良好的光声成像显像剂[12]。同时,激光辐照后,P-PFH-NPs和双蒸水组均未见明显变化,而FPBS-PFH-NPs组二维、造影模式超声成像明显增强,其原因可能是Bi2S3吸收激光能量转化为热能,使介质温度升高超过PFH沸点,发生液气相变为微气泡,增强靶区超声显影,成功证明了FPBS-PFHNPs具备光致相变及光声成像能力。
本实验成功制备了叶酸靶向相变型超声/光声双模态对比剂FPBS-PFH-NPs,具备良好的体外寻靶、相变及增强超声/光声显像能力,是一种极具发展潜能的靶向诊疗多功能分子探针。

