AtDREB1A基因过量表达对马铃薯生长及抗非生物胁迫基因表达的影响
贾小霞 齐恩芳 刘 石 文国宏,* 马 胜 李建武黄 伟
基因过量表达对马铃薯生长及抗非生物胁迫基因表达的影响
贾小霞1,2齐恩芳1,2刘 石1,2文国宏1,2,*马 胜1,2李建武1,2黄 伟1,2
1甘肃省农业科学院马铃薯研究所 / 甘肃省马铃薯种质资源创新工程实验室, 甘肃兰州 730070;2农业部西北旱作马铃薯科学观测实验站, 甘肃渭源 748201
为明确基因过量表达对马铃薯生长及基因表达的影响,以马铃薯品种陇薯3号(L3)及其转基因株系T2为材料,采用盆栽试验,在马铃薯盛花期将盆土含水量控制为田间最大持水量(FWC)的45%~50%,观察转基因前后植株表型,并研究叶片MDA含量、RWC、SOD和POD活性及其基因表达的差异。结果表明, 正常浇水条件下2个株系各指标差异不大。胁迫20 d后,转基因植株T2的表型明显好于对照L3,且RWC显著高于L3;各株系叶片的MDA含量、SOD和POD活性均明显上升,但转基因植株MDA含量上升幅度较对照小,抗氧化保护酶SOD、POD活性升高幅度较对照大, 说明转基因植株细胞膜损伤和膜脂过氧化程度较轻, 植株的耐旱性明显提高。转录组测序及生物信息学分析发现,转基因材料T2相对于L3的差异表达基因共430个,其中上调表达基因287个,下调表达基因143个。功能注释和显著性富集结果表明,差异表达基因富集涉及 GO 功能分类体系中生物过程、细胞组分和分子功能3个大类别,且大部分集中在细胞内和膜上,主要涉及信号传导、氧化还原、生物调解、应激反应、发育过程、系统免疫过程、核酸和蛋白结合转录因子活性、转运活性及催化活性。其中抗非生物胁迫相关蛋白PPR、HSP、P450、MLO等家族的大量基因表达量发生较大变化,说明这些基因在转基因马铃薯抵御干旱过程中发挥着非常重要的作用。本研究为进一步解析基因提高马铃薯抗旱性的调控网络奠定了基础。
马铃薯;基因; 非生物胁迫; 差异表达基因; 干旱
转录因子DREB1A/CBF3可以调控一系列与干旱、高盐和低温胁迫相关的功能基因的表达[1-2], 将基因转入农作物可以明显提高受体作物的抗逆性[3-6]目前, 研究者已将基因通过转基因技术导入马铃薯的不同品种中, 并进行了相关的研究。许昆朋[7]将拟南芥基因转化马铃薯鲁引1号块茎, 对温室生长6周的转基因植株光合生理指标及RT-PCR的测定分析表明, 转基因马铃薯中的表达可以直接或间接地诱导多种抗氧化胁迫基因的表达, 以此来提高对低温胁迫的抗性。Dou等[8]以转基因马铃薯为试验材料, 研究基因表达与高温逆境的相关性。通过对温室生长6周的植株抗逆相关生理指标的测定及qRT-PCR分析表明, 高温可以诱导转基因植株中的表达,基因的表达明显提高了抗氧化基因(、、和)、光合基因(、)以及蔗糖和淀粉合成基因(、)的表达量, 明显提高了转基因马铃薯的耐热性。本课题组通过农杆菌介导法将基因导入陇薯系列马铃薯中[9-10], 以不同浓度的PEG溶液模拟不同程度的干旱胁迫条件, 通过对试管苗的电导率, 超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(ASP)活性的测定及转基因植株中基因的表达情况分析表明,基因的转入提高了抗氧化酶活性, 增强了转基因马铃薯试管苗在干旱环境下的耐受能力。多项研究表明,基因的转入, 明显提高了马铃薯的抗逆性, 但关于提高马铃薯抗逆机制的研究主要集中在生理学和个别基因的表达变化层面, 不能全面分析其调控机制, 研究结果具有一定的局限性。
本研究在严格控水条件下, 试图在明确基因过量表达对马铃薯植株表型、叶片相对含水量、丙二醛含量和抗氧化酶活性影响效应的基础上, 掌握马铃薯叶片抗非生物胁迫相关基因对基因过量表达的响应效应, 为解析基因过量表达对马铃薯生长和基因表达的影响机制, 进一步为阐明提高马铃薯抗旱性的机制奠定基础。
1 材料与方法
1.1 试验材料与处理
以马铃薯品种陇薯3号(L3)及其转基因株系T2为试验材料, 于2017年4月25日将统一繁殖且大小一致的各株系微型薯以同样的深度播种于试验盆(31 cm × 27 cm)中, 每盆1株, 每个株系种24盆, 置抗旱棚中常规管理, 待马铃薯出苗并生长到盛花期(7月14日)时, 选择大小和长势均匀一致的盆栽马铃薯植株12盆, 并分为2组, 每组6盆, 一组正常浇水, 一组进行水分胁迫, 胁迫时保持盆土含水量为田间最大持水量(FWC)的45%~50%, 试验期间采用土壤水分仪和称重法监测土壤水分, 及时补水, 保证土壤含水量处于设定的干旱胁迫范围。胁迫20 d后, 于8月3日早晨10:00–11:00统一选取同一层上部叶片带回实验室, 用于生理指标测定、基因表达情况和转录组分析, 取样时, 各指标均为3次重复。
1.2 生理指标测定
用硫代巴比妥酸法[11]测定丙二醛(MDA)含量, 氮蓝四唑(NBT)光化还原法[11]测定超氧化物歧化酶(SOD)活性, 愈创木酚比色法[11]测定过氧化物酶(POD)活性, 称重法[12]测定叶片相对含水量(RWC)。
1.3 转录组测序
采集2个马铃薯材料上部相同部位叶片在液氮中速冻4 h, 然后保存于-80℃备用。使用Qiagen的RNeasy Plant MiniKit提取总RNA。分别采用Nanodrop、Qubit 2.0和Aglient 2100检测RNA的纯度、浓度和完整性, 检测合格后用于后续试验。用oligdit磁珠富集mRNA, 以此为模板合成cDNA, 纯化后进行PCR扩增, 得到最终的文库。库检合格后, 委托北京百迈客生物信息科技有限公司用HiSeq 2500进行高通量测序。
1.4 差异表达基因的筛选、功能注释和富集分析
为了保证信息分析质量, 必须将含有带接头的、低质量的Raw reads过滤掉, 得到Clean reads, 后续分析都基于Clean reads。采用Bowtie软件将各样品测序得到的Reads与参考序列比对, 根据比对结果, 结合RSEM估计表达量水平。使用FPKM (Fragments Per Kilobase of transcript per Million mapped reads)法计算基因的表达量, 找出不同样本之间差异表达的基因(FDR<0.01且|Fold Change|≥2)。将Unigene在相应的数据库(nr、Swiss-Prot、KEGG和COG)中进行序列比对, 获得该Unigene序列对应的注释信息。利用topGO软件对注释到GO数据库的差异表达基因(differentially expressed genes, DEGs)进行富集分析。
1.5 实时荧光定量PCR
为分析基因表达情况、验证RNA-Seq结果的可靠性, 以qRT-PCR检测基因和6个转录组鉴定出的上、下调表达基因。用RNA simple Total RNA Kit (TIANGEN)试剂盒提取胁迫后转基因植株和非转基因对照上部相同部位叶片总RNA, 采用First strand cDNA Synthesis Kit (THERMO)试剂盒反转录成cDNA。以反转录的cDNA为模板, 用ABIPRISMR 7300实时荧光定量PCR仪(ABI, USA)进行实时荧光定量分析, 试验设3次重复。反应体系为25 μL, 按照SYBR Premix Ex(TaKaRa)反应系统, 以马铃薯基因为内参, 用基因特异引物和DEGs序列引物(表1)进行扩增, 反应条件为95℃预变性3 min; 95℃变性10 s, 56.9℃退火30 s, 40个循环。用Rotor-Gene软件分析CT值, 采用2–ΔΔCT计算差异表达水平。
1.6 数据统计
用Microsoft Excel 2010软件整理数据, 用DPS V3.01软件进行单因素方差(One-way analysis, ANOVA)统计分析, Duncan’s法分析试验结果的差异显著性。所有数据均为“各重复的平均值±标准差”。
2 结果与分析
2.1 干旱胁迫下马铃薯的生长状况
在正常浇水条件下, 转基因植株T2与对照L3均生长状态良好且大致相同, 表明基因的转入并未对马铃薯的生长发育造成不良影响。盛花期开始水分胁迫, 20 d时对照L3植株上部和中心叶片明显萎焉卷曲、基部叶片发黄枯萎(图1-A), 而转基因植株T2除基部极个别叶片黄化外, 基本保持良好的生长状态(图1-B), 表明T2对干旱的耐受性比L3强。

表1 用于qRT-PCR表达验证的基因及其引物

图1 干旱胁迫下转基因及其对照马铃薯表型分析
A: 未转基因植株L3; B: 转基因植株T2。A: no-transgenic plant L3; B: transgenic plant T2.
2.2 干旱胁迫下超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的变化
在正常浇水条件下, 转基因材料T2和对照L3叶片中SOD和POD活性较低, 并且各株系差异不显著。胁迫20 d后, 各株系的SOD和POD活性均增强, 且T2的2种酶活性显著高于对照L3 (<0.05) (图2)。表明在遭受干旱胁迫时,过表达可提高抗氧化酶的活性, 增强植株的抗旱性。
2.3 干旱胁迫下丙二醛含量(MDA)和叶片相对含水量(RWC)的变化
在正常浇水条件下, 转基因材料T2和对照L3叶片中MDA含量较低, 并且各株系差异不显著。胁迫20 d后, 各株系的MDA含量明显上升, 但转基因材料T2的MDA含量显著低于对照L3 (<0.05)(图3-A)。
在正常浇水条件下, 转基因材料T2和对照L3叶片RWC无显著差异, 均在93%以上。水分胁迫20 d后, 各株系的叶片RWC都降低, 但转基因材料T2的降低幅度小于对照L3, 且T2植株的RWC (85.31%)显著高于对照L3 (79.20%)(<0.05)(图3-B)。
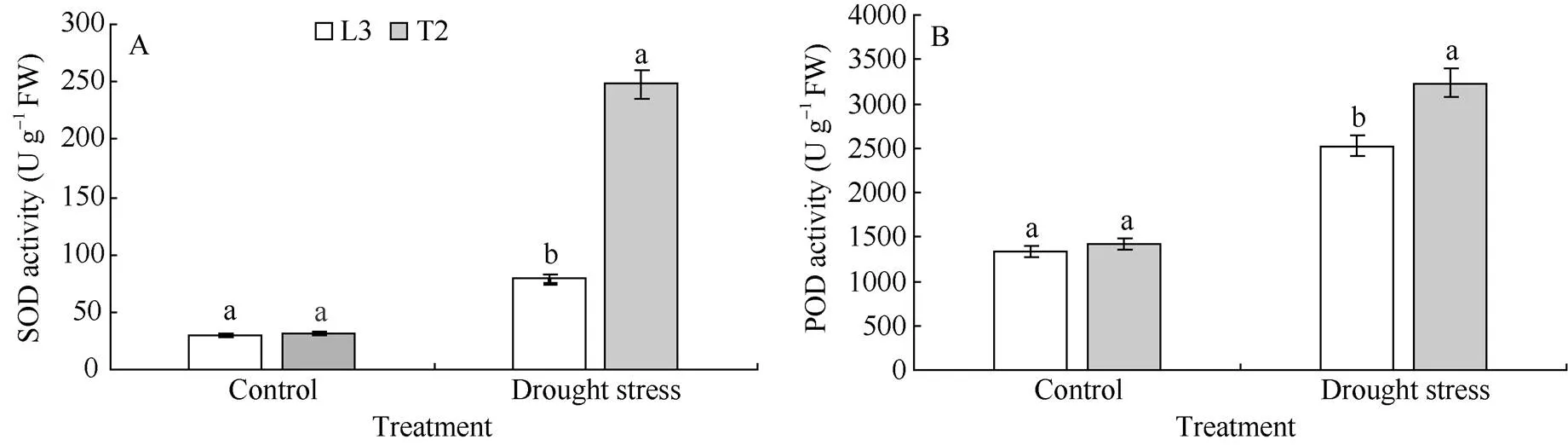
图2 干旱胁迫下马铃薯叶片SOD和POD活性的变化
相同处理标以不同字母的柱值在< 0.05水平上差异显著。
Bars superscripted by different letters are significantly different at< 0.05 within the same treatment.
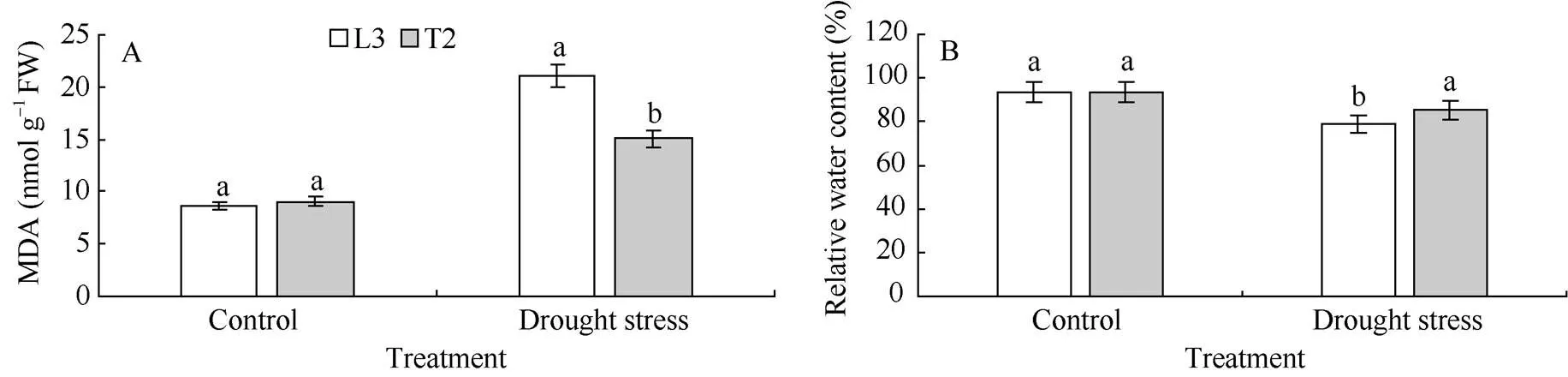
图3 干旱胁迫下马铃薯叶片MDA含量和RWC的变化
相同处理标以不同字母的柱值在< 0.05 水平上差异显著。
Bars superscripted by different letters are significantly different at< 0.05 within the same treatment.
2.4 干旱胁迫下AtDREB1A基因表达分析
qRT-PCR分析结果表明, 在正常浇水条件下, 转基因材料T2和对照L3叶片中基因相对表达量差异不显著, 差异倍数仅为2.34。胁迫20 d后, 转基因材料T2叶片中的相对表达量显著高于对照L3, 差异倍数高达37.56 (<0.05)(图4)。
2.5 干旱胁迫下马铃薯叶片差异表达基因分析
由图5可知,干旱胁迫下, 2个样品的基因表达水平存在一定的差异。转基因材料T2相对于对照L3的差异表达基因为430个,其中上调表达基因287个,下调表达基因143个。功能注释和显著性富集结果表明,这些差异表达基因富集涉及GO功能分类体系中生物过程、细胞组分和分子功能3个大类别, 且大部分差异表达基因集中在细胞内和膜上,主要涉及信号传导、氧化还原、生物调解、应激反应、发育过程、系统免疫过程、核酸和蛋白结合转录因子活性、转运活性及催化活性(图6)。其中非生物胁迫相关基因主要涉及PPR蛋白家族、细胞色素P450蛋白家族、热激蛋白(HSP)家族和MLO蛋白家族。
2.6 干旱胁迫下马铃薯叶片中抗非生物胁迫基因表达情况
2.6.1 差异表达的PPR蛋白家族基因 PPR (Pentatricopeptide repeat)蛋白家族是植物中最大的基因家族之一, 直接或间接参与植物抵抗低温、干旱等逆境胁迫。本研究中, 共有9个PPR蛋白家族基因表达量上调(图 7), 其中基因、和上调倍数较大, 分别为37.39、25.93和14.11倍;、、和上调倍数次之, 分别为9.40、9.14、8.53和6.19倍;和上调倍数最小且差异不大, 分别为4.99和4.47。
2.6.2 差异表达的HSP蛋白家族基因 热激蛋白(heat shock protein, HSP)又称热休克蛋白或应激蛋白, 在生物体的抗逆反应中起着非常重要的作用。本研究中, 共有13个HSP家族基因表达量上调(图8), 其中编码HSP90, 上调6.22倍,编码HSP70, 上调4.10倍; 其余11个均为HSP20蛋白相关基因, 表达量上调倍数的顺序为(17.86) >(14.91) >(10.52) >(9.64) >(9.18) >(7.22) >(6.58) >(6.24) >(6.21) >(5.50) >(4.54)。
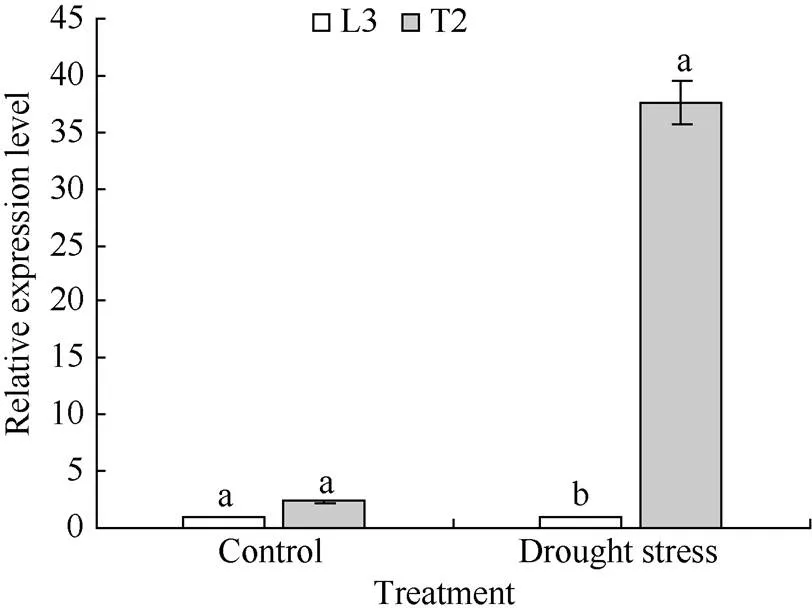
图4 马铃薯叶片中AtDREB1A基因表达的实时荧光定量分析
相同处理标以不同字母的柱值在< 0.05 水平上差异显著。
Bars superscripted by different letters are significantly different at< 0.05 within the same treatment.

图5 干旱胁迫后马铃薯叶片中差异基因表达量火山图
横坐标代表基因在不同样品中表达倍数变化; 纵坐标代表基因表达量变化的统计学显著程度。图中每个基因均由一个点表示, 黑色圆点表示无显著性差异的基因, 左侧绿色圆点表示有显著性差异的下调基因, 右侧红色圆点表示有显著性差异的上调基因。
The abscissa shows the log2(fold change) between the two samples; the ordinate shows the statically significance of the difference. Each gene is represented by one point on the graph. Differential genes with no significant difference were represented by black dots, those left green points and right red points represent significantly different down-regulated and up-regulated genes, respectively.
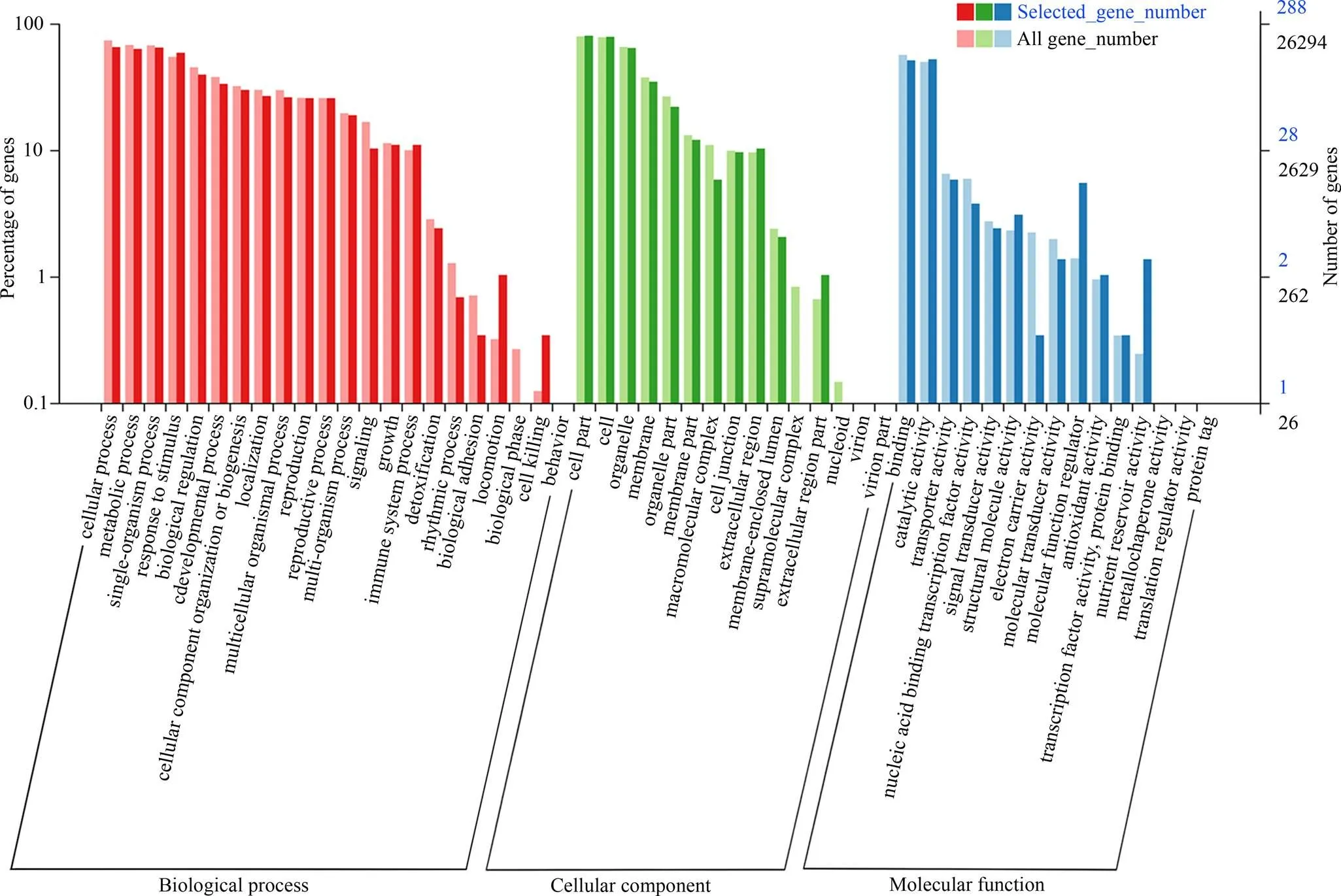
图6 差异表达基因GO注释聚类图
横坐标为GO各分类内容, 纵坐标左边为基因数目所占百分比, 右边为基因数目。
The abscissa is the content of each category of GO. The left side of the ordinate is the percentage of the gene number, and the right side is the gene number.

图7 干旱胁迫下PPR蛋白家族基因表达模式聚类图
图中连线表示各个基因变化趋势的相近程度, 线越短越相近。红色表示上调表达水平, 绿色表示下调表达水平。
The lines in graph show the degree of similarity in the variation trend of each gene, andthe shorter the line is, the more similar the genes are. Red indicates the up-regulated expression level, while green indicates the down-regulated expression level.
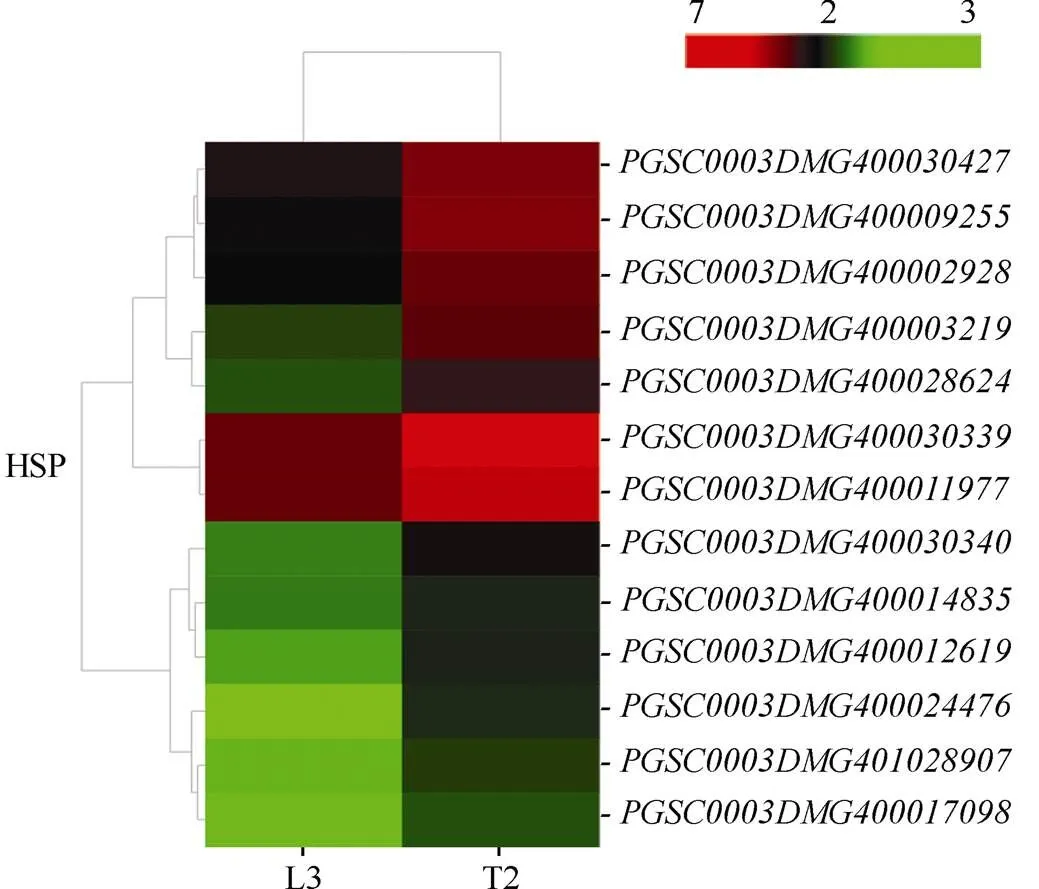
图8 干旱胁迫下HSP蛋白家族基因表达模式聚类图
图中连线表示各个基因变化趋势的相近程度, 线越短越相近。红色表示上调表达水平, 绿色表示下调表达水平。
The lines in graph show the degree of similarity in the variation trend of each gene, andthe shorter the line is, the more similar the genes are. Red indicates the up-regulated expression level, while green indicates the down-regulated expression level.
2.6.3 差异表达的P450蛋白家族基因 细胞色素P450家族蛋白在植物抗病虫防卫反应和抗非生物胁迫中都具有很重要的作用。本研究中, 共有5个编码细胞色素P450家族蛋白基因表达量上调(图9), 其中上调了271.06倍,上调了19.09倍,、和分别上调了9.11、5.41和4.39倍。
2.6.4 差异表达的MLO蛋白家族基因 MLO是高等植物特有的一类抗病家族, 在响应非生物胁迫中发挥重要作用。本研究中, 共有3个MLO蛋白家族基因表达量上调(图10), 其中上调12.43倍、上调9.13倍、上调7.52倍。
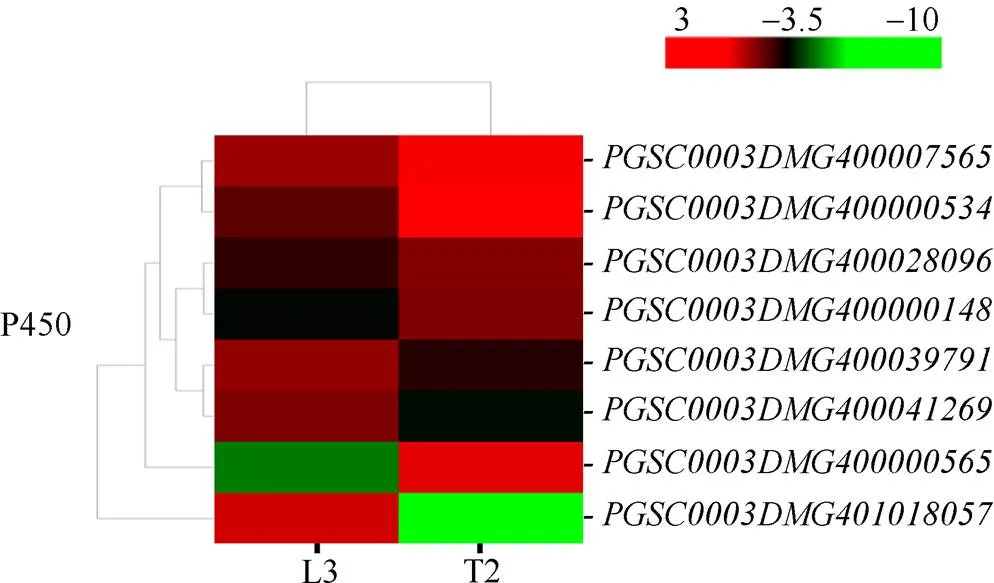
图9 干旱胁迫下P450蛋白家族基因表达模式聚类图
图中连线表示各个基因变化趋势的相近程度, 线越短越相近。红色表示上调表达水平, 绿色表示下调表达水平。
The lines in graph show the degree of similarity in the variation trend of each gene, andthe shorter the line is, the more similar the genes are. Red indicates the up-regulated expression level, while green indicates the down-regulated expression level.
2.7 差异表达基因的qRT-PCR验证
随机选取6个差异表达基因进行qRT-PCR验证。其中和为上调表达基因,和为下调表达基因。以马铃薯为内参基因, 计算6个目的基因的相对表达量, 并与DGE 测序分析的结果比较。DGE测序分析中表达量上调的3个基因, 在胁迫后叶片中相对表达量均较对照上升; 而在DGE测序分析中表达量下调的3个基因, 在胁迫后叶片中相对表达量均低于对照, 即qRT-PCR 中6个基因表达量的变化趋势与测序分析结果相一致(图11), 证明RNA-seq测序结果具可靠性。2种分析方法检测的6个差异基因的表达变化趋势相同, 但表达量存在一定差异, 这可能由2种检测方法的检测范围和灵敏度不同所致。
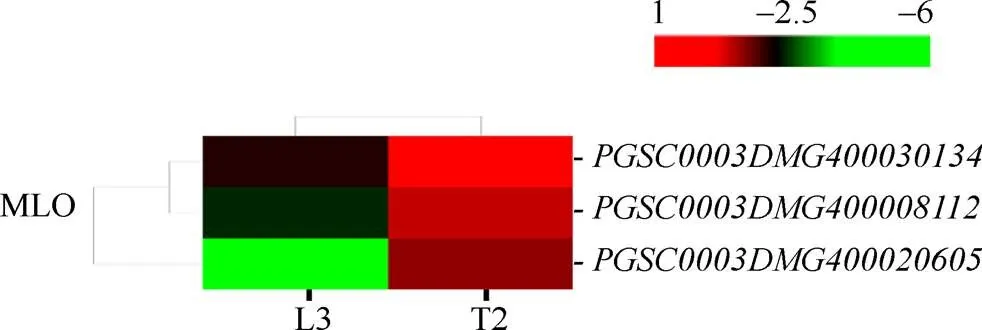
图10 干旱胁迫下MLO蛋白家族基因表达模式聚类图
图中连线表示各个基因变化趋势的相近程度, 线越短越相近。红色表示上调表达水平, 绿色表示下调表达水平。
The lines in graph show the degree of similarity in the variation trend of each gene, andthe shorter the line is, the more similar the genes are. Red indicates the up-regulated expression level, while green indicates the down-regulated expression level.
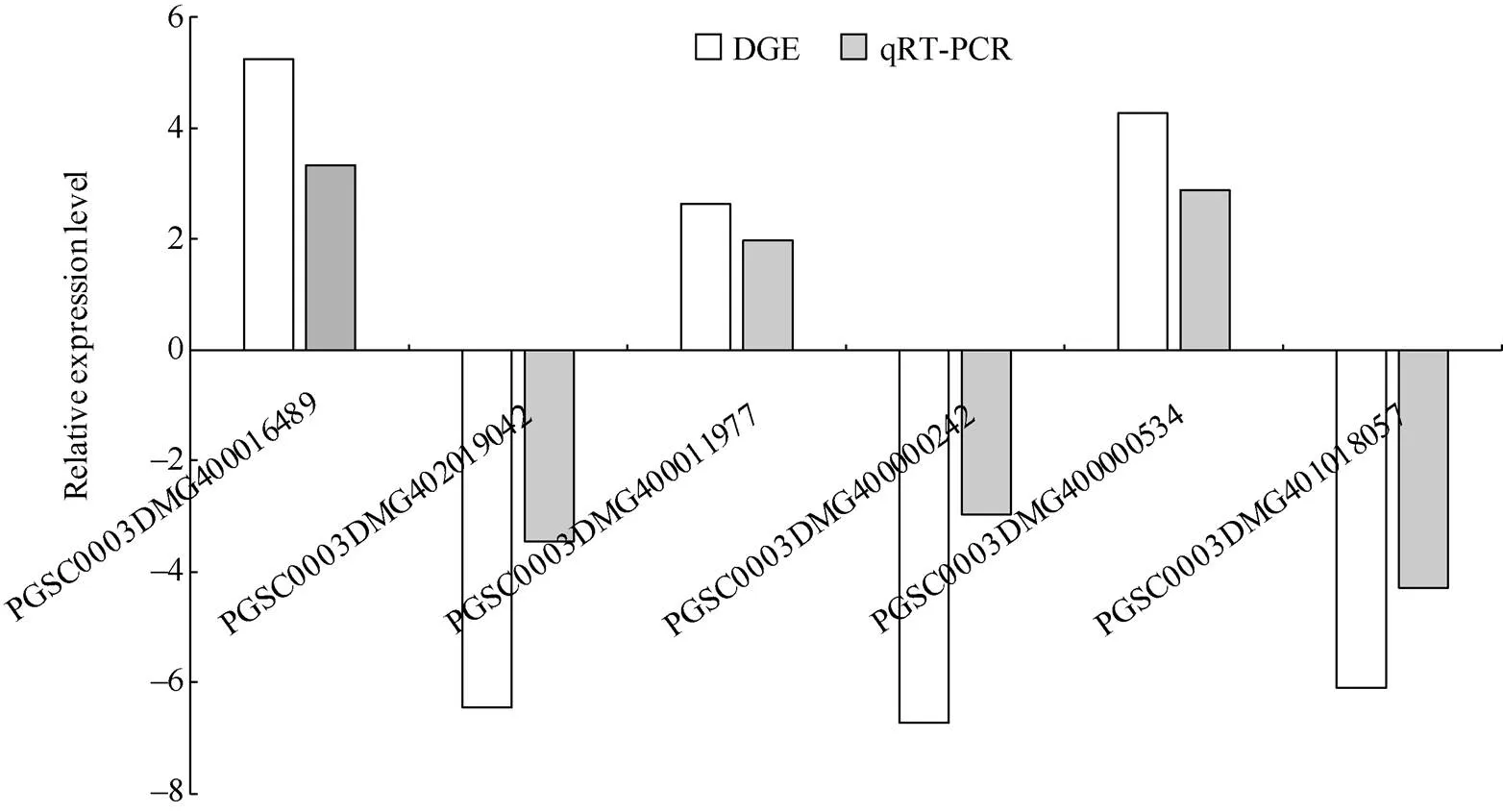
图11 干旱胁迫下L3 vs. T2差异表达基因的qRT-PCR验证
3 讨论
当处于逆境时, 植物不仅会在形态和生理上产生适应性反应, 同样会通过调节基因表达来适应新的不良环境[13]。由逆境胁迫诱导后, 在转基因植物中的过量表达可以激活其他一系列抗逆功能基因同时表达, 从而增强植物对干旱、低温及高盐等逆境的抗性[7-8,14]。本研究对盛花期的马铃薯进行控水处理, 将土壤含水量控制在田间最大持水量的45%~50%, 胁迫处理20 d时, 对照L3植株的叶片萎蔫卷曲及黄化程度比基因过表达植株T2严重的多, 说明基因过表达明显增强了马铃薯对干旱的耐受性。RWC能体现植株叶片水势, 是评价植株抗旱性的重要指标, 受到干旱胁迫后, 跟耐旱性差的植株相比, 耐旱性强的植株能保持较高的RWC[15-16]。本研究中, 在正常浇水条件下, 转基因材料T2和对照L3叶片RWC无显著差异; 水分胁迫20 d后, 各株系的叶片RWC都降低, 但转基因材料T2显著高于对照L3, 说明转基因植株耐旱性较对照强。逆境胁迫会加速植物体内活性氧的积累, 过多的活性氧会对细胞膜脂造成严重的损伤。MDA含量是评价叶片细胞质膜受干旱胁迫损伤程度的重要生理指标[17]。植物细胞内的酶促和非酶促体系形成一系列反应机制来清除活性氧, 从而维持整个细胞防御系统的动态平衡。作为酶促体系的重要成员, SOD和POD常被用来衡量逆境胁迫条件下细胞活性氧清除能力的大小[18]。本研究发现, 在干旱胁迫条件下, 转基因植株的丙二醛含量显著低于对照, 抗氧化保护酶SOD和POD活性均显著高于对照, 表明基因过表达, 提高了抗氧化保护酶SOD和POD活性, 有效地增强了细胞清除活性氧的能力, 进而减轻了活性氧对质膜造成的伤害, 这与过表达植株受干旱影响程度较轻相一致。
通过转录组测序及生物信息学方法分析转基因马铃薯与未转基因对照在转录水平上基因表达的差异, 发现转基因材料T2相对于L3的差异表达基因有430个, 其中上调表达基因287个, 下调表达基因143个。上调表达基因中与抗非生物胁迫相关的基因主要包括PPR蛋白家族、HSP蛋白家族、P450蛋白家族和MLO蛋白家族基因。PPR蛋白家族不仅在RNA的编辑加工、细胞器形成、细胞核与细胞器之间信号传递、恢复细胞质雄性不育和调节植物生长发育方面发挥重要作用, 而且直接或间接参与植物抗逆境胁迫, 在马铃薯抗旱[19]、水稻抗低温[20]、水稻和毒麦抗盐[21-22]、拟南芥抗氧化[23-24]中均发挥着重要作用。HSP是干旱胁迫物质形成的必需要素, 通过提高自身的表达量增强植物对胁迫的适应能力, 维持胁迫调节下蛋白的稳定性和维持植物的生存与正常生长[25-26]。细胞色素P450家族蛋白在植物抗病虫防卫反应和抗非生物胁迫中都具有非常重要的作用。崔会婷等[27]研究发现, 模拟干旱胁迫条件下, 苜蓿基因表达量明显上调, 转基因拟南芥比野生型表现出较好的耐旱性, 表明基因与干旱胁迫的调节机制有很大的相关性。MLO是高等植物特有的一类抗病家族, 在响应非生物胁迫中也发挥着重要作用, 很多基因的表达会受到各种生物和非生物胁迫的影响[28-29]。辣椒基因的表达受到脱落酸和干旱的诱导, 说明基因与干旱胁迫有关[30]。本研究中, 相对于未转基因对照L3, 转基因材料T2中抗非生物胁迫相关蛋白PPR、HSP、P450和MLO等家族基因表达量上调幅度较大, 上调倍数最低的都不低于4, 大部分都上调十几倍甚至几十倍, 说明这些基因在转基因马铃薯抵御干旱过程中发挥着非常重要的作用。本研究为进一步解析基因提高马铃薯抗旱性的调控网络奠定了基础。
4 结论
在增强细胞清除活性氧能力、减轻活性氧对质膜伤害程度的同时,基因过量表达引起430个基因表达变化, 其中上调表达基因287个, 下调表达基因143个, 主要涉及信号传导、氧化还原、生物调解、应激反应、发育过程、系统免疫过程、核酸和蛋白结合转录因子活性、转运活性及催化活性, 其中抗非生物胁迫相关蛋白PPR、HSP、P450和MLO等家族的大量基因表达量发生较大的变化, 说明这些基因在转基因马铃薯抵御干旱过程中发挥着非常重要的作用。
[1] Seki M, Narusaka M, Abe H, Kasuga M, Shinozaki K, Carninci P, Hayashizaki Y, Shinozaki K. Monitoring the expression pattern of 1300genes under drought and cold stresses by using a full-length cDNA micro array., 2001, 13: 61–72.
[2] Fowler S, Thomashow M F.transcription profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway., 2002, 14: 1675–1690.
[3] 王萍, 高世庆, 郭永来, 程宪国, 王罡, 马有志, 季静. 利用农杆菌介导将抗逆相关基因导入大豆的研究. 大豆科学, 2008, 27: 47–51. Wang P, Gao S Q, Guo Y L, Cheng X G, Wang Z, Ma Y Z, Ji J. Transformation of stress resistance related geneinto soybean via Agrobacterium-mediation., 2008, 27: 47–51 (in Chinese with English abstract).
[4] Courtois B, McLaren G, Sinha P K,Prasad K, Yadav R, Shen L. Mapping QTLs associated with drought avoidance in upland rice., 2000, 6: 55–66.
[5] 刘录祥, 赵林姝, 梁欣欣, 郑企成, 刘强, 王晶, 郭会君, 赵世荣, 陈文华. 基因枪法获得逆境诱导转录因子转基因小麦的研究. 中国生物工程杂志, 2003, 23(11): 53–56. Liu L X, Zhao L S, Liang X X, Zheng Q C, Liu Q, Wang J, Guo H J, Zhao S R, Chen W H. Study on production of transgenic wheat with a stress-inducible transcription factor geneby microprojectile bombardment.,2003, 23(11): 53–56 (in Chinese with English abstract).
[6] Pellegrineschi A, Reynolds M, Pacheco M, Brito R M, Almeraya R, Yamaguchi-Shinozaki K, Hoisington D. Stress-induced expression in wheat of thegene delays water stress symptoms under greenhouse conditions., 2004, 47: 493–500.
[7] 许昆朋. 转基因马铃薯提高抗冷性的研究. 山东农业大学硕士毕业论文,山东泰安, 2011. Xu K P. Studies on the Mechanisms of Enhanced Chilling Tolerance in Potato Transformed withGene. MS Thesis of Shandong Agricultural University, Tai’an, Shandong, China, 2011 (in Chinese with English abstract).
[8] Dou H O, Xu K P, Meng Q W, Li G, Yang X H.Potato plants ectopically expressingexhibit enhanced tolerance to high-temperature stress., 2014, 38: 61–72.
[9] 贾小霞, 齐恩芳,王一航,文国宏,龚成文,王红梅,李建武,马胜,胡新元. 转录因子基因和基因双价植物表达载体的构建及对马铃薯遗传转化的研究. 草业学报, 2014, 23(3): 110–114. Jia X X, Qi E F, Wang Y H, Wen G H, Gong C W, Wang H M, Li J W, Ma S, Hu X Y. Construction of a bivalent plant expression vector ofand Bar genes and studies of genetic transformation of potato., 2014, 23(3): 110–114 (in Chinese with English abstract).
[10] 贾小霞, 齐恩芳, 马胜, 胡新元,王一航,文国宏,龚成文,李建武. 转双价基因马铃薯的耐旱性及除草剂抗性分析. 草业学报, 2015, 24(11): 58–64. Jia X X, Qi E F, Ma S, Hu X Y, Wang Y H, Wen G H, Gong C W, Li J W. Analysis of drought tolerance and herbicide resistance in transgenic potato plants over-expressing., 2015, 24(11): 58–64 (in Chinese with English abstract).
[11] 张治安, 张美善, 蔚荣海. 植物生理学实验指导. 北京: 中国农业科学技术出版社, 2004. pp 265–296. Zhang Z A, Zhang M S, Wei R H. Plant Physiology Experiment Guide. Beijing: China Agricultural Science and Technology Press, 2004. pp 265–296 (in Chinese).
[12] 康雯. 土壤自然失水胁迫对地锦幼苗生理生化特性的影响. 东北林业大学硕士学位论文,黑龙江哈尔滨,2010. Kang W. Effect of Soil Natural Water Stress on Physiological and Biochemical Indexes inSeedling. MS Thesis of Northeast Forestry University, Harbin, Heilongjiang, China, 2010 (in Chinese with English abstract).
[13] 许冰霞, 尹美强, 温银元, 裴帅帅, 柯贞进, 张彬, 原向阳. 谷子萌发期响应干旱胁迫的基因表达谱分析. 中国农业科学, 2018, 51: 1431–1447. Xu B X, Yin M Q, Wen Y Y, Pei S S, Ke Z J, Zhang B, Yuan X Y. Gene expression profiling of foxtail millet (L.) under drought stress during germination., 2018, 51: 1431–1447 (in Chinese with English abstract).
[14] 李健.与转录因子在马铃薯应答低温、干旱及盐胁迫过程中存在功能差异. 山东农业大学硕士学位论文, 山东泰安, 2018. Li J.andhave Different Function in Response to Freezing, Drought and Salt Stress in Potato. MS Thesis of Shandong Agricultural University, Tai’an, Shandong, China, 2018 (in Chinese with English abstract).
[15] 杜建雄, 侯向阳, 刘金荣. 草地早熟禾对干旱及旱后复水的生理响应研究. 草业学报, 2010, 19(2): 31–38. Du J X, Hou X Y, Liu J R. A study on physiological response to drought and re-watering treatments in Kentucky bluegrass., 2010, 19(2): 31–38 (in Chinese with English abstract).
[16] 刘明稀, 卢少云, 郭振飞. 假俭草抗旱变异体的筛选及其生理鉴定. 草业学报, 2012, 21(1): 126–132. Liu M X, Lu S Y, Guo Z F. Selection and physiological identification of somaclonal variants for increased drought resistance of centipedegrass.,2012, 21(1): 126–132 (in Chinese with English abstract).
[17] 李源, 刘贵波, 高洪文, 孙桂枝, 赵海明, 谢楠. 紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应. 草业学报, 2010, 19(4): 79–86. Li Y, Liu G B, Gao H W, Sui G Z, Zhao H M, Xie N. A comprehensive evaluation of salt-tolerance and the physiological response ofat the seedling stage., 2010, 19(4): 79–86 (in Chinese with English abstract).
[18] 张海娜, 李小娟, 李存东, 肖恺. 过量表达小麦超氧化物歧化酶(SOD)基因对烟草耐盐能力的影响. 作物学报, 2008, 34: 1403–1408. Zhang H N, Li X J, Li C D, Xiao K. Effects of overexpression of wheat superoxide dismutase (SOD) genes on salt tolerant capability in tobacco., 2008, 34: 1403–1408 (in Chinese with English abstract).
[19] 范敏, 金黎平, 刘庆昌, 屈冬玉. 马铃薯PPR蛋白家族基因的克隆及其在干旱条件下的表达特征分析. 中国农业科学, 2008, 41: 2249–2257. Fan M, Jin L P, Liu Q C, Qu D Y. Cloning ofgene of pentatricopeptide repeat (PPR) protein family in potato and analysis of expression characteristics under drought conditions., 2008, 41: 2249–2257 (in Chinese with English abstract).
[20] Yan S P, Zhang Q Y, Tang Z C, Su W A, Sun W N. Comparative proteomic analysis provides new insights into chilling stress responses in rice., 2006, 5: 484–496.
[21] Baldwin J C, Dombrowski J E. Evaluation ofas a model grass species for the study of salinity stress by PCR-based subtractive suppression hybridization analysis., 2006, 171: 459–469.
[22] Ma S, Gong Q, Bohnert H J. Dissecting salt stress pathways., 2006, 57: 1097–1107.
[23] Baxter C J, Redestig H, Schauer N, Repsilber D, Patil K R, Nielsen J, Selbig J, Liu J, Fernie A R, Sweetlove L J. The metabolic response of heterotrophiccells to oxidative stress., 2007, 143: 312–325.
[24] Umbach A L, Fiorani F, Siedow J N. Characterization of transformedwith altered alternative oxidase levels and analysis of effects on reactive oxygen species in tissue., 2005, 139: 1806–1820.
[25] Hajheidari M, Abdollahian-Noghabi M, Askari H, Heidari M, Sadeghian S Y, Ober E S, Salekdeh G H. Proteome analysis of sugar beet leaves under drought stress., 2005, 5: 950–960.
[26] Wang W, Vinocur B, Shoseyov O, Altman A. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response., 2004, 9: 244–252.
[27] 崔会婷, 王珍, 张铁军, 蒋旭, 龙瑞才, 杨青川, 康俊梅. 蒺藜苜蓿基因的克隆及功能分析. 中国草地学报, 2018, 40(5): 1–10. Cui H T, Wang Z, Zhang T J, Jiang X, Long R C, Yang Q C, Kang J M. Clong and functional analysis of genefrom., 2018, 40(5): 1–10 (in Chinese with English abstract).
[28] Van Nguyen N T, Vo K T X, Park H, Jeon J S, Jung K H. A systematic view of the MLO family in rice suggests their novel roles in morphological development, diurnal responses, the light- signaling pathway, and various stress responses., 2016, 7: 1413, doi: 10.3389/fpls.2016.01413.
[29] Wang X, Ma Q, Dou K. Genome-wide characterization and comparative analysis of thegene family in cotton., 2016, 103: 106–119.
[30] Lim C W, Lee S C. Functional roles of the pepper MLO protein gene,, in abscisic acid signaling and drought sensitivity., 2013, 85: 1–10.
Effects of over-expression ofgene on potato growth and abiotic stress resistance gene expression
JIA Xiao-Xia1,2, QI En-Fang1,2, LIU Shi1,2, WEN Guo-Hong1,2,*, MA Sheng1,2,LI Jian-Wu1,2, and HUANG Wei1,2
1Potato Research Institute, Gansu Academy of Agricultural Sciences / Gansu Engineering Laboratory of Potato Germplasm Resources Innovation, Lanzhou 730070, Gansu, China;2The Ministry of Agriculture, Scientific Observation and Experiment Station of Dry Potato in the Northwest, Weiyuan 748201, Gansu, China
Longshu 3 (L3) and itstransgenic line T2 were planted in the pot experiment. The water content of the soil in pots was controlled to 45%–50% of the maximum water holding capacity (FWC) during the flowering stage of the potato. The phenotype, MDA content, RWC, activities of SOD and POD, and the gene expression level in leaves were analyzed, showing there were no significant differences between the two lines under normal watering conditions. After 20 d of stress treatment, the phenotype of transgenic plants T2 was significantly better than that of control L3, and RWC was significantly higher than that of L3. The MDA content, SOD and POD activities of leaves in each line increased significantly, while the MDA content of transgenic plants increased less than, and the activities of SOD and POD of transgenic plants increased more than those of the control, indicating that the cell membrane damage and membrane lipid peroxidation of the transgenic plants were lighter than those of the control, and the drought tolerance of transgenic plants was significantly improved. Transcriptome sequencing and bioinformatic analysis showed that compared with L3, there were 430 differentially expressed genes in T2, including 287 up-regulated genes and 143 down-regulated genes. Functional annotation and significance enrichment showed that all differentially expressed genes were involved in three broad categories of GO functional classification systems, that was biological processes, cell components and molecular functions. Most of these differentially expressed genes concentrated on the membrane in cells, and mainly related to signal transduction, redox, biological mediation, stress response, development process, system immune process, nucleic acid and protein binding transcription factor activity, transport activity and catalytic activity. The expression of a large number of abiotic stress-related genes was up-regulated, including PPR protein family, P450 protein family, heat shock protein family and MLO protein family, indicating that these genes play a very important role in drought-stress resistance oftransgenic potato. This study lays a foundation for further understanding’s regulatory network to improve potato drought resistance.
potato;gene; abiotic stress; differentially expressed genes; drought
2018-12-11;
2019-04-15;
2019-05-13.
10.3724/SP.J.1006.2019.84166
文国宏, E-mail: 251580436@qq.com
E-mail: jiaxx0601@163.com
本研究由国家自然科学基金项目(31560412, 31060200), 甘肃省农业科学院科技创新专项(2017GAAS38)和国家现代农业产业技术体系建设专项(CARS-09-P06)资助。
This study was supported by the National Natural Science Foundation of China (31560412, 31060200), the Science and Technology Support Program of Gansu Academy of Agricultural Sciences (2017GAAS38), and China Agriculture Research System (CARS-09-P06).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190510.1754.003.html

