乌克兰鳞鲤精子超低温冷冻保存方法研究
马 林,李 楠,郝 爽,吴会民,姜巨峰,刘克明,白晓慧,刘肖莲,李春艳,尤宏争
( 天津市水产研究所,天津 300221 )
鱼类精子超低温冷冻保存在遗传育种、种质资源保护以及水产养殖中均有重大意义。此项技术的应用可以为鱼类种质资源的长期保存提供低温生物学手段;可以有效地解决鱼类雌雄发育不同步或地理间隔的问题;还可以为鱼类遗传学研究不间断地提供配子材料[1]。多年来,国内外诸多学者在鱼类精子超低温冷冻保存方面做了大量研究,并取得较大进展[2-4]。然而,由于不同鱼类精子的生物学特征不同,导致冷冻保存的主要实施方法也不尽相同[5]。
乌克兰鳞鲤(Cyprinuscarpio),俗称俄罗斯鲤,属鲤形目、鲤科、鲤亚科、鲤属的一个经综合选育的养殖品种,于1998年由全国水产技术推广总站自俄罗斯引进[6]。该品种较普通鲤鱼具有生长快、个体大、抗病力强、耐低氧、易驯化、易起捕、耐盐碱性强、营养价值高等优点[7-8],成为天津市重要的淡水养殖品种之一。目前,对其研究主要集中在养殖技术[9]和规模化养殖[10]方面,关于其精子超低温冷冻保存尚未见报道。基于此,本试验采用“三步冷冻法”,对乌克兰鳞鲤精子进行超低温冷冻保存试验,旨在探索出适用于其精子简便有效的超低温冷冻保存方法,以期为该种优良种质资源的保护以及开展其他鱼类精子超低温冷冻保存提供科学参考。
1 材料与方法
1.1 乌克兰鳞鲤精液的采集
试验鱼为天津市凯润水产养殖有限公司饲养的2龄乌克兰鳞鲤。于2018年5月选取3尾性腺发育成熟的雄鱼进行精液采集。采集过程中,先将亲鱼捞出,用吸水纸将鱼体表面,特别是泄殖孔附近的水分吸干,轻轻挤压腹部,采集精液于干燥的小玻璃瓶中,采集过程中应注意采集未经尿液、粪便污染的精液。采集后,将存储容器置于冰袋上并避免光线直射,使用养殖用水进行稀释并激活,显微镜镜检,活力高于90%进行后续试验。
1.2 冷冻主要仪器
冷冻装置包括2个简易泡沫船(每个厚度4 cm)和泡沫盒,0.25 mL蓝色和白色冷冻麦细管(法国卡苏),冻存管(拇指管),铝制支撑条(Nalyene)、液氮温度监测探头(JRI SPYRF)和液氮罐(YDS)。将拇指管与铝制支撑条用透明扎带固定,标号后放入液氮壶中并放入液氮罐中,方便后续使用。解冻使用控温水浴锅(DZKW-4)。
1.3 试验方法
1.3.1 精子活力评价
由精子被激活后运动速度快、路线无规则,到精子运动明显减慢、运动轨迹清晰可辨的过程,称为激烈运动;精子由激活到视野中90%的精子停止运动或原地震颤的过程,称为精子寿命[11]。精子活力用激活率进行评价,即视野内活动精子占精子总数的百分比。具体操作方法:在干净的细胞计数板滴加一滴养殖用水,用一次性注射器针尖沾取少量精液与水滴混匀,迅速在显微镜下观察精子运动情况。为减小误差,活力检测由一人完成,由第二个人进行结果校正。
1.3.2 稀释液和稀释比例的筛选
试验中选取3种稀释液,为Hank′s稀释液(8.01 g/L NaCl,0.4g/L KCl,0.14 g/L CaCl2·2H2O,0.35 g/L NaHCO3,0.06 g/L KH2PO4,0.1 g/L MgCl·6H2O,0.1 g/L MgSO4·7H2O,0.06 g/L Na2HPO4·2H2O,10 g/L 葡萄糖,pH=6.8)[12]、Cortland稀释液(7.25 g/L NaCl,0.38 g/L KCl,0.18 g/L CaCl2·2H2O,1 g/L NaHCO3,0.23 g/L MgSO4·7H2O,0.41 g/L NaH2PO4·H2O,1 g/L 葡萄糖,pH=7)[12]和法国卡苏公司FreezeFish冻精稀释液(商品稀释液)。使用2 mL离心管将精液与稀释液分别以1∶1、1∶3和1∶5 (体积比)的比例混合,至4 ℃冰箱内保存1 h后,显微镜检查精子活力,每种比例3个样品,每个样品重复3次,筛选出适宜的稀释液和稀释比例。
1.3.3 抗冻剂的筛选
试验中选取3种抗冻剂,分别为二甲基亚砜、1,2-丙二醇和丙三醇(甘油)。使用20 mL小玻璃瓶,将筛选出用于后续试验的Hank′s和FreezeFish稀释液分别与3种抗冻剂按比例(抗冻剂体积分数为10%)混合配置冷冻保护液6种(Hank′s+二甲基亚砜,Hank′s+丙二醇,Hank′s+丙三醇, FreezeFish+二甲基亚砜,FreezeFish+丙二醇,FreezeFish+丙三醇),玻璃瓶盖上塑料盖后至4 ℃冰箱内预冷。试验时,使用2 mL离心管,移液枪吸取精液以1∶3和1∶5的比例分别与Hank′s保护液和FreezeFish保护液混合,至4 ℃冰箱保存,逐日镜检并记录精子活力,每组3个样品,每样重复3次,筛选适合的保护液配方。
1.3.4 降温方法与速率的筛选
使用液氮监测探头监测并记录液氮在液氮罐及倒出后的真实温度。筛选平衡时间的具体操作为:泡沫盒内倒入2 L液氮,将监测探头平行置于泡沫船最上方,分别监测泡沫船距液氮液面4、8 cm时液氮蒸气的温度变化情况,每分钟记录实时温度,筛选适宜的降温速率。运用“3步冷冻法”,按照过程冻精,经24 h冷冻保存,解冻后显微镜检查精子活力,每种降温方法5个样品,每样品重复3次,筛选最适降温速率(表1)。

表1 降温步骤
1.3.5 冷冻保存
在冰袋上方放置塑料离心管架,按照筛选出的冷冻方案配置精液与保护剂混合液盛放于2 mL离心管。迅速使用冷冻麦细管吸取混合液,按照上述3种降温方法,降温后放入之前准备好的拇指管中(已装有液氮),最后放入液氮罐(装有液氮)中,冷冻保存24 h。
1.3.6 解冻温度的筛选
选取3种水浴解冻温度,分别为20、30 ℃和40 ℃。在20 ℃时解冻15 s,30 ℃解冻10 s,40 ℃解冻5 s,水浴后将样品置于室温下至解冻完全。将冷冻保存24 h后的样品完全解冻后,剪去冷冻麦细管封口端,使精液混合液自然流入离心管中,迅速镜检,记录精子活力(%)和精子寿命(s)。
1.3.7 数据分析
试验数据均采用SPSS 13.0 软件进行数据处理,对测定结果进行单因素方差分析,差异显著(P<0.05)时,进行Duncan多范围检验。
2 结 果
2.1 不同稀释液和稀释比例对精子活力的影响
试验中使用Hank′s、Cortland和卡苏FreezeFish冻精稀释液分别以3种比例对乌克兰鳞鲤精子进行低温保存,经方差分析检验,9种方案的每个试验组之间差异显著,并对以上数据进行Duncan多范围检验。试验结果表明,以Cortland为稀释液的保存效果最差(P<0.05)。在Hank′s和FreezeFish稀释液的比较中,除Hank′s稀释液1∶1组与FreezeFish稀释液各比例组差异显著(P<0.05)外,其余各组之间均无显著差异(P>0.05)。Hank′s稀释液1∶3组[精子活力(81.5±9.14)%]和FreezeFish稀释液1∶5组[精子活力(76.5±6.69)%]保存效果较好,用于后续试验(图1)。
2.2 抗冻剂对精子活力的影响
乌克兰鳞鲤精液在不同种类保护液保存的结果反映出抗冻剂对精子活力的影响。由表2可见,鲤精液在Hank′s稀释液与二甲基亚砜组成的保护液(精∶液=1∶3)中保存效果最好,低温保存2 h后,精子活力较其他组高,达到(79.3±1.2)%,显著高于其他各组(P<0.05)。保存3 d后,精子活力依然可达35%以上,除略高于使用FreezeFish稀释液与丙二醇组成的保护液(精∶液=1∶5),显著高于其他各组(P<0.05)。选择此方案用于后续冷冻试验。
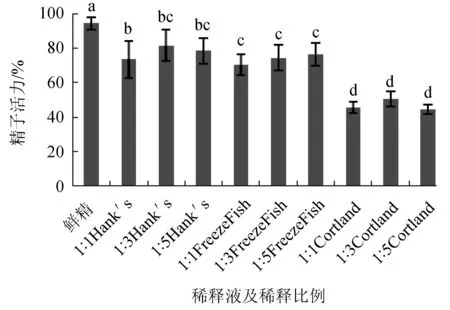
图1 稀释液及稀释比例对精子活力的影响不同小写字母表示组间差异显著(P<0.05),下同.
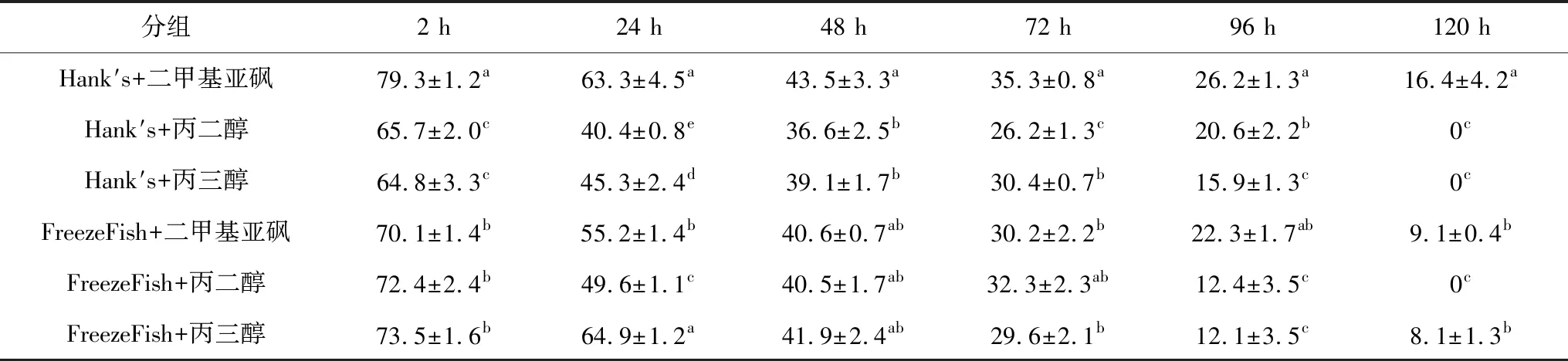
表2 冷冻保护液对精子低温保存活力的影响
注:同列中标有不同小写字母者表示组间差异显著(P<0.05).
2.3 降温方法的筛选
使用液氮监测探头分别监测距液氮液面4 cm和8 cm处液氮蒸汽每分钟的实时温度,构成降温趋势图。由图2可见,温度均先后经历快速下降、平稳下降和平衡3个阶段。在距液面8 cm处,温度在2 min内快速下降到约-15 ℃,随后缓慢下降并最终平衡于约-20 ℃。在距液面4 cm处,温度可在2 min内快速下降至-58.8 ℃,随后缓慢下降,在15 min后可平稳在约-90 ℃。
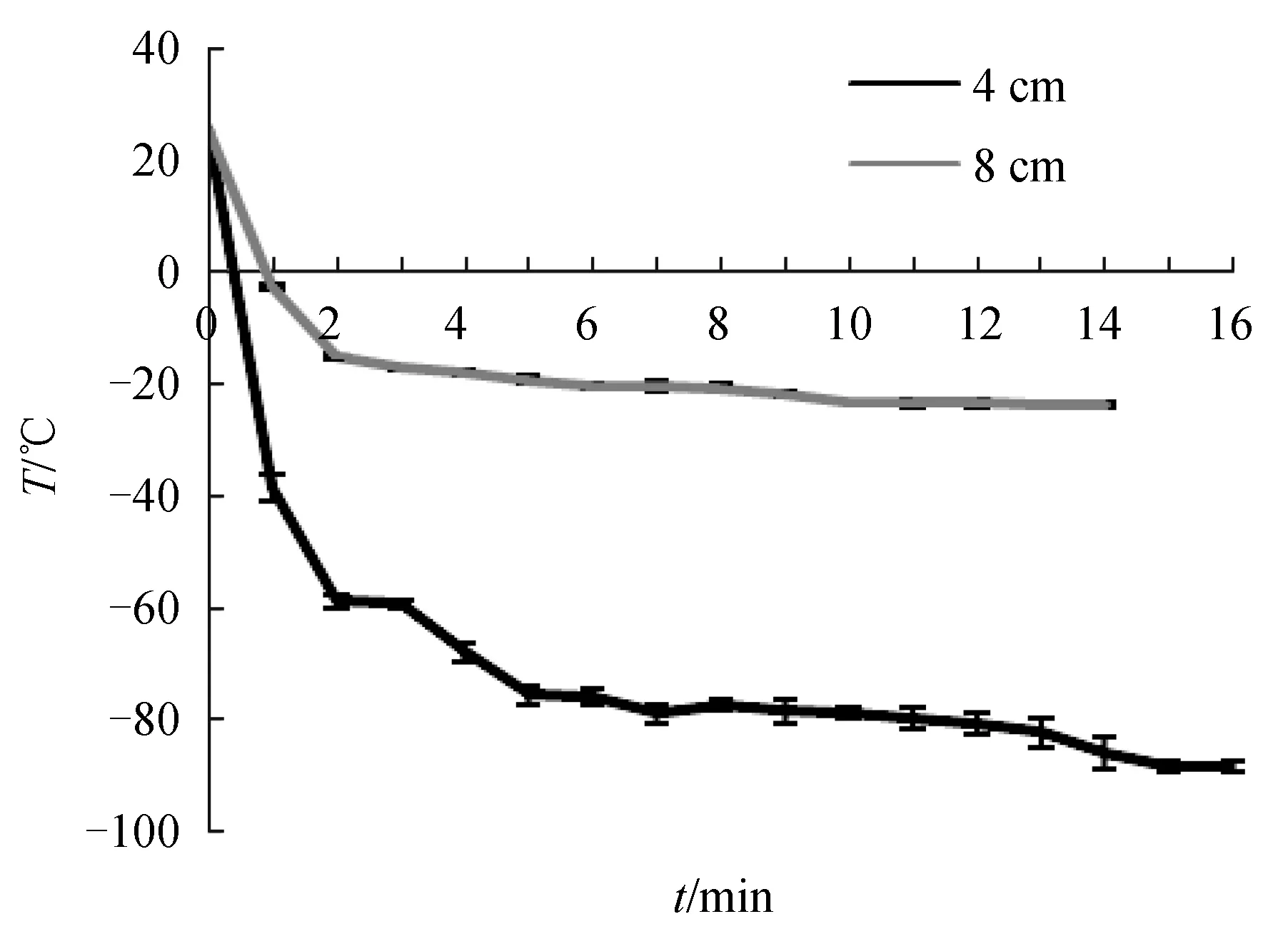
图2 液氮蒸气降温趋势
按照设计的3种“3步冷冻法”,依照2.2中所筛选的冷冻保护液方案,对乌克兰鳞鲤精子进行超低温冷冻保存24 h(图3)。解冻后,3种方法冷冻后的精子活力差异显著(P<0.05)。方法2冷冻精子解冻后精子活力最低,为(25.0±4.6)%,显著低于方法3冷冻精子解冻后活力[(68.5±5.4)%]。
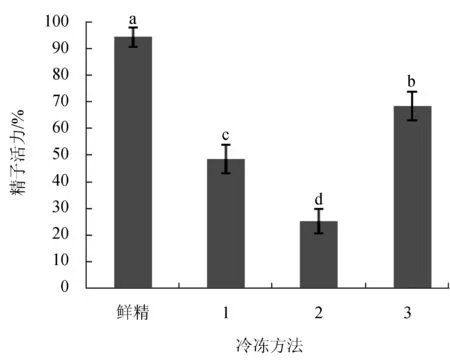
图3 3种冷冻方法对精子活力的影响
2.4 解冻温度对精子活力的影响
经24 h冷冻保存后,使用恒温水浴锅分别设置解冻温度为20、30 ℃和40 ℃,对冻精进行解冻。结果显示,20 ℃解冻后精子活力显著低于其他两组(P<0.05),30 ℃和40 ℃解冻精子活力无显著的差异(P>0.05),但显著低于对照组(新鲜精子)精子活力(P<0.05)。使用30 ℃解冻后精子活力[(68.2±5.4)%]最高,因此选择30 ℃作为最适解冻温度。
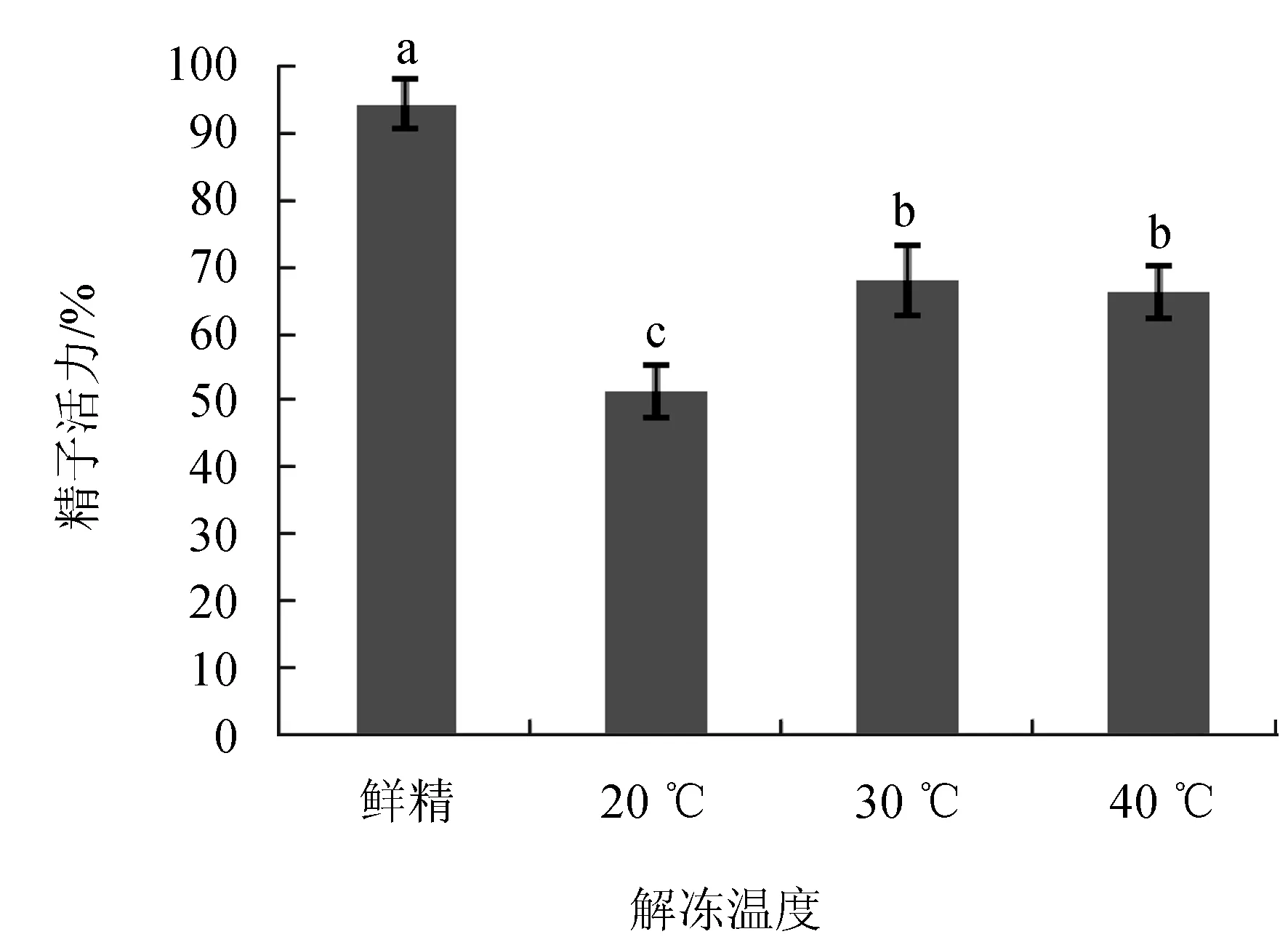
图4 不同解冻温度对精子活力的影响
3 讨 论
3.1 稀释液
鱼类精液在排出体外之后,由于环境的变化、营养物质的消耗和代谢产物的累积等因素,导致精子的活性和存活时间会快速降低直至死亡[12]。添加适宜的稀释液可以延长精子在体外的存活时间,维持其良好的生理状态,以更好地抵抗降温过程中自由基的不利影响、脂质过氧化和细胞膜完整性的破坏[2,13]。鱼类精液冷冻保存稀释液的组成和配比至今没有一个统一的配方或标准[14]。在稀释液的选择上,一般遵循以下原则:(1)稀释液应与精液等渗或稍高渗以抑制精子运动;(2)有一定的缓冲能力;(3)含有一定的营养物质以提供精子微弱代谢的需要;(4)其成分在合适的范围内越简单越好[1,15-16]。在本试验中,筛选使用标准Hank′s稀释液,当精液与Hank′s稀释液体积比为1∶3时,乌克兰鳞鲤精子低温和超低温保存效果最好,活力分别为(81.5±9.14)%和(68.2±5.4)%。陈雄芳[17]在大黄鱼(Pseudosciaenacrocea)精液冷冻保存研究中使用Hank′s获得了(89.7±7.5)%的冻精成活率;王小刚等[12]证明,点带石斑鱼(Epinepheluscoioides)精子冷冻保存的最适稀释液为Hank′s,冻精成活率高于60%。以上研究与本试验结果一致。Cortland稀释液的使用虽然在本试验中效果不佳,但在黑鲷(Sparusmacrocephalus)[18]、花鲈(Lateolabraxmaculatus)[19]、真鲷(Pagrosomusmajor)[20]等精子超低温冷冻保存中都获得了很好的保存效果。FreezeFish稀释液为一款进口鱼类通用稀释液,其成分未知且未见其他报道,在乌克兰鳞鲤精液与FreezeFish之比为1∶5时,精子活力同样处于较高水平,但低于使用Hank′s稀释液时的精子活力。对此款稀释液的有效使用有待在开展其他鱼类精子冷冻或深入探讨最适稀释比例中进一步研究。
3.2 抗冻剂
冷冻处理会导致精子膜破损,使精子蛋白质和线粒体上谷草转氨酶大量逸失进入精浆中,导致精子死亡[1]。抗冻剂的添加能够在精子的冷冻过程中保护精子,使精子细胞降低冰晶损伤,调节精子渗透压,但同时其具有毒性[21]。常用的抗冻剂有二甲基亚砜、1,2-丙二醇、已二醇、丙三醇(甘油)、乙酰胺等,这些渗透性抗冻剂是一类含有羟基的小分子化合物,当与精子混合后能快速通过细胞膜进入到细胞内替代部分游离水,降低细胞内溶质的含量;同时在冷冻时,可以降低溶液的冰点,从而减缓细胞的褶皱程度和脱水速度,减少危险温度的范围[4,15-16,22]。本试验中筛选使用二甲基亚砜、1,2-丙二醇和丙三醇作为抗冻剂,选取体积分数为10%。试验中,将精液与以Hank′s和10%二甲基亚砜配置的冷冻保护液以1∶3比例冻存后的精子活力最高,达到(68.2±5.4)%。这也证明了二甲基亚砜是较好的淡水鱼精子抗冻剂,而且10%的二甲基亚砜是一个高度有效的体积分数,既能起到良好的抗冻作用,又不会导致精子中毒[15,23-24]。
3.3 冷冻速度
冷冻速度对于维持精子生理状态非常重要,冷冻速度过快,细胞内水分不能及时渗出,会导致细胞内冰晶的形成,极易刺破细胞膜和细胞器;而冷冻速度过慢会导致精子长时间处于高渗环境中,易产生渗透休克[3]。本试验中使用液氮监测探头分别测试距液氮液面4 cm和8 cm处液氮蒸汽每分钟的实时温度。在使用方法3时,冻后精子活力最高,方法1的冷冻效果不佳。这可能是由于生物细胞一般比较容易冻结,特别是0~-60 ℃是细胞冷冻损伤的主要温度区间[16,21,25]。使用方法2冷冻精子活力最差,这可能是由于降温速率过快,且抗冻剂含量过低。低含量的抗冻剂无法使细胞脱水并取代细胞内的水,冰晶的形成对细胞造成了不可逆损伤[21-22]。
3.4 解冻温度
解冻是使冰态的精子升温复苏的过程。在解冻时,细胞外冰会先融化,此时细胞外浓度比细胞内低,水分会快速进入到细胞内,使得细胞肿胀,当肿胀程度超过细胞自身承受能力时,会造成细胞肿胀性破裂[26]。此外,在解冻过程中容易造成再结晶,使得细胞膜和细胞器受到损伤[2,13,27-28]。理论上快速解冻有利于精子迅速通过冰晶形成区,降低冰晶损伤。通常的解冻复苏方法是30~40 ℃水浴解冻或者室温流水解冻等[29]。在本研究中,使用30 ℃和40 ℃解冻约10 s后精子活力差异不显著,且30 ℃的精子活力稍高。但林丹军等[30]研究表明,对大黄鱼冻精使用38~40 ℃的水浴解冻,精子活力低于室温(21~23.5 ℃)自然解冻;而Irawan等[5]在解冻鲤鱼冻精时,使用70 ℃解冻5 s后的精子活力最高可达(94.5±3.3)%。
3.5 精子损伤
精子质膜及膜性细胞器对外界环境变化十分敏感,在外部环境突变时极易受到损伤[31]。本研究中,经过冷冻保存后精子活力较鲜精活力下降近30%,说明精子在冷冻过程中发生了一定程度的损伤,其生理功能受到影响。使用电镜观察鲤鱼冻精形态结构,发现其形态结构损伤主要表现为精子头部胀大,表面凹凸不平,或头部膨大呈泡状,严重者头部外膜破裂导致内含物外溢,精子尾部外膜破裂,或尾部断裂缺损等[32]。除细胞膜性结构损伤外,精子核DNA损伤也会造成精子生理功能及受精能力的丧失[33]。金春华等[33]使用单细胞凝胶电泳法对黄姑鱼(Nibeaalbiflora)精子DNA进行损伤检测,根据彗星拖尾中DNA占细胞总DNA的比例,将冻精核DNA损伤程度分为5级,并分析出随着精子核DNA损伤的加重,精子核逐渐缩小直至模糊或消失,彗尾逐渐出现至彗尾明显延长。
4 结 论
本研究通过筛选不同的稀释液与稀释比例、抗冻剂种类、降温速度与解冻温度,确立了适用于乌克兰鳞鲤精子的超低温冷冻方法,此方法操作简单、成本低廉,在其种质保护方面具有重要意义。在后续的研究中,可进一步对稀释液的种类及配方、冷冻速率以及冷冻损伤方面进行深入研究,以进一步提高冷冻精子成活率。

