籽用和肉用印度南瓜果实发育过程中淀粉合成途径相关基因的表达分析
王超杰 王云莉 徐文龙 韩宏宇 王志超 崔崇士 屈淑平
(东北农业大学园艺园林学院,黑龙江哈尔滨 150030)
在高等植物中淀粉主要由两种不同的葡聚糖聚合物组成:直链淀粉和支链淀粉。支链淀粉是天然淀粉的主要成分,是以α-1,6-糖苷键和α-1,4-糖苷键共同形成长度不一的分支并以一定的次序相结合的簇状结构(Gentry et al.,2016);直链淀粉是次要成分,是由α-1,4-糖苷键连接而成的线性多聚物,通常占总储备淀粉的15%~35%(Vu et al.,2014)。植物种类和贮藏器官不同,其直链淀粉和支链淀粉的含量和比例也有所不同。贮藏器官淀粉的合成(图1)主要发生在质体中,由一系列关键的酶催化合成(Ball & Morell,2003;Stitt et al.,2010;Zeeman et al.,2010;Toyosawa et al.,2016;Wyatt et al.,2016)。淀粉合成的第一步是葡萄糖-6-磷酸(glucose-6-phosphate,G6P)由葡萄糖磷酸转运蛋白(GPT)将其由细胞质转移至质体中。G6P 在质体葡萄糖磷酸变位酶(pPGM)的催化作用下生成葡萄糖-1-磷酸(glucose-1-phosphate,G1P)。G1P 和ATP 在ADP-葡萄糖磷酸焦磷酸化酶(ADP-Glc pyrophosphorylase,AGPaseL)的催化下生成ADPG,ADPG 是直链淀粉和支链淀粉合成的共同前体,为淀粉链的延伸提供糖基,此过程中,质体内的ATP 主要是从胞质中由质体型ATP/ADP 转 运 蛋 白(plastidic ATP/ADP transporter,AATP)运输而来。颗粒结合型淀粉合成酶(granule-bound starch synthase,GBSS)主要负责直链淀粉糖链的延伸。可溶性淀粉合成酶(soluble starchsynthase Ⅰ,Ⅱ,Ⅲ,Ⅳ,SSSⅠ~Ⅳ)主要负责支链淀粉糖链的延伸,支链淀粉中α-1,6-糖苷键的引入主要是由淀粉分支酶(starch-braching enzyme,SBE)完成,而淀粉去分支酶(debranching enzyme,DBE)的主要作用是水解不正确的α-1,6-糖苷键分支,对支链进行修饰。

图1 植物淀粉的生物合成途径(Wyatt et al.,2016)
淀粉是南瓜果肉的重要成分,淀粉含量的高低与南瓜果实的食用口感相关,南瓜收获时,干物质与淀粉含量越高,果肉口感越面(Hurst et al.,1995)。Nakkanong 等(2012)研究了中国南瓜(Cucurbita moschata)、印度南瓜(Cucurbita maxima)和种间杂种(Maxchatal)果实发育过程的6 个时期淀粉代谢相关基因的表达量及淀粉组成,结果显示AGPaseL 与GBSSⅠ基因的转录水平与淀粉含量变化趋势一致,SSSⅡ、ISAⅠ和SBEⅡ基因与支链淀粉合成相关。Wyatt 等(2016)对美洲南 瓜(Cucurbita pepo)Sweet REBA 和Lady Godiva 进行转录组测序,确定了在美洲南瓜果实发育过程中的蔗糖和淀粉代谢相关的酶基因,并对其表达量进行研究。王安君(2017)对不同发育时期的中国南瓜(Cucurbita moschata)CMO-X 和CMO-E 以及印度南瓜(Cucurbita maxima)CMA的果实进行高通量测序,探究果实糖类和淀粉合成调控网络,筛选出蔗糖和淀粉代谢途径差异表达的基因共12 个,结合qRT-PCR 验证中国南瓜CMO-X 和CMO-E 中差异基因表达量与相关代谢物含量的关系,确定GBSS、SSS 和SBE 为淀粉合成途径关键基因。
虽然直链和支链淀粉在南瓜果实发育过程中的积累与其代谢关键酶基因表达量之间的关系有多篇报道,但对于印度南瓜果实发育过程中直链淀粉和支链淀粉的积累与关键酶基因表达量的关系报道较少。肉用印度南瓜果实口感紧实、甜面,深受消费者青睐,籽用印度南瓜果实口感疏松,果肉基本全部废弃。因此,本试验以肉用印度南瓜和籽用印度南瓜高代自交系材料为研究背景,探究籽用和肉用印度南瓜品种果肉中直链和支链淀粉的积累模式及合成途径中关键酶基因表达量的差异,以期为南瓜品质育种提供科学依据。
1 材料与方法
1.1 试验材料
籽用印度南瓜自交系98-2,果实口感疏松;肉用印度南瓜自交系312-1,果实口感粉面;均由东北农业大学园艺园林学院南瓜分子遗传育种研究室提供。2017 年5 月中旬,在黑龙江省哈尔滨市东北农业大学向阳基地种植,每份材料种植30 株,株距50 cm,行距140 cm,3 次重复,均采用常规栽培管理方式及水肥供给。人工辅助授粉,并挂标记牌,每个单株只留1 个瓜。在不同的果实发育阶段(授粉后5、10、20、30、40、50 d)进行取样,每个时期2 份材料分别选取3 个长势一致且无机械损伤的果实,离体后立即纵切,取南瓜果肉部分用锡箔纸包裹后迅速在液氮中冷冻,储存于-80 ℃冰箱中。
1.2 干物质含量的测定
取上述冷冻南瓜果肉部分测定每份材料的干物质含量,即将果肉在65 ℃条件下烘干至恒重,测定其干质量。
1.3 南瓜淀粉的提取
将冷冻南瓜果肉取出后,于-50 ℃冷冻干燥48 h,磨粉,将干粉过100 目筛。按 Stevenson 等(2005)的碱提取方法提取南瓜淀粉,取过筛后干粉加10 mL 0.05% NaOH 放置20 h;用蒸馏水反复清洗3 次,5 000 r · min-1离心10 min 后加入19 mL 0.1 mol · L-1NaCl 和0.1 mL 10%甲苯涡旋混匀,离心弃上清液;再用蒸馏水清洗3 次,乙醇洗2 次,用冷冻干燥机干燥样品,即得到粗提的南瓜 淀粉。
1.4 总淀粉、直链淀粉、支链淀粉含量的测定
取上述粗提的南瓜淀粉磨粉后的南瓜干粉15 mg,用5 mL 80% Ca(NO3)2悬浮,在沸水中水浴10 min,于4 000 r · min-1条件下离心4 min 后将上清液转入20 mL 容量瓶中,残渣用80% Ca(NO3)2重复提取 2 次,合并提取液,定容至20 mL。每个处理3 次重复,参照徐昌杰等(1998)的测定方法测定总淀粉含量。
称取粗提的南瓜淀粉15 mg,加入1.0 mL 1 mol · L-1NaOH 溶液,30 ℃恒温箱内糊化20 h。加入2~3 mL 水,于沸水中分散8 min。取3 mL 分散液,加入1 mL 脱脂液,静置10 min,弃去上层,重复脱脂 3 次。吸取脱脂液0.5 mL,加入5 mL 水、0.1 mol · L-1乙酸溶液1 mL、0.02%碘试剂1.5 mL定容。显色10 min 后于620 nm 波长处测定吸光度值。参照杨金华等(1992)的方法绘制混合标准曲线,计算直链淀粉和支链淀粉含量。
1.5 RNA 的提取及cDNA 的合成
采用 Trizol(Invitrogen USA)法提取不同果实发育阶段南瓜果肉RNA。RNA 的质量和浓度通过超微量紫外分光光度计(SMA 4000 Merinton USA)进行检测。同时用1%的琼脂糖凝胶电泳检测RNA 的完整性。cDNA 合成使用 Rever Tra Ace q-PCR RT Master Mix with gDNA Remover(Code No. FSQ-301,TOYOBO,JAPAN) 试 剂 盒。0.5 μg RNA 加2 μL 4 × DN Master Mix(已添加 gDNA Remover),加入RNase-free ddH2O 至 8 μL,混匀后于37 ℃水浴5 min。cDNA 合成用上面提到的8 μL 反应液加2 μL 的5× RT Master MixⅡ至 10 μL混匀,37 ℃水浴15 min;98 ℃水浴5 min,于-80 ℃条件保存。
1.6 淀粉合成途径关键酶基因表达分析
选择10 个参与淀粉合成途径的相关酶基因进行表达分析,部分引物参照Nakkanong 等(2012)文献中的引物序列,引物信息见表1。以Actin 为内参基因。应用天根生化科技(北京)有限公司RealMaster Mix SYBR Green(Code No.FP202) 试剂盒进行qRT-PCR。qRT-PCR 反应体系包括1 μL稀释的cDNA,上下游引物各1 μL,9 μL 的2.5×Real Master Mix(with 20×SYBR Solution)反应液,加8 μL RNase-free ddH2O 到20 μL。所有反应液均在冰上配制,之后彻底混匀。qRT-PCR 扩增程序为:95 ℃预变性10 min;40 个循环,每个循环包括95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸30 s。所有cDNA 均进行3 次重复。
2 结果与分析
2.1 南瓜果实发育过程中干物质和淀粉积累的变化
南瓜果实发育过程中干物质含量测定结果表明(表2),在授粉后5 d,2 份材料中干物质含量差异不大,随着果实的发育,肉用南瓜312-1 中干物质呈现快速积累,在授粉后40 d 达到峰值,在果实成熟后期(授粉后50 d)略有下降,而籽用南瓜98-2 的干物质含量一直变化不大,维持在发育初期的水平,没有显著积累的过程,在授粉后50 d达到峰值。授粉后10~50 d,2 份材料之间的干物质含量差异均达显著或极显著水平。
如表3 和图2 所示,在果实发育过程中,2 份材料312-1 和98-2 的总淀粉和支链淀粉积累模式存在明显差异,312-1 中总淀粉和支链淀粉积累模式相似,都是随着果实发育逐渐积累,在授粉后40 d 时达到高峰,随后略有下降;而98-2 中总淀粉和支链淀粉含量一直维持在果实发育初期(授粉后5 d)水平,没有显著积累的过程;在果实发育的各个时期,312-1 中总淀粉和支链淀粉含量均极显著高于98-2。在授粉后40 d 时312-1 果实中总淀粉和支链淀粉含量分别为53.84%和41.85%,而98-2 果实中总淀粉和支链淀粉含量分别为8.29%和5.70%。

表1 实时荧光定量PCR 引物

表2 南瓜果实发育过程中干物质含量的变化
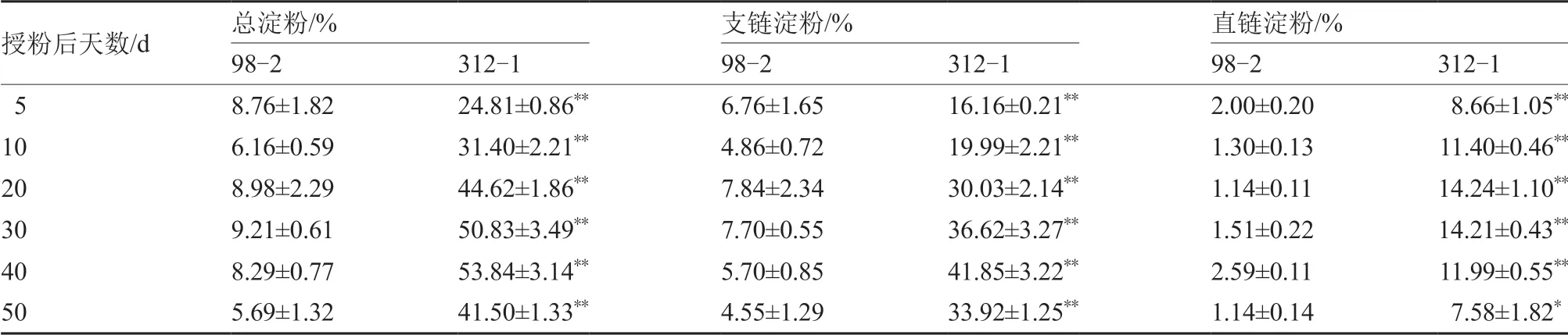
表3 南瓜果实发育过程中淀粉含量的变化

图2 98-2(A)和312-1(B)在果实发育6 个时期的淀粉积累量
2 份材料中直链淀粉的积累模式大致相同,都是维持在果实发育初期的水平,没有显著积累过程,在发育过程中略有上下波动。果实发育的不同时期312-1 中直链淀粉含量均显著或极显著高于98-2,在授粉后40 d 时312-1 果实中直链淀粉含量为11.99%,而98-2 果实中直链淀粉含量为2.59%,两者相差4.6 倍。
在淀粉组成上,2 份材料均是以支链淀粉为主。在整个果实发育期间,312-1 中支链淀粉含量平均为总淀粉含量的71.27%,98-2 中支链淀粉含量平均为总淀粉含量的79.00%,2 份材料在淀粉组成上差异不大。
2.2 南瓜果实发育过程中淀粉合成途径关键酶基因表达量的变化
淀粉合成途径中10 个关键酶基因在2 份南瓜材料果实发育不同时期的相对表达量变化如图3 所示。除ISA Ⅲ、SSSⅡ和SBEⅡ基因外,其他7 个基因的表达模式相似,均是在2 份材料果实发育前期(授粉后5 d)高度表达,在果实发育中后期表达量均维持在相对较低的水平,其中GPT、AGPaseL、GBSSⅠ 和SSS Ⅲ这4 个基因在2 份材料不同果实发育期均存在显著或极显著差异。
GPT 和GBSSⅠ基因在312-1 果实发育前2个时期的表达量均极显著高于98-2,但授粉20 d 之后GPT 和GBSSⅠ基因的表达量均显著或极显著低于98-2。312-1 果实发育过程中AATP、AGPaseL、SBEⅠ(除授粉后30 d)、SSSⅡ(除授粉后10 d)和SSS Ⅲ基因的表达量均高于98-2。PGM 基因除授粉后5 d 和30 d,其他各个时期均是312-1 中的表达量低于98-2。ISA Ⅲ基因在2 份材料中的表达量大体呈现“V”字形变化趋势,该基因在授粉后5、30 d 和50 d 时312-1 中的表达量显著高于98-2,其余各时期2 份材料间差异不显著。SBEⅡ基因在312-1 授粉后5 d 和10 d 的表达量显著低于98-2,后期则相反。

图3 南瓜果实发育过程中10 个淀粉合成途径关键酶基因的相对表达量
3 结论与讨论
南瓜干物质和淀粉含量与南瓜口感品质关系密切(Ferriol & Picó,2008;孙守如 等,2008;徐丽珊 等,2009;尹玲 等,2012)。本试验中,肉用印度南瓜312-1 中干物质和总淀粉含量均大于同期籽用印度南瓜98-2,98-2 口感疏松,312-1 口感紧实、面而粉,结合2 份南瓜果实中的淀粉和干物质含量,推断南瓜质地紧实、粉质与南瓜中淀粉和干物质含量有关。
在2 份印度南瓜材料果实发育过程中,肉用印度南瓜312-1 果实中的直链和支链淀粉的积累均显著或极显著高于籽用印度南瓜98-2。除ISA Ⅲ、SSSⅡ 和SBEⅡ 基 因 外,GPT、AATP、PGM、AGPaseL、GBSSⅠ、SSS Ⅲ和SBEⅠ基 因 在2 份材料果实发育过程中表达模式相似,各基因表达量在2 份材料中存在较大差异。GPT、AATP 和AGPaseL 主要参与淀粉合成前体物质(ADPG)的合成。前人从基因表达和转录组学研究中已证明GPT、AATP 和AGPaseL 基因在南瓜淀粉合成中的重要作用。Wyatt 等(2016)发现在美洲南瓜Sweet REBA 果实发育过程中GPT 和AATP 的转录水平高于Lady Godiva,且Sweet REBA 果实中的淀粉含量高于Lady Godiva。Nakkanong 等(2012)研究发现在印度南瓜和Maxchata 中AGPaseL 基因的转录水平与淀粉含量变化趋势一致,AGPaseL 基因在印度南瓜和Maxchata 中高度表达导致其积累较多的淀粉。本试验中,GPT、AATP 和AGPaseL基因均在2 份材料果实发育前期(授粉后5 d 和授粉后10 d)高表达,且在312-1 中的表达量显著或极显著高于98-2,推测GPT、AATP 和AGPaseL在印度南瓜果实淀粉合成过程中起着关键作用。GBSS 是直链淀粉生物合成的关键酶,GBSSⅠ基因的表达与许多植物的贮藏器官中直链淀粉含量具有明显的相关性,例如马铃薯(Kozlov et al.,2007)、木薯(Raemakers et al.,2005)和甘薯(Otani et al.,2007)。在本试验中,2 份材料在果实发育早期直链淀粉便高度积累,GBSSⅠ基因在果实发育早期(授粉后5~10 d)的表达量较高,且在312-1果实中的表达量极显著高于98-2,推测GBSSⅠ基因是调控印度南瓜果实中直链淀粉积累的关键酶基因。SSS、SBE 和DBE 共同参与支链淀粉的生物合成(高振宇 等,2004;Tetlow et al.,2008;郑义 等,2009),本试验中SSSⅡ、SSSⅢ、SBEⅠ和SBEⅡ基因在312-1 果实发育多个时期的表达量显著高于98-2,312-1 支链淀粉的含量也极显著高于98-2,推测SSSⅡ、SSSⅢ、SBEⅠ和SBEⅡ基因是调控印度南瓜果实中支链淀粉积累的关键酶基因。在水稻中有研究表明ISA Ⅲ基因参与淀粉的降解(Yun et al.,2011),本试验中2 份材料在授粉后50 d SSSⅡ和ISAⅢ基因高度表达,授粉后50 d 果实中支链淀粉含量也下降,SSSⅡ和ISA Ⅲ基因是否参与淀粉的降解还有待进一步研究。

