四川泡菜产生物胺细菌的筛选及产胺能力验证
唐垚,唐小曼,明建英,汪冬冬,张其圣,3*
(1.四川东坡中国泡菜产业技术研究院,四川 眉山 620000;2.四川理工学院,四川 自贡 643000;3.四川省食品发酵工业研究设计院,成都 611130)
四川泡菜是我国传统发酵食品的典型代表,因清香、嫩脆而深受人们喜爱,常作为烹饪食材和佐餐菜品[1]。四川泡菜按照加工方式可分为工业化和家庭式两类,其都依靠蔬菜表面附带的微生物自然发酵而成,在贮藏阶段可能积累生物胺。

1 材料与方法
1.1 材料与仪器
1.1.1 实验样品
四川工业泡菜:取自四川省眉山市某知名泡菜企业,共两份;四川家庭泡菜:取自四川省眉山市不同家庭,共两份。
1.1.2 实验试剂
组胺、腐胺、酪胺、尸胺等生物胺标准品:购于美国Sigma-Aldrich公司;乙腈、甲醇等色谱纯溶剂:购于天津市致远化学试剂有限公司;细菌DNA提取试剂盒:购于成都福际生物技术有限公司;2×Taq PCR Master Mix及相关引物:购于生工生物工程(上海)股份有限公司;其他试剂:均为国产分析纯。
1.1.3 产生物胺细菌筛选培养基(BAF)的配制
胰蛋白胨5 g,酵母提取物5 g,氯化钠5 g,葡萄糖1 g,吐温80 0.5 mL,MgSO4·7H2O 0.2 g,CaCO30.1 g,MnSO4·4H2O 0.05 g,FeSO4·7H2O 0.04 g,溴甲酚紫0.06 g,组氨酸、酪氨酸、鸟氨酸、赖氨酸各1 g,蒸馏水1000 mL,混匀后调节pH至 5.2,配制固体培养基再添加20 g琼脂,121 ℃高压灭菌15 min。
1.1.4 仪器与设备
MJ-54A立式高压灭菌锅 上海施都凯仪器设备有限公司;L6S紫外可见分光光度计、PHS-3C 酸度计 上海仪电科学仪器股份有限公司;LC-2030高效液相色谱仪 日本岛津公司;T960 PCR仪 杭州晶格科学仪器有限公司;JY04S-3E凝胶成像分析系统 北京君意电泳设备有限公司。
1.2 理化及微生物指标测定方法
1.2.1 pH的测定
参考GB 10648—1989《水果和蔬菜产品pH值的测定方法》。
1.2.2 总酸的测定
参考GB/T 12456—2008《食品中总酸的测定》,采用电位法测定。
1.2.3 盐度的测定
参考GB/T 12457—2008《食品中氯化钠的测定》。
1.2.4 菌落总数的测定
参考GB/T 4789.2—2016《食品微生物学检验 菌落总数测定》。
1.2.5 乳酸菌的测定
参考GB/T 4789.35—2016《食品微生物学检验 乳酸菌检验》。
1.2.6 酵母的测定
参考GB/T 4789.15—2016《食品微生物学检验 霉菌和酵母计数》。
1.3 生物胺含量检测
根据Frias等研究报道的方法测定样品常见的8种生物胺[7]。
1.4 生物胺形成菌的筛选及鉴定
将20 g样品加到180 mL无菌生理盐水中,匀浆后进行梯度稀释,取适当稀释度的菌悬液涂布于BAF固体培养基中,37 ℃培养48 h。挑选BAF培养基上有明显紫圈的菌落,划线法分离纯化各菌株。细菌DNA的提取参照试剂盒说明书方法进行,PCR扩增体系及程序参照Haruta等的方法进行[8],扩增产物送至上海生工生物技术有限公司进行测序,利用Blast软件将菌株16S rDNA序列与RDP数据库中核酸数据进行比对,用MEGA 5.0软件中的Neighbor-Joining法进行1000次步长计算,构建系统发育树。
1.5 氨基酸脱羧酶基因测定
组氨酸脱羧酶hdc基因的引物及扩增程序参考孟甜等的方法进行[9],酪氨酸脱羧酶tdca基因的引物及扩增程序参考Fernández等的方法进行[10],鸟氨酸脱羧酶odc基因的引物及扩增程序参考Coton等的方法进行[11],赖氨酸脱羧酶cacd基因的引物及扩增程序参考De Filippis等[12]的方法进行。
1.6 筛选菌产胺能力的验证
参考马秀玲等[13]的方法构建OD值对应菌落数的标准曲线。将筛选菌保持整个体系105CFU/mL的量接种于BAF液体培养基中,每个筛选菌3个平行,以不接菌的BAF液体培养基作为空白,37 ℃培养48 h,测其生物胺的含量。
2 结果与分析
2.1 理化及微生物指标测定结果
对四川泡菜的理化及微生物指标进行测定,结果见表1。

表1 四川泡菜的理化及微生物指标测定结果Table 1 Physicochemical and microbial indicators of Sichuan pickles
注:表中数据为平均值±标准偏差。
由表1可知,四川工业泡菜的盐度较高,菌落总数及乳酸菌总数较低,而家庭泡菜的pH较低,酸度较高,这可能是由于家庭泡菜盐度低,乳酸菌生长不受抑制,大量产酸并不断积累导致。
2.2 生物胺含量测定结果
四川泡菜常见8种生物胺的测定结果见图1。
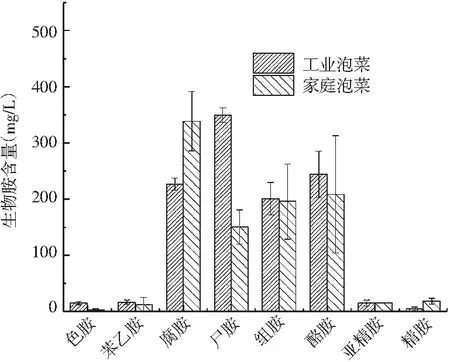
图1 四川泡菜常见8种生物胺的测定结果Fig.1 Determination results of 8 kinds of biogenic amines in Sichuan pickles
由图1可知,四川泡菜生物胺总含量约为697.29~1164.48 mg/kg,其中腐胺、尸胺、组胺、酪胺含量均超过100 mg/kg,为四川泡菜的主要生物胺。在四川工业泡菜中,尸胺含量最高,为(349.43±13.23) mg/kg,其次为酪胺,含量为(244.29±41.03) mg/kg。在家庭泡菜中,腐胺含量最高,为(338.2±53.07) mg/kg,其次为酪胺和组胺。本次实验选取的四川泡菜样品,组胺和酪胺的含量均已超过欧洲食品安全局对食品中生物胺含量建议的100 mg/kg。研究报道,酪胺和尸胺摄入量过高,会抑制人体肠道中组胺-N-甲基转移酶以及胺氧化酶的活性,导致组胺对机体产生毒害作用,且酪胺和尸胺能与亚硝酸盐形成具有致癌性的亚硝胺[14]。Sandler等研究指出摄入3 mg的苯乙胺就能造成偏头痛[15],当生物胺摄入量达到1000 mg/kg时会对人体造成严重危害。因此,四川泡菜的生物胺含量可能存在一定安全隐患。
2.3 产生物胺细菌的筛选及鉴定
四川泡菜中的生物胺除原料本身含有外,主要依靠微生物利用氨基酸脱羧形成。本研究在基础培养基中添加主要生物胺的前体氨基酸,添加溴甲酚紫作为指示剂,当微生物将氨基酸脱羧形成显碱性的生物胺时,菌落会在培养基上显示紫色。依据该显色原理,筛选产生物胺的细菌,分子鉴定结果见图2。
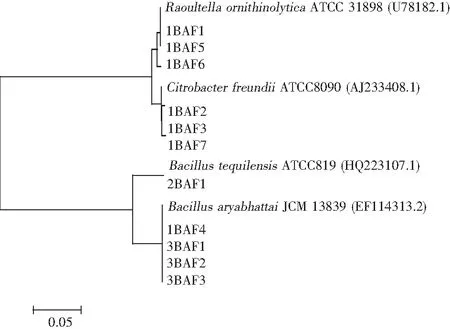
图2 生物胺形成菌的系统发育树Fig.2 Phylogenetic tree of biogenic amino-producing bacteria
从四川泡菜中分离纯化共得到11株产生物胺的细菌,其中工业泡菜样本中共筛选出8株,家庭泡菜中共筛选出3株。对筛选菌的16S rDNA序列进行测定,获得的序列在RDP数据库中比对,11株产生物胺细菌分别为解鸟氨酸拉乌尔菌(Raoultellaornithinolytica)、弗氏柠檬酸杆菌(Citrobacterfreundii)、特基拉芽孢杆菌(Bacillustequilensis)、阿耶波多氏芽孢杆菌(Bacillusaryabhattai)。Cosansu等研究了发酵食品中与生物胺形成相关的微生物包括芽孢杆菌属、柠檬酸杆菌属、梭菌属、克雷伯菌属、埃希氏菌属、假单胞菌属、沙门氏菌属等[16]。Hsien等研究了台湾市售泡菜中与组胺形成相关的微生物包括头状葡萄球菌(Staphylococcuscapitis)、阴沟肠杆菌(Enterobactercloacae)、光滑假丝酵母(Candidaglabrata)、褶皱假丝酵母(Candidarugosa)等[17]。
2.4 生物胺形成菌脱羧酶基因的确定
尸胺、腐胺、酪胺、组胺的形成分别与微生物中的赖氨酸脱羧酶、鸟氨酸脱羧酶、酪氨酸脱羧酶、组氨酸脱羧酶有关。以筛选菌的DNA为模板,采用PCR扩增氨基酸脱羧酶的相关基因,通过琼脂糖凝胶电泳检测该微生物中是否含有脱羧酶基因,凝胶电泳结果见图3。
赖氨酸脱羧酶、鸟氨酸脱羧酶、酪氨酸脱羧酶、组氨酸脱羧酶的目标基因条带大小分别为220,830,700,497 bp。由图3可知,泳道编号1,5,6有赖氨酸脱羧酶和组氨酸脱羧酶的目标基因,对应菌株分别为1BAF1、1BAF5、1BAF6,都为R.ornithinolytica,说明其具有形成尸胺和组胺的能力。筛选菌中未检测到鸟氨酸脱羧酶odc基因和酪氨酸脱羧酶tdca基因,四川泡菜中腐胺和酪胺含量较高,可能由发酵前、中期的微生物脱羧形成,并不断积累导致。

图3 赖氨酸脱羧酶(A)、鸟氨酸脱羧酶(B)、酪氨酸脱羧酶(C)、组氨酸脱羧酶(D)的凝胶电泳结果Fig.3 Gel electrophoresis results of lysine decarboxylase(A),ornithine decarboxylase(B), tyrosine decarboxylase (C) and histidine decarboxylase (D)
2.5 筛选菌生物胺形成能力的验证
将11株筛选菌定量回接至BAF液体培养基中,培养后测定生物胺的含量,结果见图4。

图4 筛选菌生物胺形成能力测定结果Fig.4 Determination results of biogenic amine formation ability of screening bacteria
由图4可知,菌株1BAF1、1BAF5、1BAF6形成了大量的尸胺和组胺,这3株菌都为R.ornithinolytica,结果与2.4一致。其中,菌株1BAF1和1BAF5形成尸胺的能力较强,在BAF液体培养基中培养48 h后,分别形成(766.67±2.17) mg/L和(754.90±29.07) mg/L的尸胺,四川工业泡菜中尸胺含量较高可能与R.ornithinolytica有关,而菌株1BAF5形成尸胺能力较弱,培养结束后测定尸胺含量为(141.22±52.79) mg/L,说明不同菌株的尸胺形成能力强弱存在差异。菌株1BAF1、1BAF5、1BAF6在BAF液体培养基中培养48 h后,含量在308.98~378.89 mg/L之间,说明其产组胺能力差别不大。
3 结论
四川工业泡菜和家庭泡菜的理化特征和微生物数量存在差异,腐胺、尸胺、组胺、酪胺为主要的生物胺,且在四川工业泡菜中,尸胺含量最高。从四川泡菜中筛选出11株产生物胺的细菌,通过检测氨基酸脱羧酶基因及回接产胺实验,验证了R.ornithinolytica具有形成尸胺和组胺的能力,且四川工业泡菜中尸胺含量较高可能与R.ornithinolytica有关。本研究可为四川泡菜生物胺含量的调控提供参考。

