无机盐、激素与真菌联合诱导土沉香抗逆能力的研究
宋晓琛 黄桂华 王西洋 宋 杰 张青青 梁坤南 周再知*
(1.中国林业科学研究院 热带林业研究所,广州 510520; 2.江西省林业科学院,南昌 330032)
土沉香(Aquilariasinensis(Lour.) Gilg),别名白木香,为瑞香科(Thymelaeaceae)沉香属(Aquilaria)乔木,我国特有的药源植物[1]。沉香是沉香属植物受到刺激或损伤后抵抗逆境胁迫产生的次生代谢物[2]。植物在逆境条件下能够产生活性氧,活性氧迸发被认为是过敏反应的特征性表现,也是植物对病原物应答的最早期反应之一[3]。植物清除活性氧主要是通过过氧化物酶(POD,peroxidase)、超氧化物歧化酶(SOD,surperoxide dismutase)、过氧化氢酶(CAT,catalase)等酶类的作用。另外植物在逆境还能产生丙二醛(MDA,malondialdehyde),丙二醛是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度[4~6]。检测土沉香在不同胁迫条件下的抗氧化酶活性和MDA含量,可以推断其抗逆能力及结香进程。
张兴丽[7]对3年生土沉香苗木进行修剪处理,发现茎部的抗性酶活性及MDA含量在处理1h后达到峰值。王东光等[8]通过对8年生土沉香大树进行激素、盐、真菌和物理创伤处理,2个月时树体创伤部位抗性酶活性和MDA含量急剧变化,随后变化缓慢,6个月时抗逆能力高者,挥发油含量也高[9]。土沉香受到胁迫后,木质部导管和管胞中有大量次生代谢物沉积,早期表现为木材颜色变深[10~12]。树体内次生代谢物的产生与抵御胁迫密切相关[13]。目前采用多因素优化组合配比诱导土沉香体内抗性酶活性,以及研究抗逆性与结香部位变色之间的关系甚少。本文在前期无机盐、激素和真菌种类单因素诱导研究基础上,进行优化组合集成设计,对10年生土沉香开展3种无机盐、3种激素与3种真菌联合诱导处理,测定不同组合处理下土沉香的抗逆性,探究抗逆性与结香前期木芯变色长度之间的相关的关系,为土沉香结香技术和机理研究提供理论依据。
1 材料与方法
1.1 试验地概况
试验地位于广东省惠州市惠阳区镇隆镇黄沙水库,属亚热带季风气候区。年均气温21.8℃,年均降水量1 800~2 000 mm,年均日照2 033 h,常年基本无霜;土壤为花岗岩发育的山地红壤。2008年春季种植土沉香,株行距2 m×3 m,种植面积200亩。
1.2 材料
10年生土沉香林分,平均胸径13.15±1.21 cm,平均树高5.82±0.21 m。选择生长健壮、胸径均一的林木为试验材料。
1.3 试验方法
1.3.1 试验设计
试验Ⅰ:以CaCl2、FeSO4、NaCl和黑绿木霉马3-4(Trichodermaatroviride)、腐皮镰孢菌P13-1(Fusariumsolani)和龙眼焦腐菌D2-2(Lasiodiplodiatheobromae)不同配比混合菌液为诱导因子(表1);试验Ⅱ:以茉莉酸甲酯、乙烯利、水杨酸钠和黑绿木霉、腐皮镰孢菌和龙眼焦腐菌不同配比混合菌液为诱导因子(表2)。两个试验均采用均匀试验设计,其中菌液设3个配比水平,其余因子设6个水平。每个试验6个处理,每处理5株,3次重复,完全随机区组排列,以注射等量去离子水为对照。2018年7月,选择晴朗的天气,采用4 mm钻头在树干两侧距离地面80 cm处分别钻孔,输液方式注入配置好的处理液250 mL。
表1 无机盐与菌液组合处理(U6(63×31))
Table 1 The combination treatment of inorganic salts and fungus liquid

处理TreatmentCaCl2(%)FeSO4(%)NaCl(%)3种混合菌配比(体积比)Combinations of three fungus(volume ratio)10.051.01.02∶3∶120.12.02.51∶1∶130.53.00.53∶2∶141.00.52.01∶1∶151.51.50.13∶2∶162.02.51.52∶3∶1CK注射去离子水Inject deionized water
表2 激素与菌液组合处理(U6(63×31))
Table 2 The combination treatment of hormones and fungus liquid

处理Treatment茉莉酸甲酯Methyl jasmonate(%)乙烯利Ethephon(%)水杨酸钠Sodium salicylate(%)3种混合菌配比(体积比)Combinations of three fungus(Volume ratio)10.0050.010.052∶3∶120.010.10.21∶1∶130.050.20.013∶2∶140.10.0050.151∶1∶150.150.050.0053∶2∶160.20.150.12∶3∶1CK注射去离子水Inject deionized water
1.3.2 测定指标与方法
1.3.2.1 抗氧化酶活性测定
分别在树体完成吸收处理液后1、7、30天时,每小区每个处理选取1株,用内径0.5 cm的生长锥在注射孔上方2 cm处钻取木芯,锡箔纸包好放入液氮中。取样当天将样品带回实验室,用液氮磨成粉、超低温冰箱-80℃保存。采用Giannopolitis等[14]的方法测定SOD活性,愈创木酚法[15]测定POD活性,高锰酸钾滴定法[15]测定CAT活性。
1.3.2.2 MDA含量测定
分别称取0.3 g木芯样粉,采用Dhindsa等[16]方法测定MDA含量。
1.3.2.3 木芯变色长度
在树体完成吸收处理液3个月时,沿树干径向方向,用内径0.5 cm的生长锥,在注射孔上方,每隔5 cm钻取土沉香树干木芯,至钻取木芯全为白木为止。测量注射孔上方径向变色长度。
1.3.3 数据统计与分析
采用Excel进行数据处理,运用SPSS19.0和DPS(V7.05)软件进行数据统计分析。应用隶属函数值综合评价法[17]。
2 结果与分析
2.1 诱导处理对土沉香木芯POD活性的影响
试验Ⅰ结果表明(图1),6个处理的POD活性均高于对照,且随处理时间的增加,呈先升高后降低趋势。处理后7天,前5个处理的POD活性均显著增高,其中处理2的POD活性最高,是对照的4.52倍,是处理后1天的1.52倍。处理后30天时,尽管处理2的POD活性有所下降,但仍高于其他处理。
试验Ⅱ结果表明(图1),除CK外,各处理的POD活性随时间的增加,亦呈先升高后降低趋势,但升幅较小。处理后1天、7天和30天时,6个处理的POD活性均显著高于对照。处理后7天,处理4的POD活性显著升高,分别为其余5个处理和对照的1.43、1.40、1.88、1.64、1.84和3.42倍。
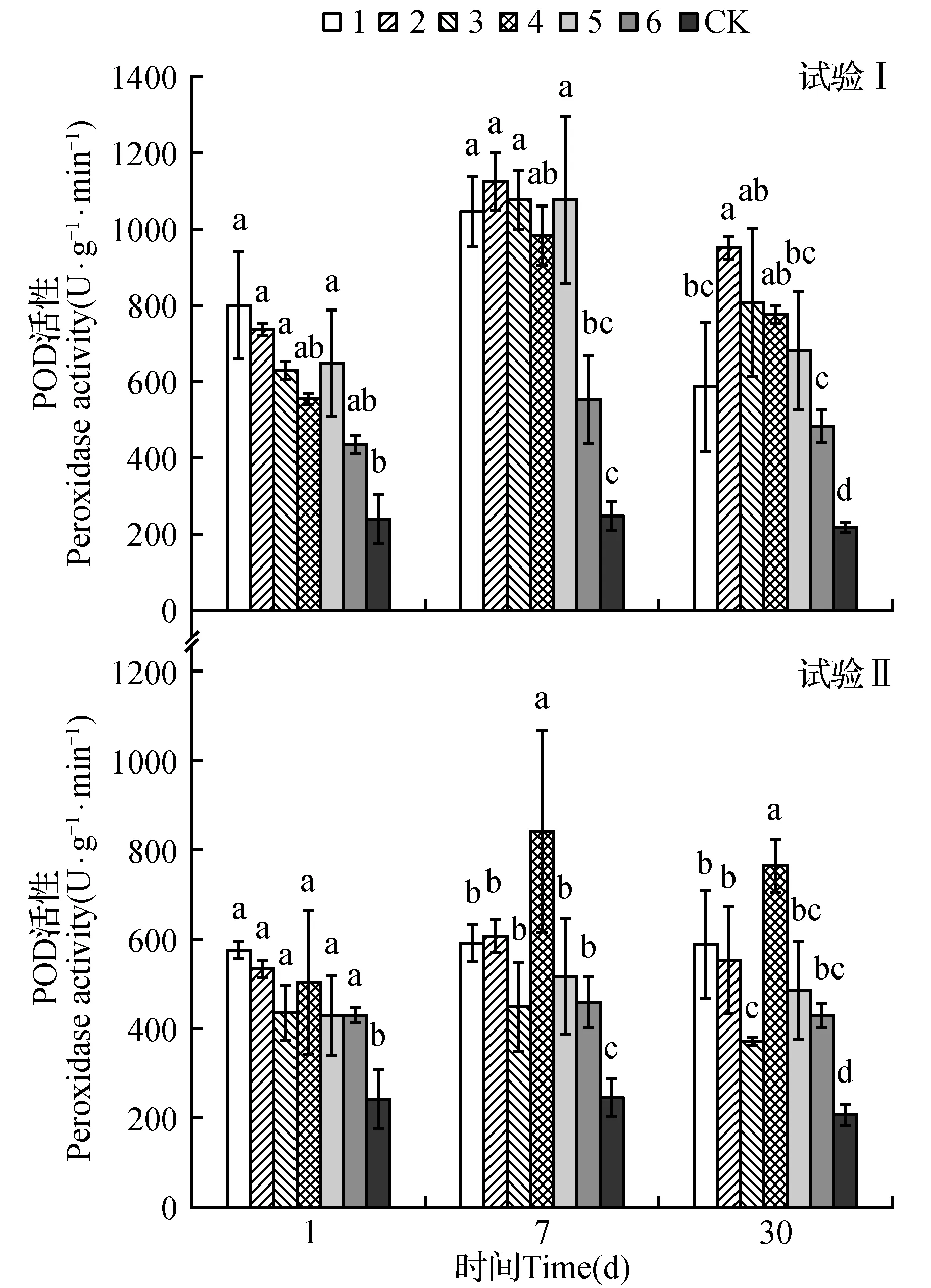
图1 不同处理对土沉香POD活性影响Fig.1 Effect of treatments on peroxidase activity

图2 不同处理对土沉香SOD活性影响Fig.2 Effect of treatments on superoxide dismutase activity
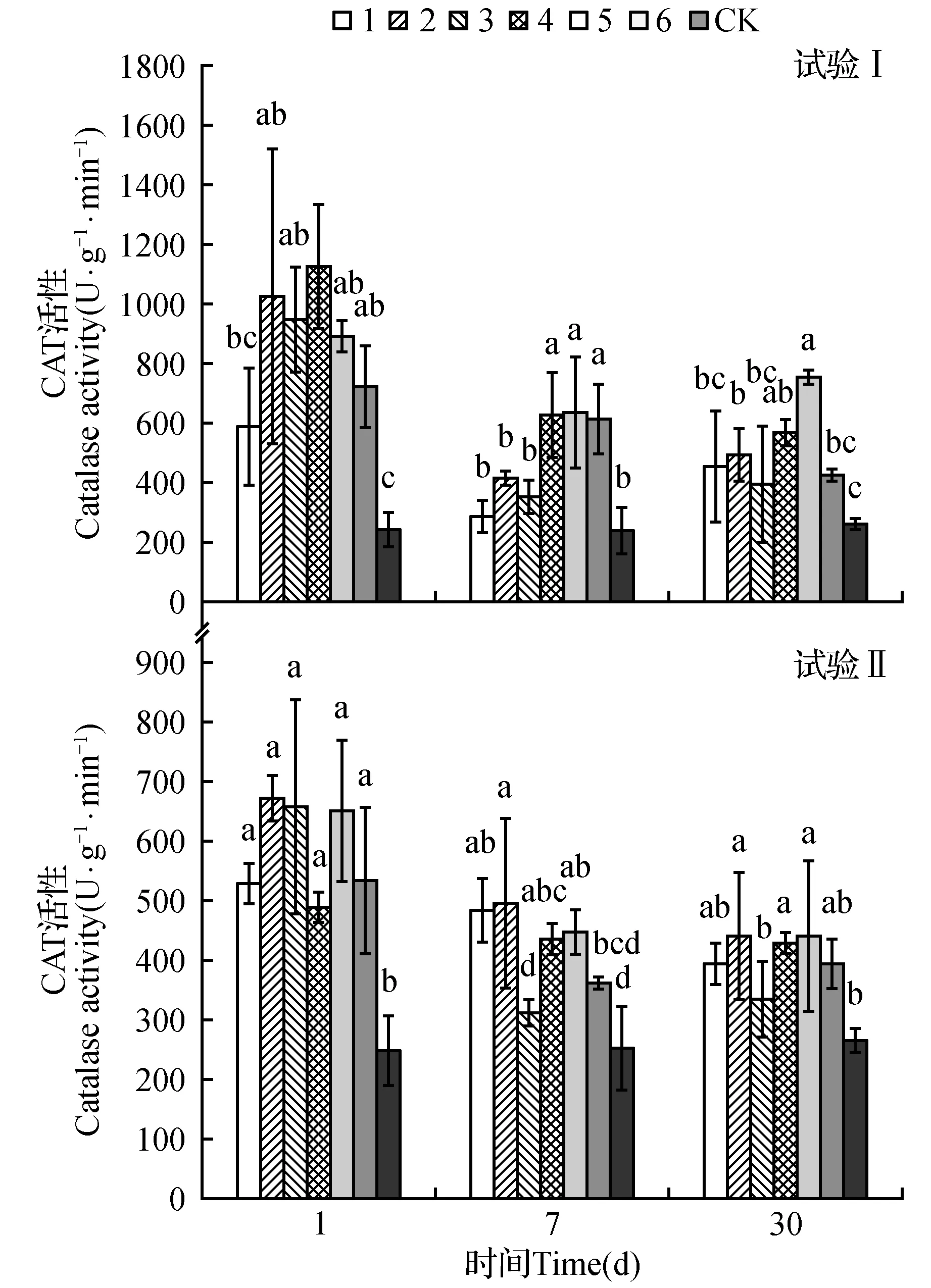
图3 不同处理对土沉香CAT活性影响Fig.3 Effect of treatments on catalase activity
对比试验Ⅰ和试验Ⅱ发现,试验Ⅰ中6个处理的POD活性高于试验II。处理后1天,试验ⅠPOD活性平均为639.2 U·g-1·min-1,而试验Ⅱ为487.2 U·g-1·min-1;处理后7天,试验ⅠPOD活性升幅较大,平均酶活性是试验Ⅱ的1.69倍;处理后30天,试验Ⅰ的POD活性开始下降且降幅较大,比处理后7天的降低26.8%,而试验Ⅱ仅降低8.0%。
2.2 诱导处理对土沉香木芯SOD活性的影响
试验Ⅰ(图2)表明,处理后1天,6个处理的SOD活性均高于对照,尽管处理1和处理2之间差异不显著,但显著高于其他4个处理;处理后7天,处理2、处理4和处理6与处理1、处理3和处理5之间差异显著,其中处理4的SOD活性最高,是处理后1天的2.29倍;处理后30天,除处理5的SOD活性低于对照外,其余处理均显著高于对照。
试验Ⅱ(图2)表明,处理后1天,除处理1的SOD活性显著高于对照外,其余5个处理与对照差异不显著;处理后7天,处理1的涨幅减少,而处理2的涨幅增大,是处理后1天的1.34倍;处理后30天,处理2、处理4和处理6的SOD活性显著低于对照。
除CK外,2个试验各处理的土沉香SOD活性,随时间呈先升后降趋势,处理后7天,酶活性均达到最高值。对比试验Ⅰ和试验Ⅱ发现,处理后1天,2个试验之间SOD活性差异不显著;处理后7天,试验Ⅰ的SOD活性升幅增大,平均酶活性是试验Ⅱ的1.52倍;处理后30天,试验Ⅰ和试验Ⅱ的SOD活性均开始下降,但试验I的降幅较试验Ⅱ低4.2%。
2.3 诱导处理对土沉香木芯CAT活性的影响
试验Ⅰ(图3)表明,处理后1天,各处理间差异显著,其中处理4的CAT活性最高,为1 122.2 U·g-1·min-1,是对照的4.51倍,处理1尽管最低,但仍为对照的2.39倍;处理后7天,处理4、5、6的CAT活性(633.3、633.3、616.7 U·g-1·min-1)显著高于处理1、2、3(288.9、416.7、361.1 U·g-1·min-1);处理后30天,处理5和处理4之间差异显著,且这2个处理的CAT活性显著高于其他处理。
试验Ⅱ(图3)表明,处理后1天,6个处理间差异不显著,但处理2的CAT活性最高,酶活性达672.2 U·g-1·min-1,是对照的2.70倍;处理后7天,处理2依然高于其他处理,处理1、4和处理5显著高于处理3和处理6;处理后30天,处理2、4和处理5与处理1、3和处理6差异显著。
在不同诱导阶段,各处理CAT活性均显著高于对照。除CK外,2个试验土沉香CAT活性随时间呈平稳下降趋势,处理后1天,酶活性达到最高,试验Ⅰ的CAT活性最高的处理4是试验Ⅱ活性最高的处理2的1.7倍。处理后7天,试验Ⅰ降幅较大,平均降低43.4%,而试验Ⅱ仅降低28.2%。
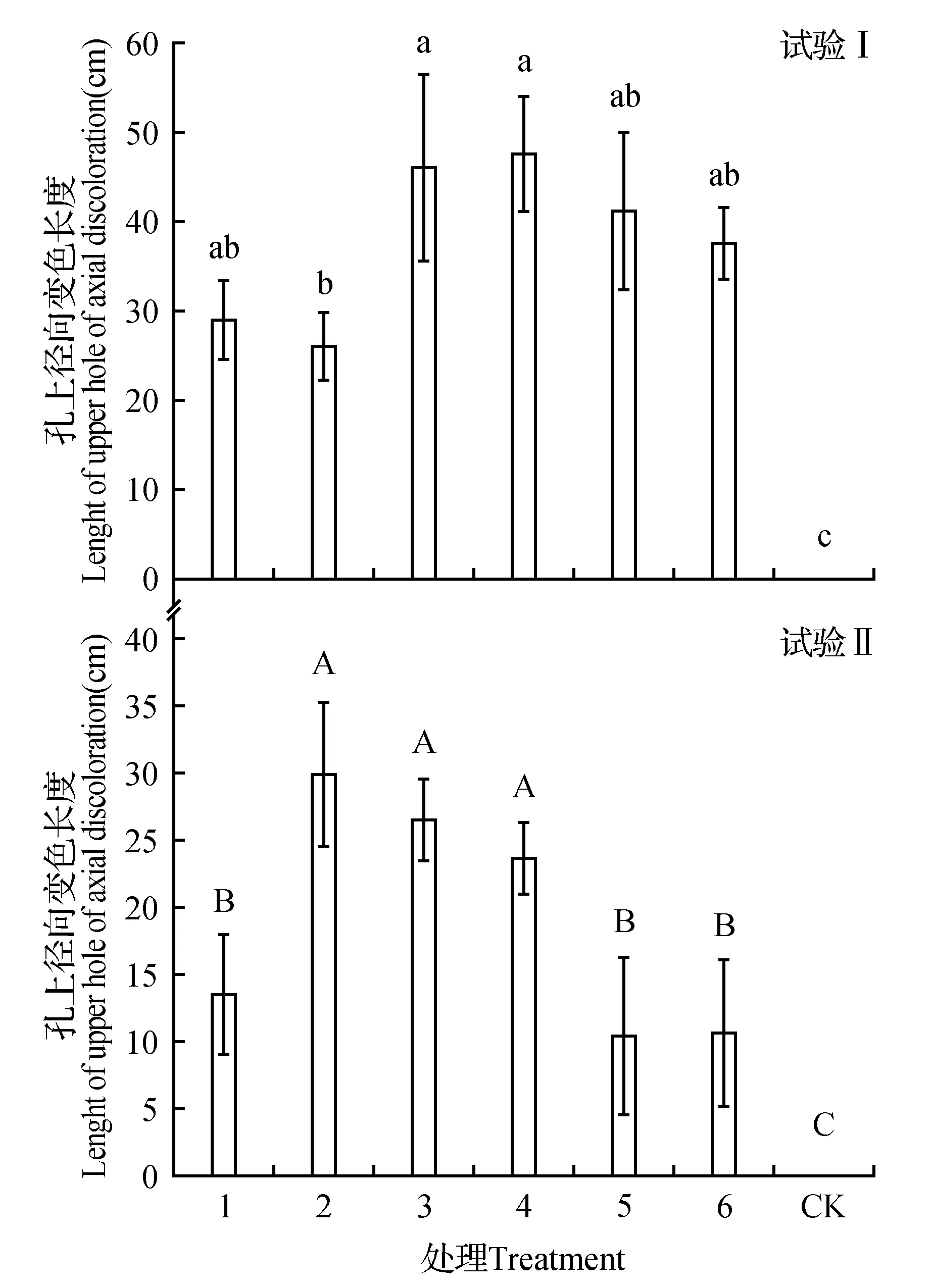
图5 不同处理诱导孔上径向变色长度Fig.5 Change in the axial discoloration length by different treatment
2.4 诱导处理对土沉香木芯MDA含量的影响
试验Ⅰ(图4)表明,6个处理MDA含量在处理后1天显著低于对照,其中处理4 MDA含量最低,为9.18 nmol·g-1FW;处理后7天,6个处理MDA含量均显著高于对照。处理6涨幅最大,是处理后1天的2.59倍。处理1涨幅最小,是处理后1天的1.95倍;处理后30天,各处理MDA含量均下降,其中处理2和处理4降幅度最大,分别降低38.7%和35.9%,而处理1降幅最少,仅减少4.7%。
试验Ⅱ(图4)表明,处理后1天,6个处理MDA含量显著低于对照,其中处理2的MDA含量最低,仅为对照的2/5;处理后7天,各处理MDA含量上升,但仍低于对照。处理后30天,处理2和处理5 MDA含量分别减少4.8和2.6 nmol·g-1FW,其余处理含量上升,但仍低于对照。
对比试验Ⅰ和试验Ⅱ发现,两个试验MDA含量均在处理后1天最低,试验Ⅱ含量最高的处理5依然比试验Ⅰ含量最低的处理4低。试验Ⅰ各处理整体趋势为先上升后下降,但是试验Ⅱ除了处理2和处理5,其余处理MDA含量变化趋势为持续升高。试验Ⅰ在处理后7天和30天,各处理MDA含量高于对照,而试验Ⅱ在处理各阶段,各处理MDA含量均低于对照。
2.5 诱导处理对土沉香木芯变色长度的影响
如图5所示,试验Ⅰ中的处理3、处理4与其余4个处理间差异显著。处理4变色长度最长,为47.6 cm,其次为处理3处理2变色长度最短,CK不变色。
如图5所示,试验Ⅱ中处理2、3、4与处理1、5、6之间差异显著。处理2变色长度最长,为29.9 cm,其次为处理3(26.57 cm),处理5和处理6变色长度最短为11 cm,而CK处理始终不变色。
对比试验Ⅰ和试验Ⅱ发现,试验Ⅰ处理下木芯的变色长度普遍长于试验Ⅱ。试验Ⅰ最长变色长度是试验Ⅱ的1.6倍,试验Ⅰ最短变色长度与试验Ⅱ最长变色长度相当。在诱导土沉香木芯变色上,无机盐与菌液配比诱导优于激素与菌液配比诱导。
2.6 诱导处理下土沉香抗逆能力综合评价
采用隶属函数值综合评价法,对这两个试验12个诱导处理的土沉香木芯中的3种抗氧化酶活性(最高时期)和MDA含量(最低时期)进行综合分析,以评估各处理下的土沉香综合抗逆能力。排序结果见表3,从表3中可见,土沉香不同处理抗逆能力高低顺序为:Ⅰ4>Ⅰ2>Ⅰ3>Ⅰ5>Ⅰ1>Ⅰ6>Ⅱ2>Ⅱ4>Ⅱ1>Ⅱ6>Ⅱ3>Ⅱ5>CK。可见,试验Ⅰ中各处理的抗逆能力大于试验Ⅱ。试验Ⅰ的处理4和试验Ⅱ的处理2分别在同类试验抗逆最强者。此外,将隶属函数综合评价值与木芯变色长度进行线性相关分析,其相关系数r=0.816**,且差异极显著,表明土沉香树体抗逆能力高低与变色长度存在显著的正相关关系,抗逆性越高其相应的变色长度也最长。
表3 隶属函数综合评价
Table 3 Subordinative function comprehensive evaluation
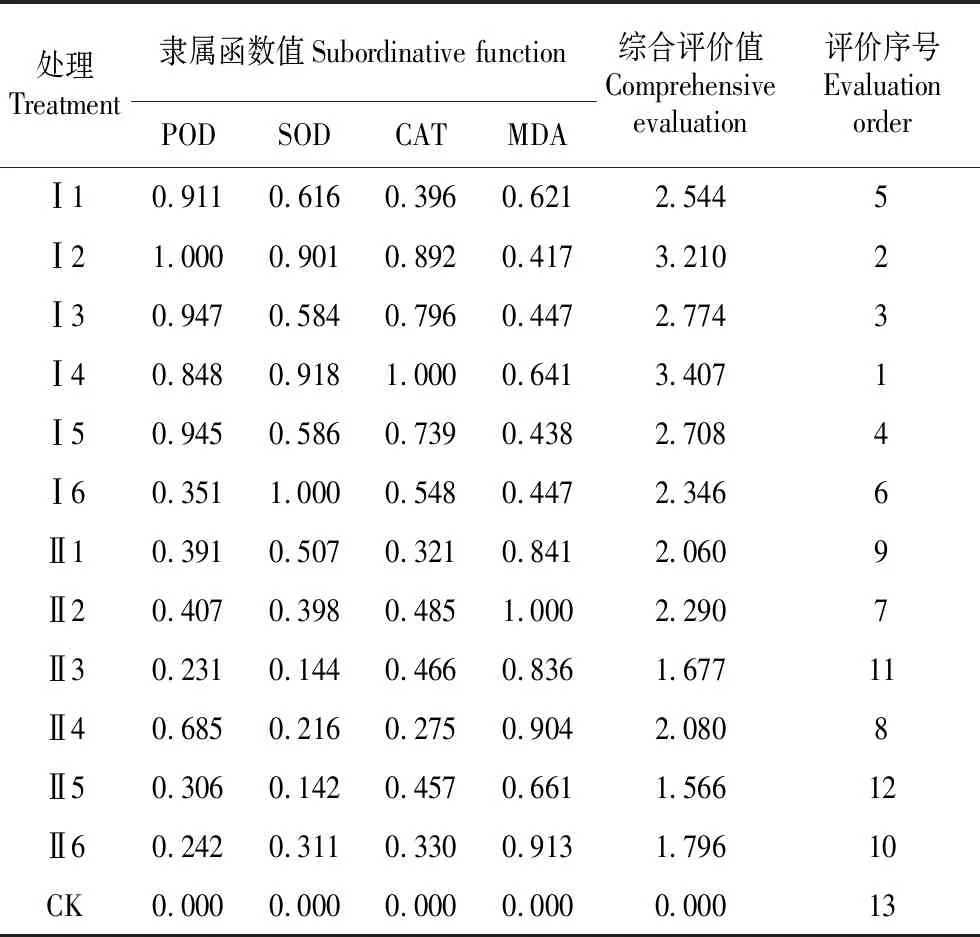
处理Treatment隶属函数值Subordinative functionPODSODCATMDA综合评价值Comprehensive evaluation评价序号Evaluation orderⅠ10.9110.6160.3960.6212.5445Ⅰ21.0000.9010.8920.4173.2102Ⅰ30.9470.5840.7960.4472.7743Ⅰ40.8480.9181.0000.6413.4071Ⅰ50.9450.5860.7390.4382.7084Ⅰ60.3511.0000.5480.4472.3466Ⅱ10.3910.5070.3210.8412.0609Ⅱ20.4070.3980.4851.0002.2907Ⅱ30.2310.1440.4660.8361.67711Ⅱ40.6850.2160.2750.9042.0808Ⅱ50.3060.1420.4570.6611.56612Ⅱ60.2420.3110.3300.9131.79610CK0.0000.0000.0000.0000.00013
2.7 最适配比浓度
运用DPS(V7.05)软件,对2个试验的抗逆能力与诱导因子进行逐步回归分析,建立回归方程。试验Ⅰ中,调整后的相关系数Ra=0.998 7,P=0.034 2。最优组合为0.93%CaCl2+0.53%FeSO4+2.5%NaCl+黑绿木霉:腐皮镰孢:龙眼焦腐(1∶1∶1)时,其抗逆能力最强;试验Ⅱ中,调整后的相关系数Ra=0.999 3,P=0.025 4。最优组合为0.005%茉莉酸甲酯+0.006%乙烯利+0.2%水杨酸钠+黑绿木霉:腐皮镰孢:龙眼焦腐(1∶1∶1),其抗逆能力最强。
3 讨论
3.1 胁迫对土沉香抗氧化酶活性的影响
植物在遭受逆境胁迫时,产生的氧自由基数量增多,为了抵抗逆境对植物造成的伤害,POD、SOD和CAT的活性增加,以便清除活性氧,减少膜脂过氧化,并随着时间的推移逐渐消耗,使其酶活性降低[18~19]。本研究土沉香在受到各处理诱导胁迫1天后,CAT活性先升高,这与郭盈天[20]对金缕梅胁迫下CAT活性变化结论一致;处理后7天,SOD和POD活性上升达到最高值,树体通过提高酶活性增强保护功能;处理后30天,SOD被消耗,酶活性降低,此时CAT活性趋于稳定,POD活性下降,酶系统的稳定性更好地维持活性氧与防御系统间的平衡[21~22]。
盐胁迫使植物渗透调节失衡,造成代谢紊乱。植物通过体内生理变化缓解高浓度离子造成的渗透胁迫[23]。真菌代谢液中可能存在的信号分子,促使土沉香胁迫信号转导,使相关基因表达,抗逆反应及时发生[24]。本研究试验Ⅰ中,无机盐与真菌联合处理的抗氧化酶活性更高,说明土沉香在受到盐和真菌双重刺激下,树体抗氧化系统功能增强。植物激素如乙烯、茉莉酸和水杨酸能促进逆境信号分子传导,调节植物对逆境胁迫的应答反应[25~27]。本研究试验Ⅱ中,通过注射乙烯利、茉莉酸甲酯和水杨酸钠,可能在树体内释放出了乙烯、茉莉酸和水杨酸信号分子,结合真菌诱导产生的信号分子,启动了土沉香防御反应,抗氧化酶活性加强。
3.2 胁迫对土沉香MDA含量的影响
MDA的积累对膜和细胞造成伤害,其本身对植物细胞具有明显的毒害作用,因此通常将它作为反应膜脂过氧化程度和植物对逆境反应强弱的标志[28~29]。在2个试验处理下,处理后1天MDA含量最低,且低于对照。说明诱导开始后,抗氧化酶活性升高,一定程度清除体内过剩的活性氧,使MDA含量降低;诱导后7天,MDA含量上升,说明在胁迫最初一段时间内,机体保护酶系统的调节失去平衡,导致活性氧产生过剩,膜脂过氧化程度加强。随后可能由于体内应激蛋白的调节作用[30],使抗氧化酶活性趋于稳定,从而MDA含量降低或趋于稳定。
无机盐与真菌联合处理(试验Ⅰ)的MDA含量比激素与真菌处理(试验Ⅱ)的高,且处理7天和30天后,试验Ⅰ各处理MDA含量高于对照,而试验Ⅱ相反。可能由于无机盐与真菌联合刺激下,POD、SOD和CAT抗氧化酶活性提高,一定程度清除体内过剩的活性氧,使MDA含量降低,但抗氧化酶调节能力有限,树体内仍积累一定量氧原基,使MDA含量高于对照。
3.3 试验处理间的抗性能力差异
王东光等[9]采用真菌、无机盐和激素单因素处理土沉香6个月,其抗逆性能力大小排序为菌液>无机盐>激素。本研究表明,无机盐与真菌联合处理的土沉香抗逆性显著高于激素与真菌处理,同时无机盐与真菌处理下的木芯变色长度也更长。说明无机盐与真菌联合处理下的抗逆性、次生代谢能力更高。可能是由于在处理30天时间内,土沉香受3种盐类联合胁迫下,细胞内离子处于高渗状态[31],抗氧化酶活性快速提升,从而表现出较强的抗逆性的缘故。激素与真菌联合处理的抗氧化酶活性比无机盐与真菌联合处理的低,涨幅和降幅也较小,这可能是由于激素和真菌信号转导过程较慢的缘故。随处理时间的增加,激素与真菌处理下土沉香的抗逆性或许会有所加大,尚需进一步观测分析。
3.4 木芯变色与结香关系
沉香的形成是木材薄壁细胞内的淀粉依次经过中间产物非淀粉的多糖、醛类或酮类及酚类化合物转化而来[32]。当土沉香受到盐、激素等胁迫后,会出现类似心材变色现象[33~34]。有色化学物质多元酚、有机酸和醋类化合物以及来源于酚经基、碳基等的含氧自由基,这些助色基和生色基与土沉香的变色密切相关[35]。木材变色,一定程度上反应了外源物质诱导结香进程中的次生代谢物的积累程度,与结香质量及挥发油含量有直接的关系。本研究将持续测定与分析木芯中变色相关代谢物质和挥发油含量,进一步深入分析抗逆性、木芯变色长度与挥发油含量之间的关系,深入探讨早期木芯变色与结香质量的关系。
4 结论
(1)土沉香树体抗逆能力与木芯的变色长度呈显著的正相关相关性。无机盐与真菌试验中的处理4(1.0%CaCl2+0.5%FeSO4+2.0%NaCl+黑绿木霉∶腐皮镰孢∶龙眼焦腐(1∶1∶1))和激素与真菌试验中的处理2(0.01%茉莉酸甲酯+0.1%乙烯利+0.2%水杨酸钠+黑绿木霉∶腐皮镰孢∶龙眼焦腐(1∶1∶1))在同类处理中抗逆能力最强处理,相应的木芯变色长度也最长。
(2)黑绿木霉、腐皮镰孢菌和龙眼焦腐菌3种菌剂的最佳混合体积比为1∶1∶1。
(3)3种无机盐与真菌联合诱导土沉香的抗逆性比3种激素与真菌联合诱导的效果更好,木芯变色长度也相对更长。
(4)理论上,土沉香抗逆能力最强诱导组合分别为0.93%CaCl2+0.53%FeSO4+2.5%NaCl+黑绿木霉∶腐皮镰孢∶龙眼焦腐(1∶1∶1)和0.005%茉莉酸甲酯+0.006%乙烯利+0.2%水杨酸钠+黑绿木霉∶腐皮镰孢∶龙眼焦腐(1∶1∶1)两个处理。

