山西运城温室番茄灰葡萄孢对啶酰菌胺的抗性
冯宝珍,李培谦
(运城学院 生命科学系,山西运城 044000)
灰霉病是由灰葡萄孢(BotrytiscinereaPers. ex Fr.)引起的一类病害,其寄主范围广泛,严重危害多种果蔬并造成较大损失。灰霉病的防治主要依赖化学杀菌剂,但是由于灰葡萄孢变异快、繁殖迅速,容易产生抗药性[1]。啶酰菌胺为琥珀酸脱氢酶抑制剂类(Succinate dehydrogenase inhibitor,SDHI)杀菌剂,2004年在英国、德国和瑞士注册登记,截至2007年,该杀菌剂先后在50个国家注册登记,用于100种作物80种病害的防治[2]。琥珀酸脱氢酶(Succinate dehydrogenases, SDHs)广泛存在于细菌细胞及真核生物线粒体内膜中,是唯一一种既能参与柠檬酸循环又负责电子传递的酶。SDHs蛋白由4个亚基组成,黄素蛋白SdhA和铁硫蛋白SdhB为亲水亚基,SdhC和SdhD则为疏水亚基[3]。啶酰菌胺能够抑制SDH蛋白活性,直接阻止线粒体呼吸链电子传递及ATP合成,导致真菌细胞分裂和生长的能量不足,最终引致真菌死亡[4]。
自灰霉病对奎宁体外抑制剂类杀菌剂产生抗性以来[5],啶酰菌胺便成为防治该病害的主要杀菌剂。由于啶酰菌胺对孢子萌发及菌丝生长的作用效果明显,杀菌谱广泛,对多种病害均具有良好的防治效果,如早疫病、灰霉病、白粉病、核盘菌病害、褐腐病等[5]。但是,单一药剂的长期使用导致病原菌抗药性的产生。研究表明,抗药性的产生源于病原菌基因发生点突变,但是各种病原菌点突变的位置和类型各不相同。研究发现,引起黄瓜褐斑病的多主棒孢霉(Corynesporacassiicola)对啶酰菌胺的抗性是由于SdhB亚基发生点突变(H278Y/R)[6];而链格孢(Alternariaspp.)和茄链格孢(A.solani)抗性产生的原因则是SdhB(H278Y/R)、SdhC(H132R)及SdhD(H132R)均发生点突变[7-8]。但是有研究发现桃褐腐病的病原菌美澳核果褐腐菌(Moniliniafructicola)对啶酰菌胺抗性的产生与基因突变没有明确的关系[9]。国外学者研究表明,灰葡萄孢对啶酰菌胺抗性产生是由于SdhB基因225 (P225F/L/T)和 272 (H272Y/R)位点发生点突变[10-13]所致。
为明确运城地区番茄灰葡萄孢对啶酰菌胺敏感性现状及抗药性类型,利用单孢分离法获得灰葡萄孢菌株,检测其对啶酰菌胺的敏感性。分析不同抗性水平菌株的SDH基因,明确其抗药性机制,并对不同抗性水平的菌株进行适应性评价,为灰葡萄孢抗药性研究及防治提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 菌株 供试105个番茄灰葡萄孢菌株于2014-2017年采集于山西运城地区番茄种植保护地。采用单孢分离法获得菌株纯培养,菌株分离培养用马铃薯葡萄糖琼脂培养基(PDA),在PDA斜面培养基上培养5 ~ 7 d,然后置于4 ℃冰箱保存。
1.1.2 试剂及培养基 试验所用啶酰菌胺(Boscalid)水分散粒剂(96%)由上海源叶生物科技有限公司提供。
1.2 方 法
1.2.1 含药培养基的制备 将啶酰菌胺原药用丙酮溶液溶解,再加入少量乳化剂(吐温80),使其溶解更充分,制备质量浓度为32 g/L的啶酰菌胺母液,具体方法参照文献[14]。在无菌操作台上,将7.8 μL的啶酰菌胺药液加入含有50 mL PDA培养基的锥形瓶中,充分混匀后,倒入培养皿中制备含5 μg/mL的啶酰菌胺培养基平板。同样的方法制备含药平板,使培养基中啶酰菌胺的终质量浓度分别为0(CK)、5、10、20、30 μg/mL。
1.2.2 抗药性水平测定 利用抑制分生孢子萌发法以及菌丝生长速率法测定所有供试番茄灰葡萄孢菌株对啶酰菌胺的敏感性,具体方法参照文献[14]。将直径5 mm的菌饼接种于上述培养基内,然后置于22 ℃的恒温培养箱中,培养5 d左右,利用十字交叉法分别测量每个培养皿中的菌落直径,然后计算其平均值。再利用DPS软件计算各菌株的菌丝生长抑制率及EC50值。啶酰菌胺抗性水平标准参照Zhang等[15]的报道,以啶酰菌胺对灰葡萄孢菌群体的敏感性基线 EC50= 1.07 μg/mL 作为参照标准。菌株抗性水平计算依据赵建江等[16]报道的番茄灰葡萄孢菌对啶酰菌胺敏感性测定抗性水平的划分方法:R<10为敏感 (S);10 ≤ R< 50为低抗 (LR);50≤R<100为中抗 (MR);R ≥100为高抗 (HR)。
1.3 抗性的分子机制分析
1.3.1 DNA提取 选择不同抗性水平的菌株各10个,在PDA液体培养基中置于22 ℃摇培3 d,收集菌丝,置研钵内加入液氮后研磨。利用真菌基因组提取试剂盒(UNlQ-10,上海生工,中国)抽提基因组DNA。
1.3.2SDH基因扩增测序 根据Broad Institute (http://www.broadinstitute.org)公布的灰葡萄孢菌株(B.fuckelianaB05.10)基因组数据,设计SdhA、SdhB、SdhC及SdhD基因的扩增引物。引物序列如下:SdhA为SdhAF(5′-ATGTCTTCATTTGCTATGCGTAGATTC-3′)和SdhAR(5′-CTATCCATTTTCATCTTTAGTGACCTTC-3′);SdhB为SdhBF(5′-ATGGCTGCTCTCCGCACAGGTGCCCGC-3′)和SdhBR(5′-TTAGAAAGCCATTTCCTTCTTAATCT- C-3′);SdhC为SdhCF(5′-ATGTTTTCACAGAGAGCAACTCAACAAT-3′)和SdhCR(5′-CTACAAGAAAGCAACCAACGCCAAAGCAC-3′);SdhD为SdhDF(5′-ATGGCTTCATTCATCAAACCATCCGTC-3′)和SdhDR(5′-TTATGCGCGCCAAATTCTTTTGATACC-3′)。 扩增产物回收后送杨凌天润奥科生物科技有限公司测序。
1.3.3SDH基因比对分析 测序结果用软件DNAMAN 6.0进行序列比对,分析发生突变的氨基酸的数量和位置,以明确突变类型与抗性表型的关系。
1.4 适应性评估
1.4.1 菌丝生长速率测定 为了进行适应性评估,选择不同抗性水平菌株各10个,对其菌丝生长速率、分生孢子萌发率以及致病性进行分析,参照Veloukas等[17]报道的方法进行。将直径5 mm菌饼接种于新的PDA平板上,置于22 ℃的恒温培养箱中培养3 d,利用十字交叉法分别测量每个菌落直径,然后计算其平均值。每个菌株设 3 个重复。
1.4.2 分生孢子萌发率测定 PDA平板上培养的菌株置于22 ℃黑暗培养15 d。然后每个平板加入10 mL无菌水,用玻片轻轻刮起制备分生孢子悬浮液。经过 4 层无菌纱布过滤后,配制分生孢子悬浮液浓度为1×106mL-1,备用。然后取20 μL分生孢子悬浮液置于含有不同质量浓度啶酰菌胺的培养基平板上,于22 ℃黑暗放置16 h后,按Veloukas等[17]的方法镜检芽管萌发。每个菌株设 3 个重复。
1.4.3 致病性测定 取20 μL分生孢子悬浮液接种番茄果实,发病后测量病斑大小,计算病情指数。每个菌株接种3个健康番茄果实,试验重复2次。具体操作参照李培谦等[14]的方法。
2 结果与分析
2.1 番茄灰葡萄孢菌株对啶酰菌胺的敏感性
菌丝生长速率试验表明,运城地区分离的105个番茄灰葡萄孢EC50值为0.40~132 μg/mL,根据敏感基线1.07 μg/mL[15],81个菌株表现抗性,EC50值为10.92~132 μg/mL; 24个为敏感菌株,EC50值为0.4~9.94 μg/mL,占供试菌株的77.14% (表1)。根据抗性水平划分标准[16],81个菌株被划分为不同的抗性水平类型,其中17个菌株EC50值>115 μg/mL,为高抗;36个菌株EC50值为53.6~103.2 μg/mL,为中抗;28个菌株EC50值为10.92~52.8 μg/mL,为低抗(图1)。根据运城市各地区番茄灰葡萄孢对啶酰菌胺抗性水平分析发现,盐湖区、夏县、临猗、永济和万荣的抗性频率分别为82%、65.2%、65%、81%和81.3%(图2),其中高抗菌株频率最高的地区为永济,达到25.4%,表明运城地区番茄灰葡萄孢已经出现明显的抗药性。
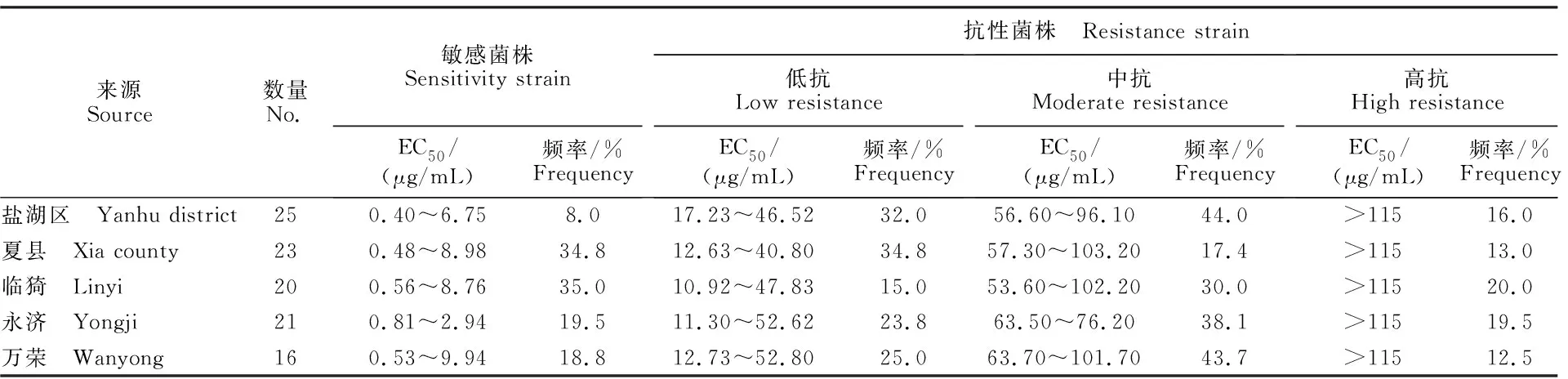
表1 105个番茄灰葡萄孢菌株对啶酰菌胺抗性测定Table 1 Resistance to boscalid of 105 B.cinerea isolates from tomato

图1 番茄灰葡萄孢对啶酰菌胺EC50值范围Fig.1 EC50values of Botrytis cinerea isolates from tomato rejected to fungicide boscalid
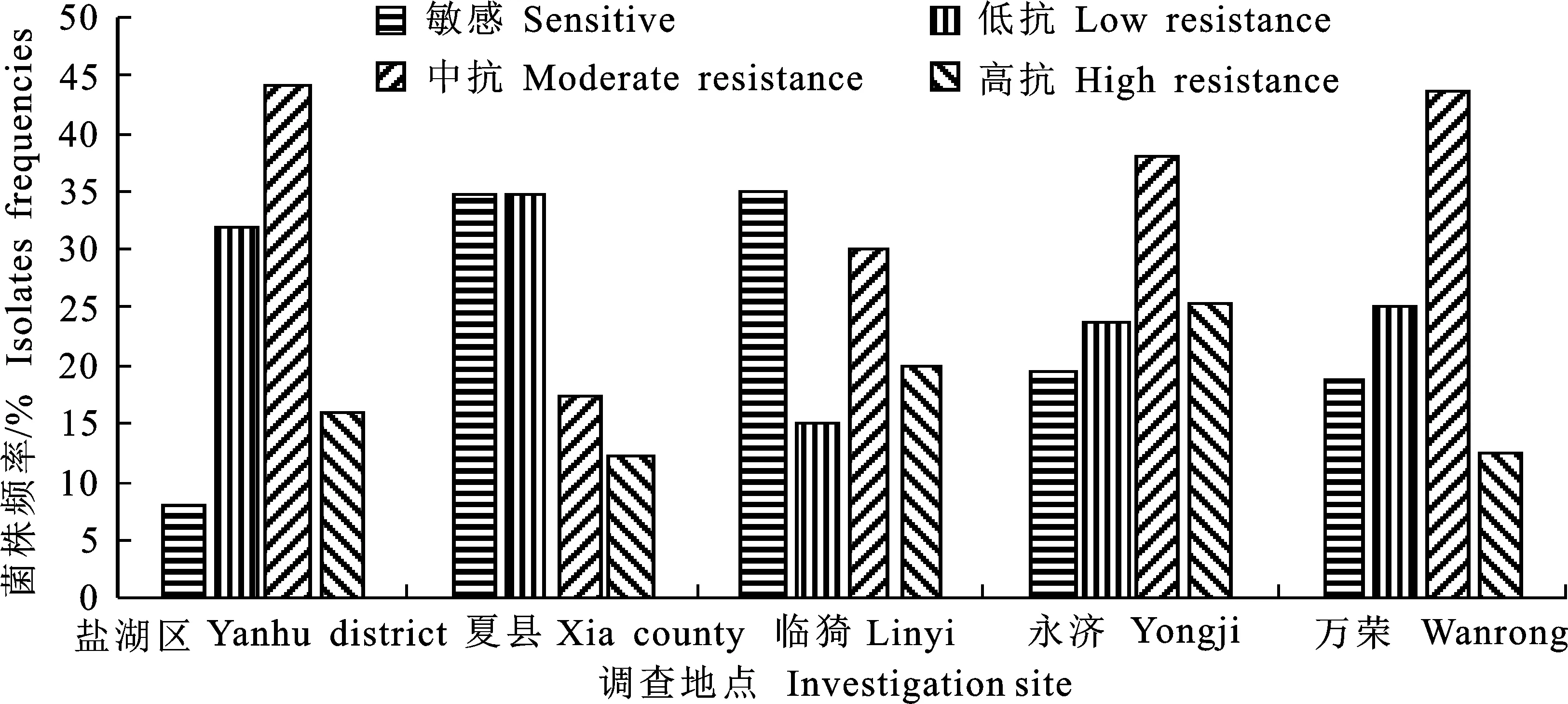
图2 不同地区番茄灰葡萄孢对啶酰菌胺抗性频率Fig.2 Regional distribution frequency of totnato Botrytis cinerea isolates resistant to boscalid
2.2 番茄灰葡萄孢SDH基因比对分析
选择不同抗性水平的菌株进行SdhA、SdhB、SdhC和SdhD基因克隆测序及序列比对分析。结果表明(图3),所选10个敏感性菌株的SdhA、SdhB、SdhC和SdhD基因均与野生型灰葡萄孢菌株(B.fuckelianaB05.10)SDH基因序列一致,表明没有发生突变。而选测的30个抗性菌株的序列比对结果显示,SdhA、SdhC和SdhD均未发生突变,仅在SdhB基因发生点突变,272位组氨酸(H)突变为精氨酸(R),而且突变类型与菌株抗性水平没有明显的相关性。

供试菌株SdhB基因的扩增序列与野生型菌株的序列比对 Sequences alignment ofSdhBgene from selected isolates and wild type isolate. A.B.cinerea菌株 02-389 (AY726619) 和B.cinerea菌株 yc1(KT254306) 源于NCBI数据库的GenBank(https://www.ncbi.nlm.nih.gov),为野生型菌株, FQBC10为供试的敏感性菌株B.cinereastrain 02-389 (AY726619) andB.cinereastrain yc1(KT254306) downloaded from GenBank at NCBI Database ( https://www.ncbi.nlm.nih.gov ) were used as wide-type isolate, FQBC10 was sensitive isolate; B.供试菌株均为低抗型,突变位点为272氨基酸,CAC突变为CGC Lowly resistant isolate, 272 mutation, CAC changed to CGC;C.参试菌株均为中抗型,突变为点为272氨基酸,CAC突变为CGC Moderate resistant isolate, 272 mutation, CAC changed to CGC; D.供试菌株均为高抗型,突变为点为272氨基酸,CAC突变为CGC Highly resistant isolate, 272 mutation, CAC changed to CGC.
图3 对啶酰菌胺不同抗性的番茄灰葡萄孢菌株的SdhB序列比对
Fig.3 Sequences alignment ofSdhBamony tomatoBortytiscinereaisolates with different resistance to boscalid
2.3 适应性评估
抗性菌株与敏感性菌株的菌丝生长速率、分生孢子萌发率以及致病性均存在明显差异(表2)。相同培养条件下,抗性菌株菌丝生长速率明显比敏感性菌株高,而不同抗性水平的菌株之间菌丝生长速率无明显差异。敏感性菌株与突变型菌株产孢量不同。但是敏感菌株分生孢子萌发率最高达到94.72%,而突变菌株分生孢子萌发率也较高,达91%以上。所有供试菌株均能侵染番茄果实发病,并且敏感性菌株与抗性菌株的致病力存在差异,引起的番茄果实病斑大小显著不同。
3 结论与讨论
番茄灰霉病是温室番茄栽培中的常见病害,冬春季节低温高湿环境更利于该病害的发生流行。目前,番茄灰霉病防治主要依赖于化学药剂,啶酰菌胺因其杀菌普广,作用效果强,被作为推荐用药之一[2]。但是,随着啶酰菌胺的使用次数和使用量不断增加,导致灰葡萄孢对其产生不同程度的抗药性。已有欧美多个国家报道田间灰葡萄孢(B.cinerea)对啶酰菌胺产生抗性[10-13]。目前已有部分学者报道国内蔬菜水果对啶酰菌胺的抗性发生。石延霞等[18]报道华北地区蔬菜作物灰葡萄孢对啶酰菌胺产生较高水平的抗药性,抗性频数达到65.88%。刘欣等[19]发现上海地区草莓灰葡萄孢对啶酰菌胺的抗性水平及抗性频率较高,高抗菌株频率达到20.51%。本研究对运城地区番茄灰葡萄孢抗性进行测定,发现对啶酰菌胺产生抗性的菌株达到77.14%,说明运城地区番茄灰霉病对啶酰菌胺的抗药性已经很普遍。


表型Phenotype菌丝直径/cmHyphal diameter产孢(×106)/mL-1Sporulation分生孢子萌发率/%Percent of condinial germination病斑/cmLesion敏感菌株 Sensitive isolate6.05 ± 0.36 a6.73 ± 0.47 a94.72 ± 0.83 a1.62 ± 0.06 a高抗菌株 Highly resistant isolate6.81 ± 0.41 b6.16 ±0.65 b92.64 ± 1.05 bc1.65 ± 0.08 a中抗菌株 Moderate resistant isolate6.90 ± 0.34 b6.93 ± 0.32 a91.32 ± 2.43 b1.54± 0.15 bc低抗菌株 Lowly resistant isolate7.07 ± 0.27 b6.15 ± 0.89 b93.05 ± 2.06 c1.55 ± 0.12 c
注:同列不同小写字母表示差异显著(P<0.05)。
Note: The different lowercases letters represent significant difference in same column(P<0.05).
运城不同地区的番茄灰葡萄孢菌株对啶酰菌胺的抗性频率差异较大,这与温室耕作及作物连作栽培管理有关。在采样过程中,笔者了解到盐湖区部分温室夏季栽培番茄,秋冬仍然栽培番茄,连作为灰葡萄孢提供休眠繁衍的场所,也增加农药使用频率,使灰葡萄孢更易产生抗药性。而临猗和夏县的温室夏季大多栽培西瓜,秋冬栽培番茄黄瓜,在一定程度上减少了灰葡萄孢的发生次数。因此,病害防治应坚持以加强栽培管理为主的综合防治策略。
国外学者研究发现抗药性产生源于病原菌基因发生点突变,主要是琥珀酸脱氢酶SdhB亚基272位组氨酸(H)突变为精氨酸(R)、酪氨酸(Y)或酪氨酸(L),但H272R常见[14]。也有研究发现该基因的225位脯氨酸发生突变P225L/F/T[12]。国内学者刘欣等[19]报道上海地区草莓灰葡萄孢抗性与琥珀酸脱氢酶SdhB亚基发生H272R或P225F突变有关。本研究发现番茄灰葡萄孢抗性菌株SdhB亚基发生H272R突变,未见其他类型突变。并且基因突变与菌株抗性水平没有明确的关系,这与前人研究结果一致[14]。
适应性可以被定义为等位基因、个体或群体的存活和繁殖成功[20]。抗性菌株的适应性是影响抗性产生、进化或衰退风险的重要因素。真菌种群中抗药性的进化在很大程度上取决于菌株的适应性,分析适应性对病害管理有重要意义[21]。对QoIs类杀菌剂具有单一抗性的灰葡萄孢未产生任何适应性变化[22-23]。而Veloukas等[17]认为啶酰菌胺抗性灰葡萄孢产生的适应性变化是由于SdhB亚基突变引起的。Laleve等[24]报道具有多个SdhB基因发生H272R 及P225L突变的灰葡萄孢产生了适应性变化。本研究中发现抗性菌株SdhB基因发生H272R突变,与野生型和敏感型菌株相比在菌丝生长速率、产孢量、孢子萌发率以及致病性上都发生明显变化,这与前人研究结果一致[17,24]。
本研究分析运城地区番茄灰葡萄孢对啶酰菌胺的抗药性,发现该地区番茄灰葡萄孢菌株普遍产生了抗药性,抗性频率达到77.14%。对抗性菌株进行靶标位点基因测序分析,发现抗性产生主要是由于琥珀酸脱氢酶SdhB亚基发生H272R突变,未发现SdhA、SdhC或SdhD突变。并且不同抗性水平的菌株SdhB亚基突变类型一致。适应性分析发现,敏感菌株与抗性菌株在菌丝生长速率、产孢量、孢子萌发率以及致病性方面都存在明显差异。抗耐药策略旨在通过降低使用属于不同化学类别杀菌剂的抗性基因的速率来减缓耐药频率。不同杀菌剂与SDHI交替应用有助于降低抗性频率。生产中不同的SDHIs交替可能增加交叉抗性基因型的频率,因此需要强调正确的用药方案和使用适当的农药混配的重要性。本研究对于分析灰葡萄孢抗药性机制及SDHI类杀菌剂抗药性分析提供理论支持,为农药抗性分子生物学分析提供重要理论依据。同时对于科学使用农药及进一步抗药性监测提供方法。

