非小细胞肺癌组织及细胞中IL-35的表达
张 玉,张城城,2,董利菊,沙 泉
随着恶性肿瘤发病率与死亡率的逐年增加,人类健康受到了严重威胁。肺癌已经成为男性发病率和死亡率最高的恶性肿瘤[1]。虽然肺癌的研究近年来已取得一定进展,但是非小细胞肺癌(non-small lung cancer,NSCLC)发现时多已处于中晚期,5年生存率并未显著提高[2]。白细胞介素35(interleukin-35,IL-35)是新发现的白细胞介素12(interleukin-12,IL-12)家族成员,由EB病毒诱导基因3(epstein-barr virus-induced gene 3,EBI3)和P35组成的异源二聚体,主要在免疫细胞中表达[3]。研究[4-6]显示,IL-35在肝癌、胰腺癌、结直肠癌等多种肿瘤组织中高表达,参与肿瘤的发生发展与转移。但IL-35在NSCLC中的表达情况知之甚少。该研究拟通过分析IL-35在NSCLC中的表达和与患者预后的关系,以及对肺癌细胞生物学功能的影响,阐明IL-35在NSCLC发生、发展中的可能作用,为肺癌的靶向治疗提供新的作用靶点。
1 材料与方法
1.1 病例资料收集安徽医科大学第一附属医院普胸外科2015年1~12月的74例NSCLC患者石蜡包埋的肺癌组织,被研究者临床资料完整,手术前均未行放化疗。NSCLC患者男47例,女27例;年龄43~84(61.31±8.49)岁,其中腺癌41例,非腺癌33例。根据国际肺癌TNM标准分期:T1+T2者55例,T3+T4者19例;淋巴结转移:N0+N1者54例,N2+N3者20例:远处转移 M0者65例,M1者9例。选择同期入院治疗的肺部良性病变患者石蜡包埋的肺组织25例,设为对照组,男14例,女11例;年龄21~68(45.92±15.06)岁,其中肺大疱7例,硬化性血管瘤5例,错构瘤4例,支气管扩张4例,其他5例。
1.2 主要试剂免疫组化试剂盒购自北京中杉金桥生物技术有限公司;RNA提取试剂盒购自台湾GeneMark生物公司;逆转录及SYBR Green荧光定量PCR试剂盒均购自南京Vazyme公司;人肺腺癌细胞株A549、NCI-H1975和PC-9为本单位免疫学省级重点学科实验室保存;正常人肾上皮细胞HEK293由安徽医科大学寄生虫学教研室馈赠;DMEM细胞培养基购自以色列BI公司;胎牛血清购自杭州四季青生物公司;Transwell小室购自美国Corning公司;CCK-8购自上海贝博生物公司;IL-35的亚基EBI3和P35抗体购自美国Abcam公司;人重组IL-35蛋白购自美国PeproTech公司。
1.3 方法
1.3.1免疫组化法检测IL-35两个亚基在NSCLC组织中的表达 采用SP法,以PBS代替一抗作阴性对照。首先组织切片经二甲苯脱蜡,梯度酒精(100%、95%、75%)水化。柠檬酸盐缓冲液(pH 6.0)于高压锅中加热煮沸,放入切片,盖上压力气阀至喷气后1~3 min进行抗原修复,3% H2O2孵育10 min,以阻断内源性过氧化物酶活性。PBS冲洗,然后一抗4 ℃孵育过夜,PBS冲洗,二抗37 ℃孵育30 min,DAB显色冲洗。最后苏木精复染,酒精脱水,二甲苯透明,树胶封片,镜检并拍照记录。免疫组化结果判断:本实验采用许良中 等[7]的方法,根据细胞着色程度和阳性细胞占观察细胞百分比的评分乘积进行半定量。随机选取5个400倍视野,每个视野计数100个细胞,按着色程度评分:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。按阳性细胞占观察细胞百分比评分:无阳性细胞为0分,阳性细胞≤10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。将两项得分结果相乘:0~2分为阴性(-),3~5分为弱阳性(+),6~8分为中度阳性(),>8分为强阳性()。其中-定义为蛋白阴性,+~定义为蛋白阳性。
1.3.2细胞培养与传代 细胞培养于含10%胎牛血清的DMEM培养液中,于37 ℃、5%CO2、相对湿度90%的培养箱中培养,隔天换液,显微镜下观察细胞形态,若为单层紧密状态时,用EDTA-胰蛋白酶消化,收集对数生长期的细胞用于后续实验。
1.3.3RT-PCR法检测细胞中IL-35亚基表达水平 分别收集对数生长期的A549、NCI-H1975、PC-9和HEK293细胞,提取总RNA作为模板并逆转录生成cDNA进行RT-PCR。EBI3:上游引物:5′-CCTTCATTGCCACGTACAGG-3′,下游引物:5′-GGGCTTGATGATGTGCTCTG-3′,扩增长度为206 bp;P35:上游引物: 5′-TCAGAATTCGGGCAGTGACT-3′,下游引物: 5′-AGTCCCATCCTTCTTTCCCC-3′,扩增长度为163 bp。内参为β-actin,PCR反应预变性温度:95 ℃、5 min,1个循环。循环反应温度:95 ℃,10 s;60 ℃,30 s,40个循环。溶解曲线温度:95 ℃,15 s;60 ℃,60 s;95 ℃,15 s,1个循环。
1.3.4CCK-8法检测细胞增殖能力 取对数生长期的A549细胞,计数细胞:每100 μl细胞数为2 000~5 000个,加入到96孔板中,待细胞贴壁,分别用2、10、50 ng/ml的IL-35刺激48 h后,每孔中加入10 μl CCK-8溶液,继续培养1~4 h,于酶标仪450 nm 波长处测吸光度(A)值。
1.3.5划痕实验和Transwell小室测细胞迁移侵袭能力 划痕实验:取对数生长期的A549细胞,胰酶消化,在6孔板中加入5×105个细胞,37 ℃培养过夜。用无菌枪头缓慢划痕,用PBS清洗细胞2~3次去除浮起的细胞。对照组加入含0.5%血清的DMEM培养基,IL-35组在加入含0.5%血清的DMEM培养基的同时,加入50 ng/ml的IL-35,放入37 ℃培养,按0、12、24 h取样,拍照。Transwell实验:A549细胞用50 ng/ml的IL-35刺激24 h后,胰酶消化制成5×105个/ml的细胞悬液。在小室上层加入20 μl Matrigel覆盖整个聚碳酸酯膜后自然晾干。下层加入含10%血清的DMEM培养基600 μl,上层加入200 μl不含血清的A549细胞悬液,37 ℃继续培养24 h,多聚甲醛固定30 min,0.1%结晶紫染色15~20 min,显微镜下拍照计数。
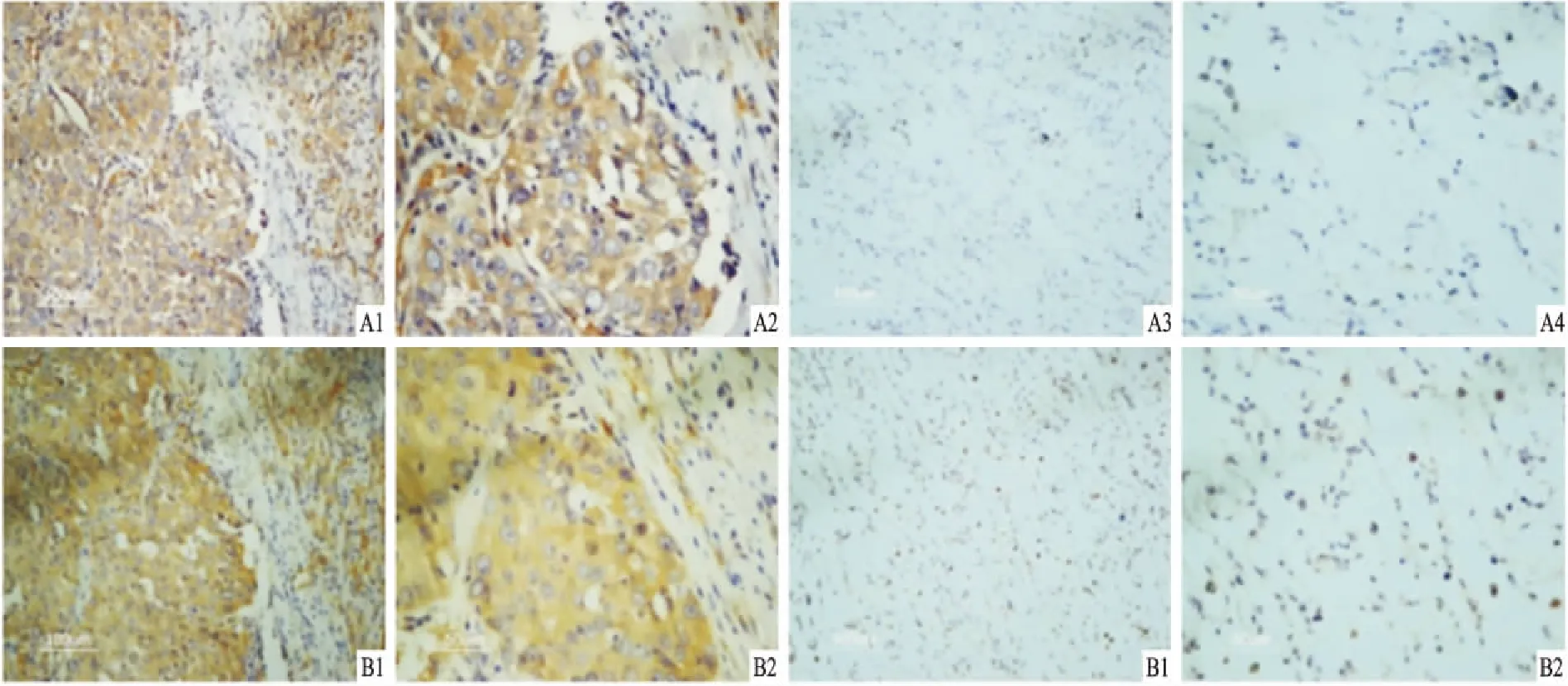
图1 NSCLC和肺部良性病变组织中EBI3和P35的表达
2 结果
2.1 IL-35在NSCLC组织中的表达免疫组化连续切片法染色结果显示,NSCLC组织中EBI3和P35的表达水平明显高于肺部良性病变者(图1),且EBI3和P35在空间分布和表达水平上有很强的相关性(rs=0.770,P<0.001),见表1,所以这两者的表达可以代表IL-35的表达水平,将IL-35表达定义为EBI3和P35都为(/),其余情况为IL-35不表达。免疫组化结果表明NSCLC组织中可能高表达IL-35。统计分析显示,IL-35表达与肿瘤T分期(χ2=5.129,P<0.05)、淋巴结转移(χ2=8.761,P<0.01)呈正相关性,与患者性别(χ2=0.667,P>0.05)、年龄(χ2=0.746,P>0.05)、组织类型(χ2=1.66,P>0.05)、分化程度(χ2=0.688,P>0.05)及远端转移(P>0.05)等无相关性(表2),以上结果提示:IL-35可能是肺癌的潜在标志物。
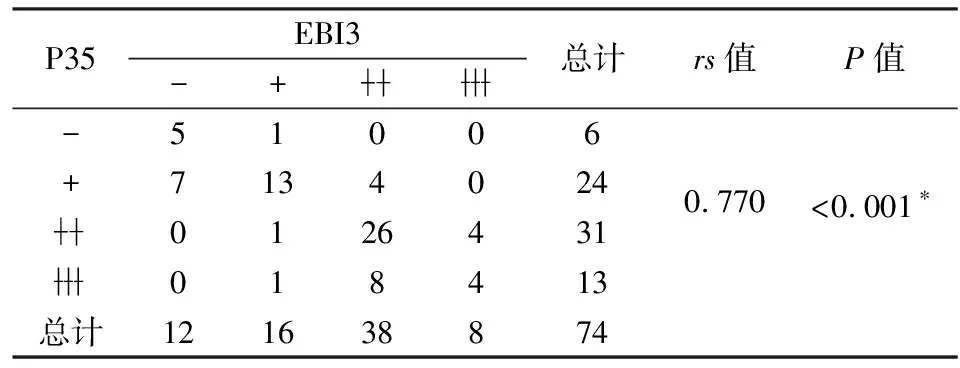
表1 IL-35两个亚基在74例NSCLC中表达的相关性
*采用Spearman相关性分析

表2 IL-35表达与NSCLC病理特征的相关性(n)
2.2 IL-35亚基在肺癌细胞和HEK293中的表达以人肾上皮细胞HEK293为对照,通过RT-PCR法检测IL-35亚基EBI3和P35在不同肺癌细胞系中的表达。结果显示,IL-35亚基在肺癌细胞系A549、H9175、PC-9中的表达水平与人正常细胞HEK293细胞有差异(图2),表明IL-35可能在肺癌的进展中发挥重要作用。

图2 EBI3和P35在不同肺癌细胞系和正常细胞中的表达
2.3 IL-35对A549肺癌细胞增殖的影响鉴于IL-35在A549细胞中表达量最高,且易培养,因此选择A549细胞作为后续研究对象。不同浓度的人重组外源性IL-35蛋白作用于A549细胞48 h后,通过CCK-8法检测显示,50 ng/ml的IL-35可明显促进A549肺癌细胞的增殖,与0 ng/ml比较,差异有统计学意义(P<0.001),见图3。

图3 不同浓度IL-35对A549细胞活力的影响
2.4 IL-35对A549细胞迁移和侵袭能力的影响采用划痕实验于0、12、24 h分别检测50 ng/ml的IL-35对A549细胞迁移能力的影响,结果显示,IL-35具有一定的促进肺癌细胞迁移的能力,与对照组比较,24 h后划痕相对宽度明显降低,差异有统计学意义(P<0.001),见图4A、4B。Transwell小室实验结果显示,IL-35具有一定的促进肺癌细胞侵袭的作用,与对照组比较,IL-35组侵袭细胞数量明显增加,差异有统计学意义(P<0.01),见图4C、4D。由此可推测IL-35可明显促进A549细胞的迁移和侵袭。
3 讨论
肺癌是发病率和死亡率增长最快,对人类健康和生命威胁最大的恶性肿瘤之一。肺癌好发于支气管黏膜上皮,病因至今尚不完全明确。随着医疗水平的提高,肺癌的治疗方法日益丰富,已发展成为手术为主,放疗、化疗和免疫治疗等治疗手段为辅的综合性治疗,但NSCLC确诊时多已属于晚期,总体预后情况仍不容乐观[8-9]。随着分子生物学的不断发展,基因治疗已成为肿瘤治疗的研究热点,而寻找有效的靶基因尤为重要。研究证实,白细胞介素能影响包括肿瘤细胞在内的多种细胞的增殖、成熟、黏附及转移等多方面生理过程。大量动物实验结果显示,IL-12对肝癌、肾细胞癌等多种癌症具有防治效果,可增强免疫应答,发挥抗肿瘤作用[10]。
IL-35是IL-12家族的最新成员,主要由Treg细胞分泌,在单核细胞、T细胞、B细胞及肿瘤细胞等多种类型细胞上表达,通过激活JAK-STAT信号通路参与免疫功能的调节,除了直接抑制肿瘤微环境的肿瘤免疫状态,引起免疫逃逸,IL-35还能直接作用于某些肿瘤细胞促进肿瘤的进展[11]。Wang et al[12]研究发现,IL-35在B细胞淋巴瘤、黑色素瘤及鼻咽癌等多种肿瘤组织和肿瘤细胞系中都有表达。有研究[13]证实IL-35在急性髓系白血病中,除了能诱发肿瘤的免疫逃逸机制外,也能直接促进肿瘤增殖及抑制肿瘤凋亡。一项NSCLC研究[14]显示,NSCLC患者血浆IL-35水平较正常对照人群明显升高,且血浆IL-35高表达水平与较差的TNM分期及淋巴结转移显著相关,单因素及多因素分析显示血浆IL-35是NSCLC患者的独立预后因素。由此可见,IL-35可能在肿瘤的发生、发展过程中发挥重要作用。
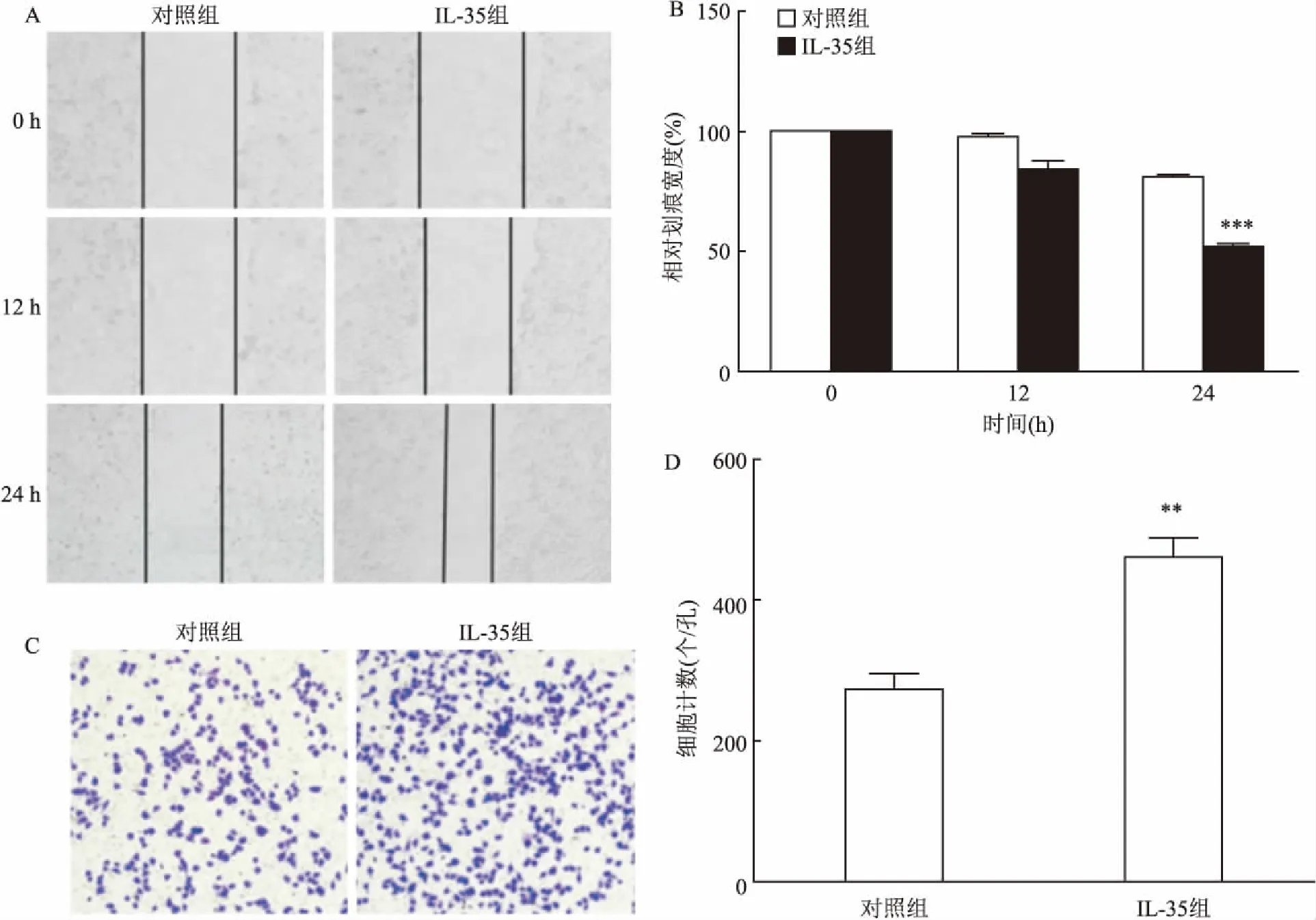
图4 IL-35对A549细胞迁移和侵袭的影响
A:显微镜下细胞迁移能力的差异×50;B:划痕愈合的相对定量分析;与对照组比较:***P<0.001;C: 显微镜下细胞侵袭能力的差异×100;D:细胞侵袭数目的定量分析;与对照组比较:**P<0.01
本研究通过免疫组化法检测NSCLC患者和对照组组织中IL-35的表达水平,结果显示NSCLC患者组织中IL-35的表达明显高于肺部良性病变患者,初步表明IL-35在NSCLC患者组织中异常高表达。通过统计分析74例NSCLC患者组织中IL-35表达差异与临床病理特征之间的相关性得出:IL-35表达与肿瘤分期、淋巴结转移呈正相关性, 与患者性别、年龄、组织类型、分化程度及远端转移等均无相关性,而复发和早期转移是NSCLC预后不良的主要因素,说明IL-35的高表达水平和患者的不良预后相关,提示其可能影响NSCLC的发生、发展。接着通过体外细胞功能学实验证实,人重组IL-35蛋白能明显促进肺癌细胞的增殖、迁移和侵袭,表明IL-35在NSCLC中可能是一种新的促癌不良因子,参与肺癌的不良进程。因此,IL-35可以作为一个新的有效的治疗靶点,应用于临床和靶向药物的研发。
综上所述,IL-35在NSCLC中高表达,并促进肺癌细胞的增殖、迁移与侵袭,为深入研究IL-35对肿瘤的作用提供了线索,IL-35可能是一种NSCLC诊断和预后判断的新型标志物,但是IL-35发挥促癌作用的具体分子机制仍待进一步研究。

