亮菌口服液对5-FU化疗后小鼠肠黏膜屏障及肠道菌群移位的影响
董文钦,朱耀东,李 平,张 梅
化疗引起的肠黏膜屏障的损伤,又称“化疗性肠黏膜损伤”(chemotherapy-inducedintestinal mucosal injury, CIMI),是目前癌症化疗中常见的副作用[1]。目前对CIMI的防治主要集中于控制症状,促进肠黏膜修复等,但许多药物价格昂贵,效果欠佳[2]。亮菌是我国最早发现并拥有自主知识产权的一种真菌,经发酵提取的亮菌口服液(armillariella oral solution, AOS)常被用于临床。研究[3]表明,AOS能够明显改善慢性胃炎、肠炎的临床症状和体征。课题组前期研究[4]证实,AOS的主要成分亮菌多糖能缓解CIMI,其机制可能与抑制肠上皮细胞的凋亡有关,然而,CIMI作用机制复杂,其是否与肠黏膜屏障功能的调节有关,相关的研究报道较少。研究[5]表明,肠道菌群失调是5-氟尿嘧啶(5-fluorouracil, 5-FU)诱导CIMI中重要的作用机制之一,肠黏膜屏障的破坏使不同的病原体进入宿主,导致肠黏膜的损伤[6]。该研究通过建立化疗性肠黏膜损伤模型,用AOS进行干预,检测不同剂量AOS作用后肠黏膜屏障和菌群移位的情况,探讨AOS对化疗性肠黏膜损伤的保护作用及可能的机制。
1 材料与方法
1.1 实验动物及试剂C57BL/6小鼠购自安徽医科大学实验动物中心,雌雄不拘,SPF级,体质量(17~22)g,4~6周,共36只。处于室温22 ℃,湿度50%,通风环境良好。AOS购自合肥诚志生物制药有限公司;双歧杆菌三联活菌片(combined bifidobacterium and lactobacillus tablets group,CBL )购自内蒙古双奇药业股份有限公司;5-FU购自天津金耀有限公司;异硫氰酸荧光素-葡聚糖(fluorescein isothiocyanate-dextran, FITC-Dextran)购自西安瑞禧生物科技有限公司;ELISA试剂盒购自上海碧云天生物科技有限公司;麦康凯培养基和哥伦比亚血平板购自合肥天达诊断试剂有限公司。带状闭合蛋白(zonula occludens, ZO-1)小鼠单克隆抗体、咬合蛋白(occludin)小鼠单克隆抗体购自美国Proteintech公司;小鼠/兔聚合物法检测系统购自北京中衫金桥生物技术有限公司。
1.2 仪器ThermoFisher FC型全波长多功能酶标仪购自美国Thermo公司;AIR TECH型超净工作台购自苏州市苏净集团安泰公司;DHG-9070型电热恒温鼓风干燥箱购自上海齐欣科学仪器有限公司;PYX-DHS型恒温培养箱购自上海跃进医疗器械厂;全自动微生物分析仪(VITEK 2 Compact)购自法国Biomerieux公司;GFL1008型水浴锅购自深圳市朗诚科技股份有限公司;LG300型光学显微镜购自无锡市朗伽生物医学有限公司;RM2235型切片机购自德国莱克公司;Image-Pro-Plus6.0图像分析软件购自美国Media Cybernetics公司。
1.3 实验分组及处理适应性喂养3 d后,将36只小鼠随机分均为6组:正常组,模型组,双岐杆菌组(450 mg/kg)[7],亮菌口服液低剂量组(1 ml/kg)、中剂量组(5 ml/kg)、高剂量组(10 ml/kg)[8]。模型组、AOS组和双歧杆菌组均接受5-FU腹腔注射7 d(50 mg/kg,第8~14天),化疗前2 h分别接受等体积生理盐水、亮菌口服液及双歧杆菌溶液灌胃,共14 d(第1~14天)。
1.4 检测
1.4.1小鼠肠组织肉眼观及光镜下观察 化疗结束后24 h,颈椎脱臼法处死小鼠,取出十二指肠下端至回盲部肠管,观察肠组织大体形态。取中段空肠2~3 cm,浸入4%多聚甲醛中,固定24 h。石蜡包埋、切片,常规HE染色,光镜下观察肠黏膜结构。
1.4.2FITC-Dextran示踪法[9]检测肠道通透性 实验结束前4 h动物禁食水,应用FITC-Dextran灌胃(40 mg/100 g),4 h后取血,肝素抗凝,3 500 r/min 离心10 min。取血浆25 μl加入100 μl PBS,用全波长多功能酶标仪测定其荧光强度,激发光波波长为488 nm,发射光波长为525 nm,制作标准曲线并计算样品浓度。
1.4.3ELISA检测血浆内毒素含量 取血,肝素抗凝,4 ℃、3 500 r/min离心10 min,取血浆,采用ELISA检测内毒素含量,严格按照说明书步骤操作。
1.4.4肠道细菌移位检测 CO2吸入麻醉小鼠后,无菌条件下摘取数个肠系膜淋巴结及肝、脾组织,称取相同重量后无菌生理盐水冲洗干净置于无菌组织匀浆器中研磨,加入无菌生理盐水稀释成1 ml的匀浆液。取匀浆液100 μl,接种于麦康凯培养基平板,置于37 ℃恒温箱中培养24 h,并用哥伦比亚血平板进行分离培养,VT2 compact鉴定,后计数不同组内脏器官发生肠道菌移位情况。凡是组织匀浆中培养出3个或3个以上肠道菌落即为阳性。
1.4.5免疫组化检测肠组织紧密连接ZO-1、occludin蛋白的表达 按照免疫组化链霉菌抗生物素蛋白-过氧化物酶法(streptomyces avidin-peroxidase,SP)操作,石蜡切片常规脱蜡、水化;0.01 mol/L柠檬酸钠缓冲液(pH 6.0)溶液98 ℃煮10 min抗原修复,过氧化物酶阻断剂温育10 min,洗涤,滴加一抗(抗ZO-1、occludin抗体稀释度分别为1 ∶400、1 ∶400),4 ℃冰箱孵育过夜,加HRP标记的山羊抗小鼠/兔IgG聚合物二抗,37 ℃孵育20 min,洗涤,DAB显色3 min,复染细胞核,脱水、透明,干燥后中性树胶封片观察。应用Image-Pro-Plus软件进行图像分析,分别测定紧密连接ZO-1、occludin蛋白的累积光密度(integrated optical density,IOD)。
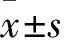
2 结果
2.1 小鼠一般状况及体质量变化正常组小鼠饮食、活动正常,受刺激后反应灵敏,毛发有光泽,体质量持续增加,大便正常。模型组小鼠化疗后第5、6天,饮食及活动减少,受刺激后反应迟钝,体质量明显呈下降趋势,有中度或重度腹泻症状。与模型组比较,AOS中、高剂量组及双歧杆菌组小鼠体质量减少程度降低(P<0.05),腹泻程度也减轻,受刺激反应和活动尚可;低剂量组与模型组相比,体质量变化差异无统计学意义(P>0.05)。见图1。

图1 各组小鼠化疗前后体质量变化
1:正常组;2:模型组;3:AOS低剂量组;4:AOS中剂量组;5:AOS高剂量组;6:双歧杆菌组;与正常组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
2.2 小鼠肠组织肉眼观及光镜观察化疗结束后24 h处死小鼠,取下整个小肠组织,肉眼观察不同组小肠大体标本的变化。正常组小肠可见其肠管色泽鲜嫩,呈淡黄色,弹性良好,无充血、水肿等表现,而模型组小肠肠管呈黑红色改变,弹性差,充血水肿明显;亮菌口服液高剂量组及双歧杆菌组可见肠管损伤明显减轻,肠腔轻、中度水肿,无明显出血,弹性尚可。见图2。

图2 各组小鼠肠组织肉眼观察

图3 各组小鼠肠组织光镜观察 HE×200
HE染色检测空肠组织病理学改变。与正常组相比,模型组有严重的组织损伤,包括绒毛的萎缩,变形或者消失,肠隐窝加深,甚至丢失,炎症细胞的浸润,空泡化和水肿(图3B中a示绒毛的萎缩,水肿,b 大量炎症细胞浸润,c 隐窝结构的丢失)。然而,中剂量组绒毛高度有所恢复,隐窝变浅,炎症细胞浸润减少,高剂量组绒毛高度恢复,隐窝排列整齐,各层结构相对清晰完整。由此提示AOS可缓解5-FU诱导的肠黏膜损伤,尤以中、高剂量组效果明显。另外,双歧杆菌组肠黏膜的损伤也明显缓解。见图3。
2.3 各组小鼠血浆FITC-Dextran浓度及细菌内毒素含量的测定与正常组比较,模型组小鼠血浆中FITC-Dextran的浓度明显增加,内毒素含量也升高(P<0.05);与模型组比较,AOS组FITC-Dextran浓度及内毒素含量下降,且中、高剂量组及双歧杆菌组下降明显(P<0.05),而低剂量组差异无统计学意义(P>0.05)。见表1。

表1 各组小鼠肠黏膜通透性检测指标比较
与正常组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01
2.4 肠道菌群脏器移位率的测定正常组小鼠各脏器并无肠道菌群移位现象,而模型组小鼠内脏器官出现较多细菌移位现象。与模型组比较,给予AOS后,小鼠内脏器官肠道菌移位率显著下降,尤以中、高剂量AOS明显,差异有统计学意义(P<0.05);双歧杆菌组内脏器官移位率也明显下降(P<0.01)。提示AOS缓解肠黏膜炎症可能与减少小鼠肠道细菌移位有关。见表2。

表2 各组小鼠脏器肠道菌群移位情况
与正常组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
2.5 各组小鼠肠组织中ZO-1、occludin蛋白的表达肠道紧密连接蛋白位于相邻细胞顶侧,ZO-1蛋白位于细胞膜内,occludin蛋白位于细胞膜外,胞质内也可见分布,免疫组化染色后阳性表达为棕黄色颗粒沿膜连续分布。与正常组比较,模型组可见棕黄色颗粒染色变浅、减少,成弱阳性,分布不连续,紧密连接蛋白表达明显减少;与模型组比较,AOS组棕黄色颗粒增多,染色增强,沿膜连续分布,ZO-1及occludin蛋白的表达增加。见图4、图5。半定量分析IOD值,模型组蛋白表达明显低于正常组(P<0.01);AOS中、高剂量组与模型组比较,蛋白表达明显增高(P<0.01)。见图6A、6B。

图4 各组小鼠肠组织中ZO-1蛋白的表达 免疫组化×400

图5 各组小鼠肠组织中occludin蛋白的表达 免疫组化×400

图6 各组小鼠肠组织中ZO-1、occludin蛋白的表达
A:ZO-1蛋白阳性表达;B:occludin蛋白阳性表达;1:正常组;2:模型组;3:AOS低剂量组;4:AOS中剂量组;5:AOS高剂量组;6:双歧杆菌组;与正常组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
3 讨论
肠黏膜炎是癌症化疗的常见并发症和剂量限制性毒副作用,但是到目前为止,仍然缺乏有效的治疗策略。越来越多的研究[10]表明,传统中医药能够减轻化疗相关副作用。AOS是从一种真菌-亮菌中分离、纯化,培养后精制而成的中药制剂,其主要成分是亮菌甲素和亮菌多糖,具有解痉、消炎、保肝、降酶、抗肿瘤、免疫调节、促进造血功能恢复等作用[11]。本研究在课题组前期研究基础上,进一步探讨AOS对CIMI的保护作用及可能的作用机制。
化疗诱导的肠黏膜炎作用机制涉及众多环节,其中肠黏膜屏障的破坏,导致功能的缺失,从而使有害物质侵入,也较为关键。机械屏障是肠黏膜重要屏障之一,主要由黏膜表面的粘液层、肠上皮细胞及其紧密连接、黏膜下固有层等组成。而肠上皮紧密连接是肠腔和黏膜之间的电荷和分子大小选择性屏障,在调节肠上皮细胞的通透性方面起重要作用[12]。其主要由咬合蛋白(occludin)、闭合蛋白(claudins)、连接黏附分子、带状闭合蛋白ZO 家族(ZO-1、ZO-2 和ZO-3)及与其相连的细胞骨架蛋白等组成[12]。紧密连接蛋白减少、缺失或移位,肠道通透性增加,可引起化疗性肠黏膜炎、坏死性小肠结肠炎,炎症性肠病[13]等疾病。本研究显示,给予AOS后,肠道紧密连接蛋白ZO-1、occludin的表达较模型组明显升高。FITC-Dextran是一种低分子多聚糖,正常情况下,小鼠体内不含FITC-Dextran且不被小肠吸收,经胃管进入消化道的FITC-Dextran进入血液循环的唯一方式便是破坏肠道屏障的完整性。血浆中的荧光强度愈强,FITC-Dextran的浓度愈高,提示肠黏膜屏障损害越严重。本研究也显示,AOS干预后,血浆中FITC-Dextran浓度降低。这些结果提示,AOS对肠黏膜的机械屏障有保护作用,能降低肠上皮细胞的通透性,缓解肠黏膜的损伤。
肠黏膜的生物屏障主要由正常的肠道菌群构成,正常情况下这些菌群间相互制约,并与宿主之间维持相对稳定。化疗药物作用后,肠道菌群与宿主之间的平衡被打破,肠道中的菌群或细菌代谢产物透过黏膜屏障,转移到肠系膜淋巴结和肠腔外其他器官或部位,这一过程也称为细菌移位[14]。本研究结果显示,给予AOS后,血浆中内毒素含量及菌群移位率明显下降,提示AOS明显改善了化疗后小鼠肠道菌群移位的情况。
综上所述,AOS可能是通过抑制肠道紧密连接蛋白ZO-1、occludin的表达,降低肠道黏膜的通透性,进而抑制细菌及内毒素的移位,缓解化疗后损伤的肠黏膜。然而,有研究[15]表明,化疗药作用后肠道内菌群的结构发生了变化,是否AOS缓解CIMI也与调节肠道菌群的平衡有关,需待进一步研究。

