小窝蛋白-1在肝癌细胞及间质中的表达及意义
陈甜 张烨琼 吴艺锋
原发性肝癌是发病率较高的四大恶性肿瘤之一,具有较高的死亡率和术后复发率。小窝蛋白-1(Cav-1)是细胞膜上的一种支架蛋白,在多种信号途径中起重要调节作用,是机体维持正常生理功能所必需的。研究表明,Cav-1在肿瘤的进展中扮演着重要的角色[1]。Cav-1的表达能够激活肿瘤微环境,与肿瘤相关的成纤维细胞的转化、肿瘤细胞的侵袭和转移能力有关。邱艳等[2]研究发现,Cav-1与肝脏损伤的发生有重要的关联,其在肝脏损伤模型小鼠中的表达显著上升。但就目前而言,Cav-1在肝癌细胞及其间质的表达水平尚不明确。本研究选取80例肝癌及其癌旁组织标本为研究对象,检测其中Cav-1的表达情况,旨在分析其与肝癌临床病理特征及预后的关系。
资料与方法
一、一般资料
80例肝癌及其癌旁组织标本,纳入标准:(1)诊断均符合《原发性肝癌诊疗规范(2011年版)》标准[3],且经病理确诊;(2)行治疗性肝大部切除或部分切除术的原发性肝癌患者,获得活体组织标本;(3)术前均未行任何治疗;⑷均签署知情同意书;排除标准:(1)复发性宫颈癌;(2)合并其他恶性肿瘤;其中男58例,女22例。年龄(58.12±7.85)岁。肝功能A级53例,B级27例。右半肝切除25例,左半肝切除27例,联合两个肝叶切除28例。根据国际抗癌联盟的分类组织学分级Ⅰ级 0 例、Ⅱ级 16例、Ⅲ级 64 例。
二、方法
(一) 免疫组化的方法 将所取得的肝癌及癌旁组织经10%甲醛溶液浸泡后采用石蜡包埋,制作切片,厚度为4 μm。选择相应的试剂盒行免疫组化染色,具体过程为:组织切片经处理后与一抗孵育过夜,磷酸盐(PBS)缓冲液冲洗3次,3 min/次。与生物素标记的羊抗兔IgG孵育30 min。随后与过氧化氢酶标记的链霉亲和素室温孵育15 min,PBS缓冲液冲洗3次,3 min/次。然后DBA(0.02%3,9-氨基联苯胺的Tris-HCl溶液,pH 7.6)中染色5 min,经苏木精复染,无水乙醇脱水,二甲苯透明,封片后在显微镜(高倍镜,×400)下观察Cav-1的表达情况。
(二)阳性结果的判定 以已知阳性肝组织切片作为阳性对照,PBS代替一抗作为阴性对照。以半定量的积分法判断Cav-1的表达情况,由两位病理医师在双盲的情况下进行。分为阴性(0分)、弱阳性(1分)、强阳性(2分)三个等级,其中阴性为不着色,弱阳性为弥漫弱阳性,染色强阳性细胞数≤30%;强阳性为染色强阳性细胞数≥30%[3]。最终结果取两位病理医师的平均数,低表达0~1分,高表达1.5~2分。抗Cav-1购自美国Cambridge公司,DBA试剂盒购自武汉博士德生物制药有限公司,整个免疫组化过程严格按照试剂盒操作说明进行。
三、 统计学处理
采用SPSS 20.0软件。计数资料采用频数表示,组间比较采用卡方检验,Cav-1与各临床病理参数之间的相关性采用spearman相关性检验进行。以P<0.05为差异有统计学意义。
结 果
一、 Cav-1在肝癌细胞、癌旁细胞及其间质中的表达情况
Cav-1在癌旁肝细胞中的表达主要在细胞质,而在肝癌细胞膜和间质均有所表达。Cav-1在间质中的表达主要集中于血管壁。经统计分析发现,Cav-1在肝癌细胞中表达显著高于癌旁组织,在肝癌间质的表达明显低于癌旁间质,差异有统计学意义(P<0.05)。见表1。
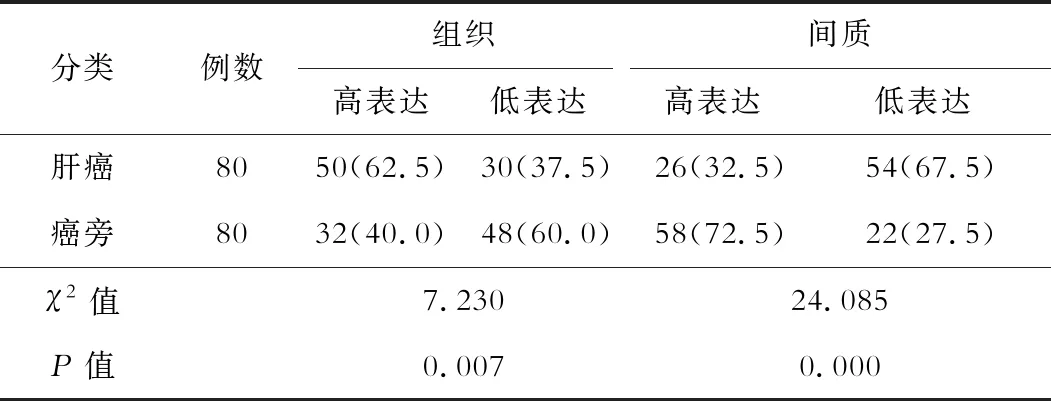
表1 Cav-1在肝癌细胞、癌旁细胞及其间质中的表达情况
二、Cav-1与肝癌实质及间质组织各临床病理参数之间的关系分析
Cav-1在肝癌实质中的表达与肝硬化、周围器官侵犯、血管侵犯、癌栓形成有关(P<0.05)。见表2。Cav-1在肝癌间质中的表达与最大径,是否多发,是否有卫星、周围器官侵犯、血管侵犯、癌栓形成有关(P<0.05)。见表3。
讨 论
小窝(caveolae)是一个直径为50~100 nm的膜结构,主要由细胞膜表面内陷而形成,是各种信号分子和信号通道的“整合器”,是细胞膜生物功能的重要结构基础。小窝(caveolin)是小窝结构形成的重要蛋白,对小窝的形成至关重要,在细胞吞噬、脂类运输和代谢、细胞增殖、分化和凋亡方面有重要的生理功能,与肿瘤的发生、发展和转移密切相关[4]。小窝蛋白被认为是参与恶性转化和恶性发展的关键因子。Cav-1能够维持胆固醇的稳态,在调控细胞信号传导(表皮生长因子受体、C反应蛋白、Src家族酪氨酸激酶)中也有重要作用。Cav-1被认为是抑癌基因或癌基因,其在一些肿瘤如乳腺癌、小细胞型肺癌中呈低表达,而在另一些肿瘤如食管癌[5]、前列腺癌、胰腺癌中呈高表达。

表2 Cav-1在肝癌实质中的表达与各临床病理 参数之间的关系分析
本研究通过检测Cav-1在肝癌及其间质中的表达发现,Cav-1在肝癌细胞中表达显著高于癌旁组织(P<0.05),这与刘振华等[6]研究结果相似。本研究结果显示,Cav-1与肝硬化、周围器官侵犯、血管侵犯、癌栓形成有关(P<0.05)。这提示Cav-1与肝癌的侵袭、转移有关。Cav-1的表达可导致E-钙黏素的减少,蔡晓曼等[7]研究表明,Cav-1可能通过调节E-钙黏素的表达而影响食管癌的转移,这也许可以解释Cav-1 过表达的肝癌细胞迁移和侵袭能力提高。王冰等[8]研究结果显示,原发性肝癌组织中Cav-1蛋白的表达显著低于肝硬化组织。这可能与肝硬化导致肝结构的紊乱,进一步破坏血液循环,引起肝细胞缺血、缺氧有关。本研究还发现,Cav-1与卫星结节虽然无显著相关性,但有正相关趋势。张帅等[9]研究认为,Cav-1能促进肝星形细胞的增殖、迁移来修复肝癌损伤的肝细胞以及促进肝组织再生。本研究未发现显著性差异可能与癌细胞侵入到卫星结节形成之间受到了其他因素的影响。本研究还发现,Cav-1在肝癌间质的表达明显低于癌旁间质(P<0.05)。但Cav-1在间质中的高表达与最大径、是否多发、是否有卫星、周围器官侵犯、血管侵犯、癌栓形成有关(P<0.05)。Cav-1可能与肿瘤血管的形成有关,国外蛋白质组学分析显示,Cav-1—/—的乳腺成纤维细胞可大量分泌促血管生成因子[10]。而本研究发现,Cav-1在间质中的表达主要在血管壁上,其促进肝癌的侵袭、迁移可能在一定程度上与其促进间质血管生成有关。本研究的局限之处在于,Cav-1表达与肿瘤进展之间的关系及分子水平仍未明确,在下一步的研究中将着重进行探讨。

表3 Cav-1在肝癌间质中的表达与各临床病理 参数之间的关系分析

