3.0T场强下的磁共振波谱成像对肝性脑病局部脑代谢改变的评价作用
马文伟 侯海燕 蒋冬 高俊
肝性脑病(HE)为肝硬化的严重并发症,据报道,肝硬化患者中HE发生率达30%~84%[1]。临床主张对HE进行早诊断、早治疗,以防止患者病情恶化。专家发现[2],人体组织在形态结构发生变化之前,必然已经发生了复杂的生化改变。磁共振波谱(magnetic resonance spectroscopy,MRS)可定量分析人体组织代谢,国外报道指出,HE患者的MRS可有效反映患者脑代谢情况[3]。本研究以62例慢性肝硬化患者及30名健康志愿者作为研究对象,探讨3.0 T场强下的MRS对HE局部脑代谢改变的评价作用,现报道如下。
资料与方法
一、临床资料
选择本院2016年1月—2018年7月收治的病毒性肝炎肝硬化患者62例进行前瞻性研究,其中无肝性脑病的失代偿期肝硬化患者(肝硬化组)38例,男性23例、女性15例;年龄34~75岁,平均(50.35±9.89)岁。出现肝性脑病并发症的慢性肝性脑病患者(HE组)24例,男性18例、女性6例;年龄36~73岁,平均(52.40±10.01)岁;临床分期:前驱期5例、昏迷前期13例、昏睡期6例,均处于急性发作期。
诊断标准:(1)失代偿期肝硬化的临床诊断:①有病毒性肝炎感染史;②存在肝功减退和门脉高压;③血清白蛋白下降、血清胆红素升高、凝血酶原时间延长等;④B超或CT提示肝硬化及内镜发现食管胃底静脉曲张。(2)《中国肝性脑病诊治共识意见(2013年,重庆)》[4]中肝性脑病诊断标准:①有严重肝病和(或)广泛门体侧支循环形成;②存在肝性脑病诱因;③肝功能血生化指标明显异常及(或)血氨增高;④存在精神紊乱、昏睡或昏迷等症状;⑤脑电图异常。纳入标准:(1)经临床表现、肝功能试验、血清免疫学检查证实为病毒性肝炎肝硬化;(2)符合失代偿期肝硬化的临床诊断及肝性脑病诊断标准;(3)入组前1周内无发热史、电解质及酸碱平衡紊乱史;(4)MRS的谱线基线较平稳;(5)研究经医院伦理委员会批准和同意。排除标准:(1)伴中枢神经系统原发性病者;(2)伴代谢性疾病、肾脏功能损害等可能影响脑代谢物浓度的疾病者;(3)有酗酒、药物滥用史者;(4)体内有心脏起搏器、铁磁性植入物者。
另从同期健康体检者中选入年龄与性别匹配的30名健康志愿者作为对照组,纳入标准:(1)无肝病病史;(2)无腹部手术史;(3)近期健康体检的肝脏影像学检查显示形态和密度(信号或回声)无异常。其中男性19例、女性11例;年龄32~72岁,平均(49.68±8.48)岁。
二、检查方法
所有患者均行1H-MRS检查,HE患者的波谱采集于急性发作的间歇期。检查仪器为PHILIPS Achieva 3.0 T TX 多源发射磁共振机,8通道头颅表面线圈。检查方法:给患者戴耳塞,固定其头部、定位,采用单体素氢质子波谱点分辨自旋回波波谱序列(SV-PRESS-35),扫描参数:TR/TE=2 000 ms/35 ms,翻转角=90°,平均采集次数128次,扫描时间为4 min 52 s。先行横轴位T2WI-TSE SENSE序列扫描,参数:TR/TE =3 000 ms/80 ms,Nr of Slices:20,Hip angle=90°,FOV:230 mm,SITh/Gap:5 mm/1 mm。以该扫描序列作为MRS检查的定位像,观察脑组织内异常信号影。感兴趣区为正方体,体素大小:15 mm×15 mm×15 mm。定位后先预扫描,完成匀场、发射/接受增益调节,水抑制扫描,使脉冲的半高宽度控制≤11 Hz,水抑制效果>96%。利用磁共振机自带的软件分析脑组织1H-MRS,先进行基线校准与信号平均,后识别代谢物并计算各代谢物波峰曲线下面积。代谢物观察化学位移位置:N-乙酰天门冬氨酸(NAA)为2.01 ppm;碱复合物(Cho)为3.22 ppm;肌醇(mI)为3.22 ppm;肌酐(Cr)波峰包括3.03 ppm和3.93 ppm,本研究仅分析3.03 ppm处的波峰;谷氨酸-谷氨酰胺复合物(Glx)波峰较多,本研究仅分析3.75 ppm处波峰。记录或计算NAA/Cr、Cho/Cr、Glx/Cr和mI/Cr。记录3组患者的颅脑MRI表现,并比较3组脑代谢物峰下面积比值。
三、统计学方法
结 果
一、慢性肝硬化患者的颅脑MRI表现
肝硬化组与HE组患者的脑实质T2WI上均未见明显异常信号,基底节区的苍白球及邻近区域的T1WI上可见双侧对称性高信影,患者多出现不同程度的脑萎缩,以双侧额叶等部位较为常见。
二、对照组1H-MRS表现
对照组脑组织1H-MRS均可清晰显示NAA(2.01 ppm)、Cr、Cho、mI的共振峰及Glx峰。
三、3组脑代谢物峰下面积比值的比较
HE组与肝硬化组的Cho/Cr、mI/Cr均明显高于对照组,差异有统计学意义(P<0.05),但HE组与肝硬化组Cho/Cr、mI/Cr的差异无统计学意义(P>0.05)。HE组Glx/Cr高于肝硬化组与对照组(P<0.05),但肝硬化组与对照组Glx/Cr的差异无统计学意义(P>0.05)。3组NAA/Cr的差异均无统计学意义(P>0.05)。见表1。
讨 论
HE发病机制尚不明确,目前的病理学说主要包括氨中毒学说、神经递质变化学说等[5]。本研究中HE组与肝硬化组的MRS上T2WI未见明显异常,仅可见基底节区苍白球及邻近区域T1加权信号增强,推测与锰的沉积有关[6]。另外还表现为不同程度脑萎缩,多见于双侧额叶,提示单纯MRI检查往往无法发现患者脑部异常。有研究表明,急性期HE患者的头颅MRI可见脑水肿[7],由于本研究为急性发作的间歇期进行检查,故患者均未见脑水肿。
MRS属于磁共振新技术,利用氢质子磁共振频率在不同化合物中的差异及共振峰的峰高和面积反映化合物浓度,反映组织、细胞代谢情况。本研究中HE组与肝硬化组的Cho/Cr、mI/Cr均高于对照组,HE组Glx/Cr高于肝硬化组与对照组,提示肝硬化患者的波谱图像上Cho峰与mI峰降低,降低Glx峰升高,这一结果与HE的氨中毒学说相呼应。HE患者随着肝功能受损,对氨的代谢能力减弱,大量氨堆积于血液中,血氨浓度升高,破坏血脑屏障后进入脑组织,并在星形细胞中合成谷氨酰胺,故Glx峰升高。与此同时,谷氨酰胺的产生使星形细胞内渗透压升高,细胞通过排出mI与Cho等渗透剂的途径进行代偿,调节细胞内渗透压[9],在MRS上反映为mI和Cho降低。本研究中,但HE组与肝硬化组Cho与mI的差异无统计学意义,mI和Cho的降低幅度不明显,推测与细胞还可通过排出牛磺酸等其他渗透剂调节渗透压有关,推测随着HE患者病情的加重,这种差异会愈加明显。
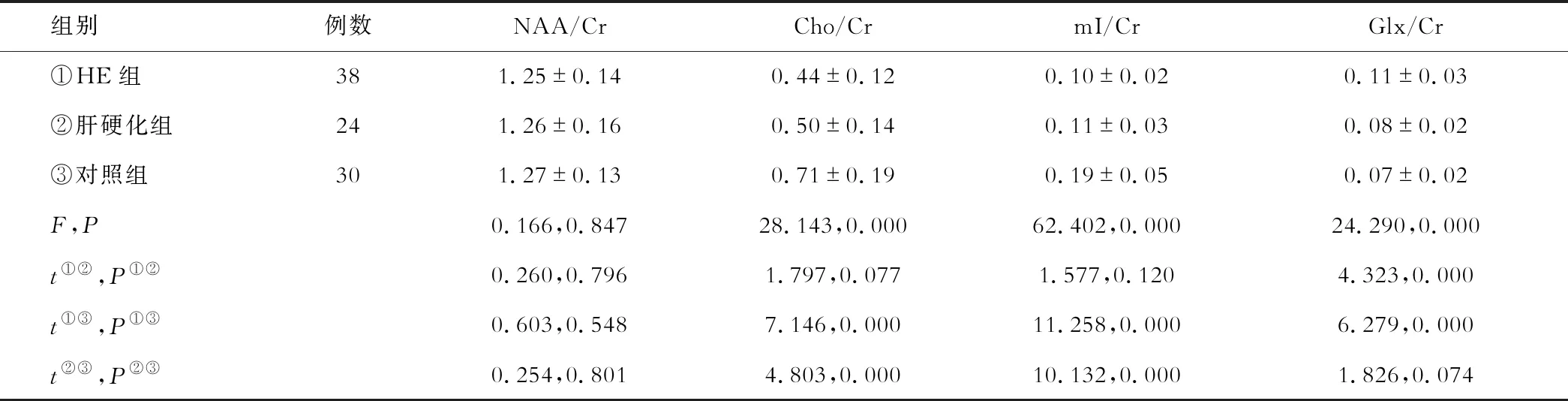
表1 各组患者代谢产物峰下面积比值的比较
综上所述,肝硬化与HE患者均存在脑代谢异常,证实脑代谢改变早于HE症状,且Glx峰的升高可较准确地预示HE的出现。

