自身免疫性肝病患者合并非酒精性脂肪性肝病的临床及病理特征
曹俊英 卢君瑶 白玉盘 袁小凌 包玉洁 许洁
非酒精性脂肪性肝病(NAFLD)是一种发病率和死亡率高的疾病之一[1]。鉴于NAFLD发病率的不断上升,可能会叠加于其他慢性肝病之上,如自身免疫性肝炎和重叠综合征[2],报道称这种叠加在全球发病率达1.8%~3.6%[3]。本文回顾性观察了经临床和病理确诊的 AIH以及AIH重叠PBC共67例患者的肝组织切片,就合并肝脂肪变性患者的临床及病理特点进行探讨。
资料与方法
一、资料
2006年至2018年就诊于上海交通大学医学院附属第九人民医院感染科,确诊为AIH以及AIH重叠PBC的患者。排除其他慢性肝病(病毒性肝炎,女性饮酒>20 g/d,男性饮酒>30 g/d),肝脂肪变性依据肝组织学。最终67例受试者的临床及病理学数据被用于分析。基本分布如下:男性12例,女性55例,年龄30~78岁,平均年龄54.22岁。合并肝脂肪变性患者14例(13例AIH,1例AIH重叠PBC),不伴肝脂肪变性的患者53例(34例AIH,19例AIH重叠PBC)。
二、方法
收集全部病例的肝脏穿刺报告,记录每例患者的性别、年龄、住院号、穿刺日期,并以此追溯患者肝穿前1周的生化结果(谷丙转氨酶、谷草转氨酶、γ-谷氨酰转肽酶、碱性磷酸酶、甘油三酯)。肝组织脂肪变性程度以光镜下每单位面积脂肪变性细胞所占比例划分为4个级别:<5%;5%~33%;33%~66%;>66%。肝组织脂肪变性类型分小泡性及大泡性。提示自身免疫性肝炎的特征包括明显的界面性性肝炎,门脉及门脉周围区域有中度至重度淋巴浆细胞浸润,明显的桥接性坏死或融合性坏死伴严重的淋巴浆细胞炎性改变。肝脏组织病理学检查以明确存在小叶炎症、气球样变、门脉纤维化、界面性肝炎、浆细胞浸润和胆管损伤。排除单纯PBC及原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)。
三、统计学分析
数据均输入电脑,用 SPSS 21软件计算均值、标准差,并进行t检验,多组间均数比较采用方差分析(ANOVA),多个样本率的比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
一、肝脂肪变性的程度与类型的关系
14例肝组织并发脂肪变性,发生率为20.9 %(14/67);其中轻、中、重度分别为 7、4及 3例,构成比分别为50%、28.6%及21.4%。肝脂肪变性小泡性、大泡性分别为 10及4例,构成比分别为71.4% 及28.6%。肝脂肪变性程度愈轻,小泡性脂肪变愈明显。
二、肝脂肪变性与肝组织病变程度的关系
肝脂肪变性与肝组织炎症坏死分级的关系:Knodell HAI计分分别为2.86±0.363、2.79±0.532,无显著差异(F=3.448,P>0.05);见表1。
肝脂肪变性与纤维化分期的关系:Knodell HAI计分分别为2.86±1.027、2.36±0.922,无显著差异(F=0.689,P>0.05)。见表1。
三、肝脂肪变性与年龄、性别的关系
无肝脂肪变性患者发病年龄:(54.11±9.98)岁,女性占比为88.7%;有肝脂肪变性患者发病年龄:(54.64±13.72)岁,女性占比为57.1%;两者均有显著差异(P<0.05)。见表1。
四、肝脂肪变性与肝酶水平的关系
无肝脂肪变性者谷丙转氨酶、谷草转氨酶、γ-谷氨酰转肽酶、碱性磷酸酶水平分别是:(434.89±420.557)、(307.17±289.23)、(290.77±320.35)、(284.17±282.00) U/L;有肝脂肪变性者谷丙转氨酶、谷草转氨酶、γ-谷氨酰转肽酶、碱性磷酸酶水平分别是(622.29±508.48)、(427.50±374.30)、(210.50±128.57)、(138.50±65.99) U/L;其中碱性磷酸酶水平有统计学意义(P<0.05)。(表1)
五、肝脂肪变性与甘油三酯水平的关系
无肝脂肪变性者甘油三酯:2.32±1.18 mmol/L;有肝脂肪变性者甘油三酯:2.51±1.57 mmol/L。两者无统计学意义(见表1)。
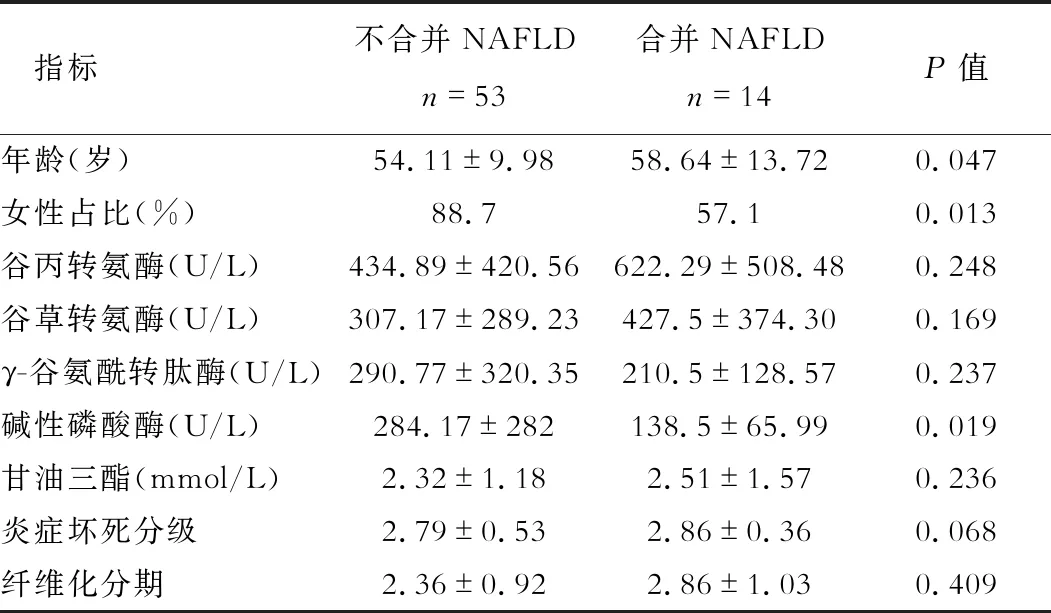
表1 AIH及AIH重叠PBC患者合并NAFLD与 不合并NAFLD的临床病理特征比较
讨 论
本研究发现,合并有非酒精性脂肪肝的AIH及重叠综合征的患者与不伴有非酒精性脂肪肝者相比,女性所占比例较低,年龄较大。诊断年龄较大可由几个因素来解释:首先,对于非酒精性脂肪肝的女性患者,诊断AIH比较困难,因为一些非酒精性脂肪肝患者的抗核抗体呈阳性,而这些女性患者往往满足AIH的诊断标准[4]。此外,AIH和NAFLD在女性中的分布均为单峰,此单峰出现在她们六十几岁时[5-6],AIH的诊断可能延迟,因为医生将AIH合并NAFLD的患者视为只有NAFLD。其次,NAFLD可通过生活方式或激素变化在AIH发病后发生。抗核抗体阳性的NAFLD患者年龄较大,且以女性为主[2,7]。这些因素可能支持上述AIH合并NAFLD的患者较不合并NAFLD的患者较低的女性比例、较大的年龄的观察结果。
肝脂肪变性作为共同致病因子可以对受其他疾病影响的肝脏产生影响。在本研究中,两组患者的肝酶(谷丙转氨酶/谷草转氨酶/γ-谷氨酰转肽酶)水平无明显差异,仅碱性磷酸酶在AIH合并NAFLD组中显示较低水平。在肝病理学方面,两组并未发现显著的炎症活动度和纤维化程度差异。NAFLD中的轻度肝脂肪变性患者,脂肪变的类型以小泡性为主;随脂肪变性程度的加重,大泡性脂肪变明显增强。然而,肝组织脂肪变性与肝组织炎症活动度及纤维化进程并无明显相关关系。NAFLD患者没有具有足够特异性的症状及体征,尚且缺乏替代性的血清标志物,本研究的两组间甘油三酯水平也未显示明显差异,由于本研究病例数不够多,目前尚不清楚这一观察结果是否反映了AIH合并NAFLD性质,或许仅仅是诊断时的阶段表现,由于无法根据生化指标判定是否需要干预,肝脏活检可以帮助确诊。值得注意的是在治疗AIH合并NAFLD患者的过程中,类固醇可以改善AIH相关炎症,却可能会同时恶化脂肪变性,所以决定是否启动皮质类固醇治疗非常重要,如何平衡及监测也是下一步要研究的内容。报道显示[6],抗核抗体高滴度的人群如果合并NAFLD,疾病进展的风险将升高,所以建议对这类人群进行肝组织活检以做出最后诊断和决定是否开始类固醇治疗。
本研究为单中心的回顾性研究,缺少体质指数、腰围等信息,病例数较少,仅仅是对于AIH及AIH重叠PBC的病人肝组织脂肪变性的回顾性调查。我国NAFLD发病率快速上升的同时,由于检测水平和认识的提高,自身免疫性肝病人数也不断增加。而在AIH的治疗中需要涉及激素问题,激素的应用可能会恶化脂肪变性。目前关于这方面研究较少,对于药物的治疗也有争议,我们的研究仅仅是初步地分析了部分AIH合并NAFLD患者的临床及病理特征,仍然需要进一步开展更有意义的研究,希望将来可以收集更多的病例进行研究使病人获益。

