氯化钙-氨水体系生产纳米碳酸钙的复合碳化机理研究
颜 鑫 ,卢云峰 ,马媛媛 ,谢 龙
(1.湖南化工职业技术学院化工系,湖南株洲412004;2.石家庄科林威尔环保科技有限公司;3.连州市凯恩斯纳米材料有限公司)
石灰石资源虽多,却是一种不可再生的资源,随着国家对碳酸钙矿山开采的要求越来越严格,对三废处理、环境保护的要求越来越高,近年来大量碳酸钙生产企业被迫关闭,造成近一年来中国碳酸钙市场出现供不应求的局面。以电石渣等工业废渣为原料生产轻质碳酸钙成为迫切而现实的需求。以电石渣为原料生产轻质(纳米)碳酸钙过程中,首先需要将电石渣用氯化铵溶液进行浸取反应,然后过滤洗涤,制得氯化钙-氨水溶液;最后用二氧化碳进行碳化反应以制得轻质(纳米)碳酸钙[1]。氯化钙-氨水体系不同于石灰乳体系,二者的碳化过程和机理也不同。因此,对氯化钙-氨水体系的碳化过程和机理进行深入研究具有现实意义。
1 实验部分
1.1 实验原料
主要原料:电石渣,呈干燥粉末状;氯化铵、碳酸氢铵,均为分析纯;二氧化碳为工业钢瓶气体。
1.2 实验过程
实验装置为中试装置[2],工艺流程示意图见图1。

图1 中试装置工艺流程示意图
在电石渣生产轻质碳酸钙的中试装置中,浸取釜中电石渣的投料均为4 kg,加水量为50 L,充分搅拌后,系统溶液的pH约为12.5;第一次氯化铵的投料量为6 kg,反应时间为120 min,浸取反应结束后,体系的pH约为10.4。第二、三、四次循环时,电石渣的投料量均为4 kg,每次补充的氯化铵为0.5 kg。二氧化碳体积分数为99%,反应温度控制在15~30℃,碳化反应时间为30~40 min,反应终点的pH为8.0。第一次、第二次碳化为单纯的二氧化碳碳化,第三次、第四次碳化为碳酸氢铵+二氧化碳的复合碳化,其中第三次、第四次碳酸氢铵用量分别占碳化总量的10%、20%。
1.3 材料分析表征
用Quanta200型扫描电子显微镜表征样品颗粒形貌;用激光粒度仪(LS-608)表征粒子的分布情况;用酸度计(PHS-3C)跟踪碳化过程。
2 结果与讨论
2.1 单纯的二氧化碳碳化产品表征
氯化钙-氨水体系采用二氧化碳作为碳化剂,且碳化反应中不添加任何分散剂,也不进行表面改性处理时,所得产品SEM照片见图2。由图2可见,产品呈立方型,且团聚现象严重。图2a中单个粒子的粒径达11.8 μm,图2b中的团聚体由数十个立方单体构成,表面存在明显的凹陷,图2c中的每个团聚体几乎都存在明显的凹陷。

图2 CO2碳化过程产品SEM照片
由于碳化体系中没有添加任何晶形导向剂,凹陷应该归咎于体系中固有的NH4+或Cl-的离子氛对碳酸钙结晶诱导的影响,根据碳酸钙微晶表面存在大量羟基,而羟基易于吸附NH4+,因而可以推定为NH4+离子氛的影响是造成团聚表面形成凹陷的重要原因。c(NH4+)在碳化过程中有一个自始至终逐渐增大的过程,可以认为NH4+离子氛的影响也是逐渐增大的,即在碳化初期对单个碳酸钙粒子的形成影响很小,碳化末期由于c(NH4+)增大,对碳酸钙团聚体的影响将明显增大。单纯的CO2碳化产品的激光粒度分析结果如图3所示。

图3 CO2碳化过程产品粒度分布情况
由图3可知,单纯的CO2碳化过程粒度分布较宽,D50达到了27.61 μm,团聚现象非常严重,平均粒径已大于普通轻质碳酸钙的平均粒径,这与SEM结果一致。
2.2 氯化钙-氨水体系的碳化机理分析
2.2.1 氯化钙-氨水体系单纯CO2碳化机理
电石渣与一定比例的清水配成浆液,然后加入可溶性铵盐进行浸取反应,反应的离子方程式如下:

氯化钙-氨水体系完全不同于石灰乳体系,二者的碳化过程也完全不同。氯化钙-氨水溶液体系中,存在大量游离的Ca2+,而石灰乳体系中石灰乳属于微溶物质,存在一个石灰乳粒子的缓慢溶解过程,c(Ca2+)很小。因此,看起来氯化钙-氨水体系的碳化过程应该更加快速,更加有利于碳酸钙粒子的超细化。但事实不然,在碳化气浓度和流量、钙原子总浓度和碳化温度一定的前提下,氯化钙-氨水体系的碳化反应表现得很慢,其碳酸钙粒子甚至要大于普遍的轻质碳酸钙粒子,如图2所示。其原因如下:氯化钙-氨水体系的pH仅为10.4左右,明显小于石灰乳体系的 pH(12.5 左右),即相当于前者c(OH-)仅为后者c(OH-)的1%。弱酸性CO2必须首先与弱碱性氨水反应生成HCO3-,其反应速度远小于与强碱性的石灰乳体系的反应速度,不利于碳化初期形成大量晶核,不利于碳酸钙粒子的超细化。
氯化钙-氨水体系单纯CO2碳化机理如下:

反应(2)属于二氧化碳从气相主体向液相主体进行相变的过程,气液相之间的相界面阻力较大,同时受到二氧化碳浓度和压力的影响,相变过程相对缓慢;反应(3)是弱酸与弱碱之间的反应,反应速度也不快[1,3]。 所以,单纯 CO2碳化过程速度慢、时间长、产品粒子粗,反应中前期反应(2)是控制步骤。由于反应(1)、(2)、(3)每一步反应都不快,碳化反应初期不可能形成大量 CO32-,虽然c(Ca2+)较高,却不可能生成大量碳酸钙晶核,从而不利于碳酸钙粒子的超细化[1,3],如果 不添 加分 散剂 或采 取其 他手段的话,是不可能生产出纳米级轻质碳酸钙产品的。无论是实验研究还是实际生产中,CO2浓度高或数量充裕,在碳化反应末期,体系pH都逐渐减小,氨水浓度逐渐降低,因此,碳化末期(1)式成为氯化钙-氨水体系单纯CO2碳化过程的控制步骤。
可见,氯化钙-氨水体系单纯CO2碳化过程整个反应过程的阻力主要是二氧化碳气体通过气液液膜的扩散阻力和弱电解质氨水的电离反应,过程的控制步骤取决于两种阻力的相对大小。在碳化反应中前期,氨水浓度相对较大,电离常数(Kb=1.8×10-5)也相对较大,而碳酸的电离常数(Ka1=4.2×10-7)较小,因此,氨水电离相对较快,(2)式为控制步骤。由于实验过程或生产过程中二氧化碳浓度高、数量充裕,且氨具有易挥发性,在循环体系中难以满足氨平衡,因此,氨属于关键少数,(3)、(4)式都必须依靠(1)式产生的OH-,总体来说(1)式属于整个碳化体系的关键步骤和控制步骤。
氯化钙-氨水体系的CO2碳化过程pH和温度变化曲线见图4。

图4 氯化钙-氨水体系CO2碳化过程pH和温度变化曲线
2.2.2 氯化钙-氨水体系中碳酸氢铵+CO2复合碳化机理
氯化钙-氨水体系的复合碳化过程如下:首先加入一定量的碳酸氢铵进行复化学碳化反应,碳酸氢铵作为易溶强电解质瞬间产生了大量HCO3-,使反应(4)显著加快,加上c(Ca2+)大,可短时间内形成大量碳酸钙晶核,然后再通入CO2进行碳化反应。
第一步复化学碳化:当碳化初期加入一定数量的碳酸氢铵时,与氯化钙形成复化学反应,在瞬间形成大量晶核;如果碳酸氢铵是以固体形式加入碳化体系,则碳酸氢铵存在一个溶解过程,碳化反应速度和碳酸钙粒子超细化都会受到明显影响;反之,如果碳酸氢铵事先进行溶解、以饱和溶液形式加入碳化塔,那么第一步复化学碳化速度将会很快、时间很短且超细化的效果也会更好。同时,如果加入的碳酸氢铵是农用碳酸氢铵的话,一般都含有少量不溶性杂质,先溶解、过滤,得到饱和溶液再加入体系是很有必要的。
第二步CO2碳化:第一步碳化结束后马上通入CO2继续进行碳化反应,形成复合碳化反应。与单纯CO2碳化过程不同的是,碳酸氢铵快速电离瞬间产生了大量HCO3-,使反应(4)显著加快,瞬间消耗掉了体系中绝大部分OH-,使体系pH短时间内下降很快,从而间接影响到反应(1)、(2)、(3)。 与单纯CO2碳化过程相同的是,循环体系中氨属于关键少数,难以满足氨平衡,氨的电离反应属于控制步骤,由于第二步CO2碳化阶段时间长得多,因此,氨的电离反应也是整个复合碳化过程的控制步骤。
复合碳化产品的激光粒度分析结果如图5所示。由图5可见,复合碳化过程产品粒度分布窄,D50仅有340 nm,已经达到亚纳米级,团聚现象不明显。复合碳化过程pH和温度变化曲线如图6所示。图6与图4对比可知,复合碳化过程pH曲线更陡一些,碳化时间缩短20%,碳化终温也有所降低。值得注意的是,复合碳化初期加入碳酸氢铵既有利于碳酸钙粒子超细化,又是一个对铵根的补充,实际生产中只需加入少量石灰乳就能得到较多的游离氨,可代替添加氨水来满足氯化钙-氨水体系氨平衡的需要。
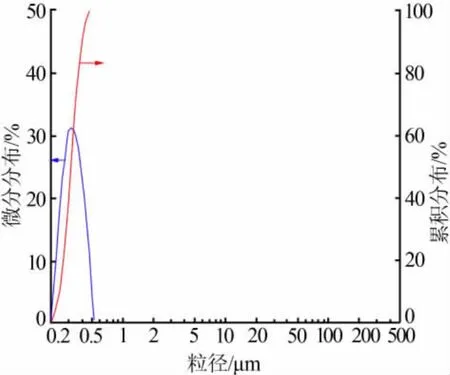
图5 复合碳化过程产品粒度分布情况

图6 氯化钙-氨水体系复合碳化过程pH和温度变化曲线
3 结束语
1)氯化钙-氨水体系单纯CO2碳化过程时间长、速度慢、粒子粗、团聚严重,其根源是氯化钙-氨水体系pH低,吸收CO2反应速度慢,碳化初期不可能形成大量碳酸钙晶核,因而不利于粒子超细化。而复合碳化过程则相反,其根源在于碳酸氢铵的复化学碳化能够在短时间内形成大量碳酸钙晶核,有利于粒子超细化。2)提出了氯化钙-氨水体系的单纯CO2碳化反应机理,循环体系中氨属于关键少数,难以满足氨平衡,整体来说氨的电离反应属于整个单纯CO2碳化体系的关键步骤和控制步骤。3)总结了复合碳化过程的化学反应机理,第一步碳酸氢铵的复化学碳化阶段,氨的电离反应是慢速反应和控制步骤。第二步 CO2碳化阶段,前期 CO2的溶解相变过程是控制步骤,而中后期氨的电离反应是控制步骤;由于第二步CO2碳化阶段时间长得多,整体来说氨的电离反应也是整个复合碳化过程的控制步骤。

