大鼠自发性及药物相关性胰岛纤维化研究进展
周 飞, 王浩安
(1.四川大学华西医院 国家成都新药安全性评价中心, 成都 610041;2. 成都华西海圻医药科技有限公司,成都 610041)
胰腺为大鼠重要的消化和内分泌器官, 由外分泌部和内分泌部构成。胰腺外分泌部主要分泌消化酶, 参与机体对食物的消化; 内分泌部由具有内分泌功能的细胞组成胰岛,胰岛细胞分泌的激素对葡萄糖的代谢具有重要作用[1,2]。然而随着年龄的增长,大鼠胰岛发生β细胞增生、胰岛纤维化、肿瘤等自发性病变的发生率逐渐增高[3]。在毒性病理实际工作中,胰岛纤维化虽然是大鼠中较为常见的自发性疾病,但许多药物也能引起或加重此改变[4-7]。关于大鼠胰岛β细胞增生及一些肿瘤性病变于国内外均可见报道,但自发性胰岛纤维化国外仅有少量报道,而国内未见有相应报道。故本综述就关于大鼠自发性及药物相关性的胰岛纤维化进行了归纳及总结,为实验动物研究、药物研发及药物安全性评价提供参考。
1 胰岛纤维化的病理学改变
胰岛纤维化的镜下改变可分为胰岛毛细血管扩张、出血和炎症、色素沉着和纤维化4种典型病理学改变[3-12]。胰岛毛细血管的扩张是病程的起始阶段胰岛出血、炎症、色素沉着为病理进程的发展阶段, 纤维化是病理进程后期阶段。出血表现为胰岛中心或周边可见红细胞漏出血管并伴有色素沉着或/和吞噬有色素的巨噬细胞浸润[10-13]。透射电子显微镜观察可见出血的胰岛毛细血管周边有迁移出并吞噬有红细胞的巨噬细胞,大量成熟的胶原纤维包裹血管, 毛细血管内皮未见明显改变。色素为含铁血黄素, Perl's blue特殊染色为阳性, 部分胰岛中可见色素沉着但未见出血。偶可见胰岛中或周边炎细胞浸润及水肿等进行性反应。纤维化的胰岛体积增大,胰岛被增生的纤维结缔组织分隔成多个细胞小团, 镜下表现为细胞团块像岛屿样漂浮于纤维组织中, 即所谓的漂浮现象。胰岛的上述病理改变在胰腺3个区域(头、体、尾)的分布上未见差异[10]。
2 大鼠自发性胰岛纤维化
2.1 病变分布谱
胰岛纤维化可见于多种啮齿类动物中。Homo-Delarchei等[8]在4月龄的糖尿病非肥胖Goto-Kakizaki(GK) 大鼠中描述了“大胰岛”的存在,这些“大胰岛”的内分泌细胞被纤维组织破坏。自发性糖尿病Torii大鼠(SDT)在疾病的发生过程中, 胰岛内或胰岛周围同样会出现纤维化并伴有炎症[9]。Hayden等[10]在Ren2高血压转基因大鼠中发现存在胰岛早期纤维化的超微病理学改变。毒理学试验中, 老龄SD大鼠也可见局限于胰岛且对周围腺泡组织影响较小的出血、纤维化和增生的自发性改变[4]。
Imaoka等[11]研究表明,大鼠胰岛毛细血管扩张最早可见于8周龄,而胰岛出血、色素沉着和纤维化最早可在12周龄中出现。Dillberger[3]报道,3.5月龄雄性SD大鼠胰岛纤维化的发生率为20%。然而,也有报道[14]显示在102周龄时,SD大鼠胰岛部分纤维组织被重新吸收,从而使纤维化的发病率降低。Imaoka等[11]应用线性回归算出以上病理改变的发生率与时间的关系方程式,详见表1。
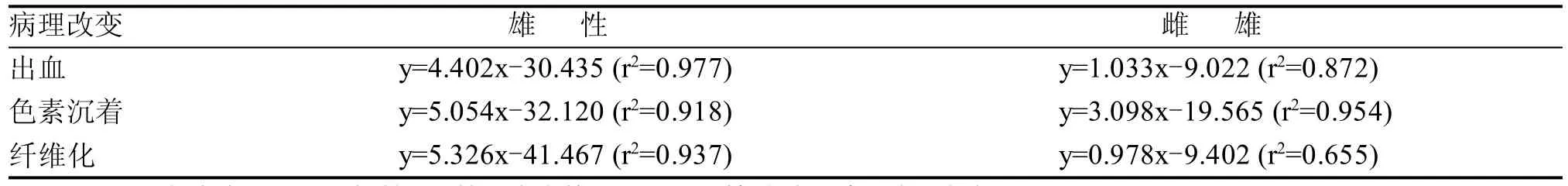
表1 SD大鼠胰岛纤维化病变发生率与时间的关系方程式
2.2 病变的性别差异性
大鼠自发性胰岛纤维化在各报道中均为雄性发生率及严重程度高于雌性[11-15]。Dillberger[3]报道,14月龄的雄性SD大鼠, 其胰岛纤维化的发生率可高达90%; 而雌性SD大鼠在14月龄时, 发生率仅为20%。有研究[16]认为胰岛纤维化雌雄差异性是由于雌雄动物新陈代谢不同所致,因雄性大鼠体质量增长快于雌性大鼠,故雄性大鼠的新陈代谢较雌性旺盛, 从而对供血量及氧的消耗多于雌性,雄性大鼠胰岛因血氧供应问题而产生纤维化。报道[17,18]显示雌激素具有血管内皮保护作用,故Imaoka等[11]认为,老龄雄性大鼠较低的血清雌二醇水平意味着缺乏血管保护功能,从而引起红细胞漏出胰岛毛细血管(即微出血),进而引起一系列炎性改变,最终导致胰岛纤维化。Hajdu等[7]给予阉割的SD大鼠雌激素,可减少胰岛体积增大和纤维化的发生率。Shinohara等[19]研究表明,当对自发性糖尿病大鼠做卵巢切除术后,胰岛内及周边炎细胞浸润,色素沉着及纤维化等病理改变的发生率要高于假手术组,而这种现象可以通过注射雌激素得以缓解。Imaoka等[15]进一步研究表明,皮下注射β-雌二醇3-苯甲酸酯(EB)26周能够抑制雄性大鼠胰岛炎症的发生、降低纤维化的发生率, 但不能够抑制各年龄段大鼠胰岛出血的病变。所以他们认为细胞核内的雌激素受体信号通路可能并没有直接参与对胰岛炎症/纤维化的抑制过程,而EB的作用可能是抑制肌成纤维细胞的出现,从而抑制胰岛纤维化[14]。
3 药物相关性胰岛纤维化
Kaduk等[20]通过脂肪乳溶解的Busulfan(Myleran®, Busulfex)®(白消安,马利兰®,一种烷基化抗肿瘤药)饲喂雄性Wistar大鼠,见大鼠胰岛周边出血及纤维化。推测可能为Busulfan沉积于毛细血管周细胞中导致胰岛内及周边的有孔毛细血管损伤加重。而持续性毛细血管损伤引起出血,最终导致胰岛纤维化,萎缩及高血糖症。但该药在人身上已使用多年,未见像大鼠胰岛毒性的报道。
大鼠静脉注射给予凝血因子Xa抑制剂Rivaroxaban(利伐沙班)后,在有效剂量范围内除导致机体低凝状态异常引发多处器官出血外,还见胰岛周边出血、炎症、纤维化以及含铁血黄素沉着的病理学改变[21]。
脾酪氨酸激酶(Spleen tyrosine kinase, Syk)是一种非受体类酪氨酸激酶,是包含有免疫受体酪氨酸激活基序的免疫受体的一种重要下游信号酶。在对脾酪氨酸激酶抑制剂的研究中,Long等[22]对SD大鼠、CD-1小鼠、Beagle犬和食蟹猴分别经口灌胃给予一种脾酪氨酸激酶抑制剂,表明该抑制剂可引起SD大鼠胰岛周边出血及纤维素沉积。而其余种属的实验动物均未见该病理学改变。引起SD大鼠胰岛出现上述病变的原因可能是脾酪氨酸激酶抑制剂破坏了胰岛处血小板-内皮细胞的稳态。
Bruton's络氨酸激酶(Btk)是有关于B细胞和骨髓细胞信号转导通路中的关键激酶。Erickson等[23]通过经口灌胃给予SD、Wistar和F344大鼠以及Beagle犬包括Ibrutinib和Spebrutinib在内的多种Bruton's络氨酸激酶抑制剂后,3个品系的大鼠均出现胰岛出血、色素沉着和胰岛纤维化的改变,但SD大鼠最为敏感,而在Beagle犬中未见胰岛出现类似改变。作者推测该病理学改变是由于大鼠的胰岛微血管受损所致。
Brenneman等[4]分享了一系列其公司未上市的受试物对大鼠胰岛损伤的毒性机制,病变主要发生在胰岛周围的内外分泌部交界处(endocrine-exocrine interface, EEI)。由这些受试物诱导的胰岛纤维化未见性别差异性。胰岛素产生和/或释放的改变可能继发于胰岛的损伤。病变表现为轻微受损的胰岛周围出现充有血液的扩张间隙,然后混合性炎细胞浸润、血浆渗出、出血以及纤维素沉着使得内外分泌部交界处的边界消失。更长期受影响的胰岛则出现纤维化以及偶见的含有含铁血黄素的巨噬细胞。他们认为可能是受试物增加了胰岛部位的血流,加之大鼠胰岛EEI血管为薄壁有孔毛细血管,这些血管更加容易受损或漏出血液成分。
4 结语
综上所述, 无论是自发性还是药物相关性的胰岛纤维化均与胰岛血管损伤有关。老龄大鼠胰岛血管受损而导致自发性胰岛纤维化的具体机理至今未见定论[11]。药物相关性的大鼠胰岛纤维化在其他种属相应的药物研究试验中均未见相应胰岛改变,可能原因为种属间胰岛解剖结构的差异性所致: 多数哺乳动物中,胰腺的主要血液流向为供应胰岛的血液出胰岛后通过腺泡门脉系统扩散到周边外分泌部; 然而在大鼠中, 供应外分泌部和胰岛的血管为两条不同的血管, 最终于胰岛周边的腺泡门脉系统汇合[4,24]。大鼠胰岛采用分支血管独立供血的体系可能是导致高新陈代谢胰岛的有孔毛细血管更易受损的原因。故在大鼠毒理学试验中,若胰岛纤维化为药物相关性改变,其在犬、猴等的毒理学试验及药物临床研究中可能不会出现,这对于药物的毒性研究及风险评估具有重要意义。
大鼠自发性胰岛纤维化与年龄相关, 以老龄大鼠多见, 发生率可参考Imaoka等[11]的线性回归方程,且存在性别差异性,即主要以雄性多见。而药物相关性的胰岛纤维化不具有年龄相关性,于各年龄段可见,且不具有性别差异性。再者, 药物及其代谢产物是否对血管有影响也可用于判定大鼠胰岛纤维化为自发性或药物相关性的一个提示性指标。

