尼莫地平联合注射用鼠神经生长因子对脑出血患者脑水肿带体积、神经功能及血清炎性因子水平的影响
王金梅,刘佳,石富铭
脑出血指非创伤性脑实质自发性出血,是临床常见脑血管疾病之一,占所有脑血管疾病的25%~35%[1]。脑出血具有发病急、病情进展迅速、致死率高等特点,近年来随着我国人口老龄化进程加剧,脑出血患者数量不断增多[2]。脑出血的致病原因多种多样,其中高血压所致脑小动脉破裂是导致脑出血的主要原因。近年研究表明,脑出血可导致细胞因子、自由基及炎性递质释放增多,继而引发脑水肿及神经功能恶化,因此在脑出血的治疗过程中需注意控制脑水肿并保护神经功能[3]。本研究旨在探讨尼莫地平联合注射用鼠神经生长因子对脑出血患者脑水肿带体积、神经功能及血清炎性因子水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2017年3月—2018年3月北京市大兴区人民医院收治的脑出血患者120例,采用随机数字表法分为对照组和研究组,每组60例。对照组患者中男33例,女27例;年龄61~76岁,平均年龄(69.1±1.2)岁;出血部位:基底核区39例,脑叶8例,脑桥6例,小脑5例,脑室1例,内囊1例。研究组患者中男36例,女24例;年龄60~77岁,平均年龄(69.5±1.5)岁;出血部位:基底核区41例,脑叶7例,脑桥5例,小脑4例,脑室2例,内囊1例。两组患者性别(χ2=0.307,P=0.579)、年龄(t=1.378,P=0.170)、出血部位(χ2=0.652,P=0.986)比较,差异无统计学意义,具有可比性。本研究经北京市大兴区人民医院医学伦理委员会审核批准,所有患者对本研究知情同意。
1.2 纳入与排除标准 纳入标准:(1)首次发病;(2)符合《中国脑出血诊治指南(2014)》[4]中的脑出血诊断标准:急性起病并伴有局灶神经功能缺损症状(少数为全面神经功能缺损症状),常伴有头痛、呕吐、血压升高等,并经颅脑CT检查证实存在出血灶、排除非血管性脑部病因;(3)成年人、生命体征平稳。排除标准:(1)并发脑疝而需行开颅手术治疗者;(2)出血量>30 ml者;(3)伴有严重心、肺等器官功能障碍者;(4)对本研究所用药物过敏者;(5)收缩压>220 mm Hg(1 mm Hg=0.133 kPa)或舒张压>130 mm Hg者;(6)伴有脑肿瘤或血管畸形者。
1.3 治疗方法 对照组患者给予常规治疗,包括绝对卧床休养、吸氧、控制血糖及血压等,同时给予20%甘露醇(石家庄市鹿泉制药厂生产,生产批号:130207)125~250 ml静脉滴注以降低颅内血压。研究组患者在常规治疗基础上给予尼莫地平联合注射用鼠神经生长因子治疗,其中尼莫地平(拜尔医药保健有限公司生产,生产批号:20133010)10 mg/次,1次/d,静脉滴注,连续治疗14 d;注射用鼠神经生长因子(未名生物医药有限公司生产,生产批号:20130222)18 μg/次,1次/d,肌肉注射,连续治疗28 d。
1.4 观察指标
1.4.1 脑水肿带体积 脑出血病灶由出血灶和出血灶周围水肿带组成,脑出血病灶体积(ml)=病灶最大层面长×宽×层间距×病灶层数×0.5(cm3),出血灶体积(ml)=出血最大层面长×宽×层间距×出血灶层数×0.5(cm3),脑出血病灶体积-出血灶体积即为脑水肿带体积。本研究所用仪器为美国GE公司多层螺旋CT扫描仪,检查时采用常规平扫,层厚、层中心距均为 5 mm。
1.4.2 美国国立卫生研究院卒中量表(NIHSS)评分 比较两组患者治疗前后NIHSS评分,该量表包括意识水平、感觉及语言功能、肢体运动功能等项目,总分42分,评分越高表明神经功能缺损程度越重。
1.4.3 血清炎性因子水平 采用酶联免疫吸附试验(ELISA)检测两组患者治疗前后血清肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)水平,试剂盒由南京建成生物有限公司提供,严格按照试剂盒说明书进行操作。
1.4.4 不良反应 观察两组患者治疗期间药物不良反应发生情况。
1.5 统计学方法 采用SPSS 18.0统计软件进行数据分析,年龄、脑水肿带体积、NIHSS评分、血清TNF-α及IL-1β水平均符合正态分布,以(±s)表示,采用两独立样本t检验;性别、出血部位以例数表示,采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 脑水肿带体积、NIHSS评分 治疗前两组患者脑水肿带体积、NIHSS评分比较,差异无统计学意义(P>0.05);治疗后研究组患者脑水肿带体积小于对照组,NIHSS评分低于对照组,差异有统计学意义(P<0.05,见表1)。
表1 两组患者治疗前后脑水肿带体积、NIHSS评分比较(±s)Table 1 Comparison of volume of cerebral edema band and NIHSS score between the two groups before and after treatment
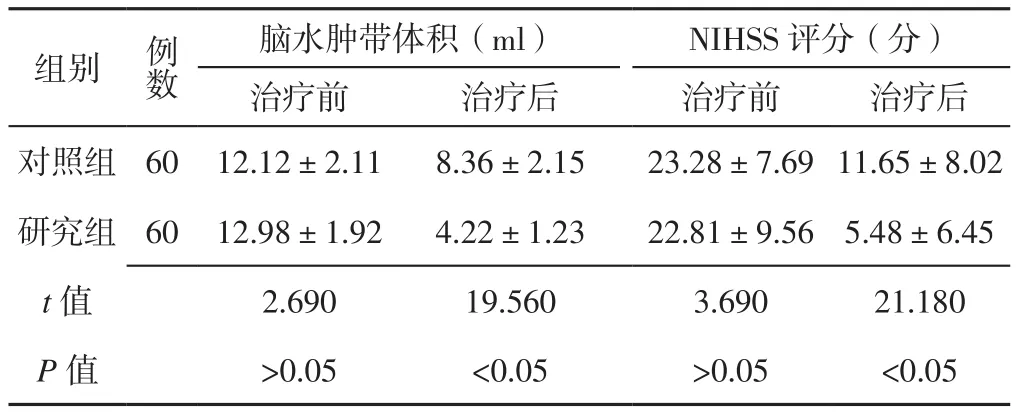
表1 两组患者治疗前后脑水肿带体积、NIHSS评分比较(±s)Table 1 Comparison of volume of cerebral edema band and NIHSS score between the two groups before and after treatment
注:NIHSS=美国国立卫生研究院卒中量表
组别 例数脑水肿带体积(ml) NIHSS评分(分)治疗前 治疗后 治疗前 治疗后对照组 60 12.12±2.11 8.36±2.15 23.28±7.6911.65±8.02研究组 60 12.98±1.92 4.22±1.23 22.81±9.56 5.48±6.45 t值 2.690 19.560 3.690 21.180 P值 >0.05 <0.05 >0.05 <0.05
2.2 血清TNF-α、IL-1β水平 治疗前两组患者血清TNF-α、IL-1β水平比较,差异无统计学意义(P>0.05);治疗后研究组患者血清TNF-α、IL-1β水平低于对照组,差异有统计学意义(P <0.05,见表2)。
表2 两组患者治疗前后血清TNF-α、IL-1β水平比较(±s,ng/L)Table 2 Comparison of serum levels of TNF-α and IL-1β between the two groups before and after treatment
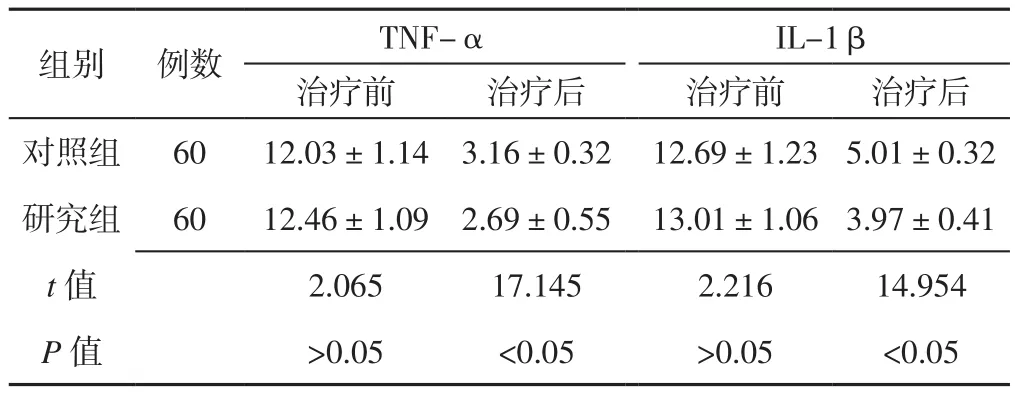
表2 两组患者治疗前后血清TNF-α、IL-1β水平比较(±s,ng/L)Table 2 Comparison of serum levels of TNF-α and IL-1β between the two groups before and after treatment
注:TNF-α=肿瘤坏死因子α,IL-1β=白介素1β
组别 例数 TNF-α IL-1β治疗前 治疗后 治疗前 治疗后对照组 60 12.03±1.14 3.16±0.32 12.69±1.23 5.01±0.32研究组 60 12.46±1.09 2.69±0.55 13.01±1.06 3.97±0.41 t值 2.065 17.145 2.216 14.954 P 值 >0.05 <0.05 >0.05 <0.05
2.3 不良反应 两组患者治疗期间未出现明显药物不良反应。
3 讨论
脑出血后继发性脑损伤的发生机制较复杂,与炎性反应、氨基酸毒性、自由基损伤、脑水肿、补体系统活性并释放血管活性物质等密切相关[5-6],严重时可导致脑细胞死亡[7]。近年研究表明,凝血酶释放、血块回缩、血红蛋白毒性作用、红细胞溶解及炎性反应等是导致脑出血后脑水肿的主要原因[8]。
目前,临床治疗高血压脑出血的方法多种多样,尚未形成标准治疗方案[9]。尼莫地平是一种阻滞型Ca2+拮抗剂,对脑血管及Ca2+通道具有选择性,可有效提高侧支循环血液供应量、抑制Ca2+进入平滑肌细胞内、减少血管内皮细胞活性物质的释放及脑细胞自由基、血小板的生成,有利于维持血管平滑肌弹性[10-11]。此外,尼莫地平还能够增加小血管扩张能力,有利于改善局部脑组织微循环,减少脑水肿的发生[12]。注射用鼠神经生长因子是一种具有生物活性的小分子分泌蛋白,有助于维持感觉神经元、交感神经元正常功能及神经元活力,促进神经元增殖、分化及轴突生长[13],加快神经功能恢复进程等,近年来注射用鼠神经生长因子用于治疗脑出血并取得良好的效果[14]。
本研究结果显示,两组患者治疗前脑水肿带体积、NIHSS评分及血清TNF-α、IL-1β水平间无统计学差异,治疗后研究组患者脑水肿带体积小于对照组,NIHSS评分及血清TNF-α、IL-1β水平低于对照组,表明尼莫地平联合注射用鼠神经生长因子可有效缩小脑出血患者脑水肿带体积、减轻神经功能缺损程度、降低血清炎性因子水平,有利于保护神经元,改善患者神经功能及预后。本研究结果还显示,两组患者治疗期间均未出现明显药物不良反应,提示尼莫地平联合注射用鼠神经生长因子治疗脑出血的安全性较高,有一定临床应用推广价值;但本研究样本量较小且观察时间较短,尼莫地平联合注射用鼠神经生长因子对脑出血患者的远期影响及二者的具体作用机制仍有待通过扩大样本量、延长观察时间而进一步研究证实。

