大气PM2.5 短期暴露对心脑血管疾病住院风险的滞后效应和累积效应研究
张文博,阎磊,解淑艳,宋佳丽,季润青,胡爽,李希,严小芳,郑昕,邵凤民,李静
据世界卫生组织(WHO)估计,大气颗粒物(主要包含PM2.5、PM10)污染每年导致全球400 余万人死亡[1]。大气污染长期或短期暴露均可显著引起死亡及急性心肌梗死、心律失常和心力衰竭等疾病的发生[2-4]。大量研究表明,PM2.5对心脑血管疾病的影响存在滞后效应和累积效应[5-6]。
虽然关于PM2.5对心脑血管疾病短期暴露健康效应的研究较多,但基于我国PM2.5监测数据和我国人群的相关研究证据仍不充分。我国在全国范围内系统监测PM2.5污染情况始于2013 年[7],因此使用我国监测数据开展的研究时间较晚,多数短期暴露的有力证据源于国外研究,有关我国PM2.5短期暴露的滞后效应和累积效应的结论尚不明确;欧美国家的PM2.5污染情况与我国差距明显[8],PM2.5在更高浓度时的短期健康效应同样不明确。因此有必要基于我国PM2.5监测数据和我国人群,探索PM2.5短期暴露的滞后效应和累积效应对心脑血管疾病住院风险的影响。
本研究基于河南省人民医院的住院病例数据,探索PM2.5短期暴露的滞后效应和累积效应对心脑血管疾病住院风险的影响,旨在为改善防护工作、减轻大气污染对健康的危害提供依据。
1 对象与方法
1.1 研究对象资料
患者资料来源于河南省人民医院2015 年1 月1 日至2018 年6 月26 日期间的全部病案首页资料,包括性别、年龄、入院及出院日期、入院及出院主要诊断等。病例的诊断结果采用《GB/T14396-2016疾病分类与代码》[9]要求的编码形式。参照既往研究已证实的与颗粒物污染相关的疾病[10],研究人员利用编码从病案首页数据库中提取“出院主要诊断”为下列6 类事件的患者:冠心病、急性心肌梗死、心力衰竭、心律不齐、短暂性脑缺血发作和脑卒中。在上述时间段内多次就诊者,本研究仅纳入首次就诊信息。
由于大气污染物资料[PM2.5、PM10、二氧化硫(SO2)、二氧化氮(NO2)、一氧化碳(CO)、臭氧(O3)每日平均浓度值]和气象资料(每日平均气温、每日平均相对湿度)均为郑州市资料,因此按照住址信息将患者限定为郑州市居民。同时结合上述两项资料的时间覆盖范围、排除关键变量缺失(患者编号、住址信息、住院时间、入院诊断等)等情况后,确定最终的研究人群。
1.2 大气污染物资料
同期郑州市大气污染物监测资料来源于“全国城市空气质量实时发布平台”的历史数据。资料内容包括PM2.5、PM10、SO2、NO2、CO“城市每日24小时平均浓度值”和O3“城市日最大8 小时浓度平均值”。
1.3 气象资料
同期气象资料来源于“中国气象数据网”。本研究中纳入的郑州市“逐日地面气象观测资料”包含日平均气温和日平均相对湿度。
1.4 统计学方法
本研究对郑州市2015 年1 月1 日至2018 年6月26 日的大气污染、气候状况采用均值、标准差、四分位数、极值的形式描述,均值为该时间段内所有日均值的算术均数。污染物间相关性分析采用Spearman 秩相关的分析方法。
本研究采用双向匹配的病例交叉设计,在控制气象因素(温度、相对湿度)后评价PM2.5短期暴露对于心脑血管疾病住院风险的影响[11-12]。在选择对照时采取时间分层的方式,在结局事件发生的时间点前后,间隔相同时间(3 周),确定对照发生的时间点,即病例和对照发生的时间点处于“同一个星期几”,此种方法可以有效避免PM2.5分布的“星期效应”[13]。同时,同一组病例和对照的滞后期保持一致,例如,当病例的滞后期为3 天时,前后两个对照的滞后期同为3 天。双向匹配的病例交叉设计可有效避免大气污染物时间趋势带来的偏倚[12]。
本研究先得出采用不同滞后期(0~15 天)的健康效应(OR 值),再对滞后期内每一天的滞后效应进行累积,获得该时间段内的累积效应。lag0 的PM2.5的平均暴露浓度为当日浓度,lag1 的PM2.5暴露浓度为发生事件当日前1 天的PM2.5日均值,其余滞后期的暴露浓度依次类推[14]。具体模型如下:
Logit (Pt)=βPMlagt+Tt+RHt+α
模型说明:Pt,发生污染后第t 天污染物滞后效应导致的心脑血管疾病住院风险;β,回归系数;PMlagt延迟第t 天的污染物浓度;T,日均气温;RH,日平均相对湿度;α,残差。第0 到第t 天的累积效应表示为β0+β1+……βt,累积效应的OR 值为eβ0+β1+……βt[15]。运用上述模型建立“单污染物模型”(污染物变量部分只纳入PM2.5)和“多污染物模型”(污染物变量部分纳入PM2.5、PM10、SO2、NO2、CO、O3),多污染物模型旨在调整其他污染物后,分析PM2.5短期暴露对心脑血管疾病住院风险的影响是否改变。
基于SAS 9.4 软件进行上述统计分析,得出PM2.5浓度每升高10 μg/m3时,心脑血管疾病住院风险的改变。P<0.05 视为差异具有统计学意义。
2 结果
研究人群基本特征(表1):2015 年1 月1 日至2018 年6 月26 日期间,河南省人民医院可纳入研究的心脑血管病住院患者5 194 例;男性比例高于女性(57.4% vs 42.6%);患者平均年龄为(48.5±22.8)岁,56~75 岁的患者占50.4%(2 618 例)。出院主要诊断为冠心病的患者数量最多,3 646 例(70.2%);其次为短暂性脑缺血发作患者,628 例(12.1%),急性心肌梗死、心律不齐、脑卒中和心力衰竭的患者分别有258 例(5.0%)、243 例(4.7%)、211 例(4.1%)和208 例(4.0%)。
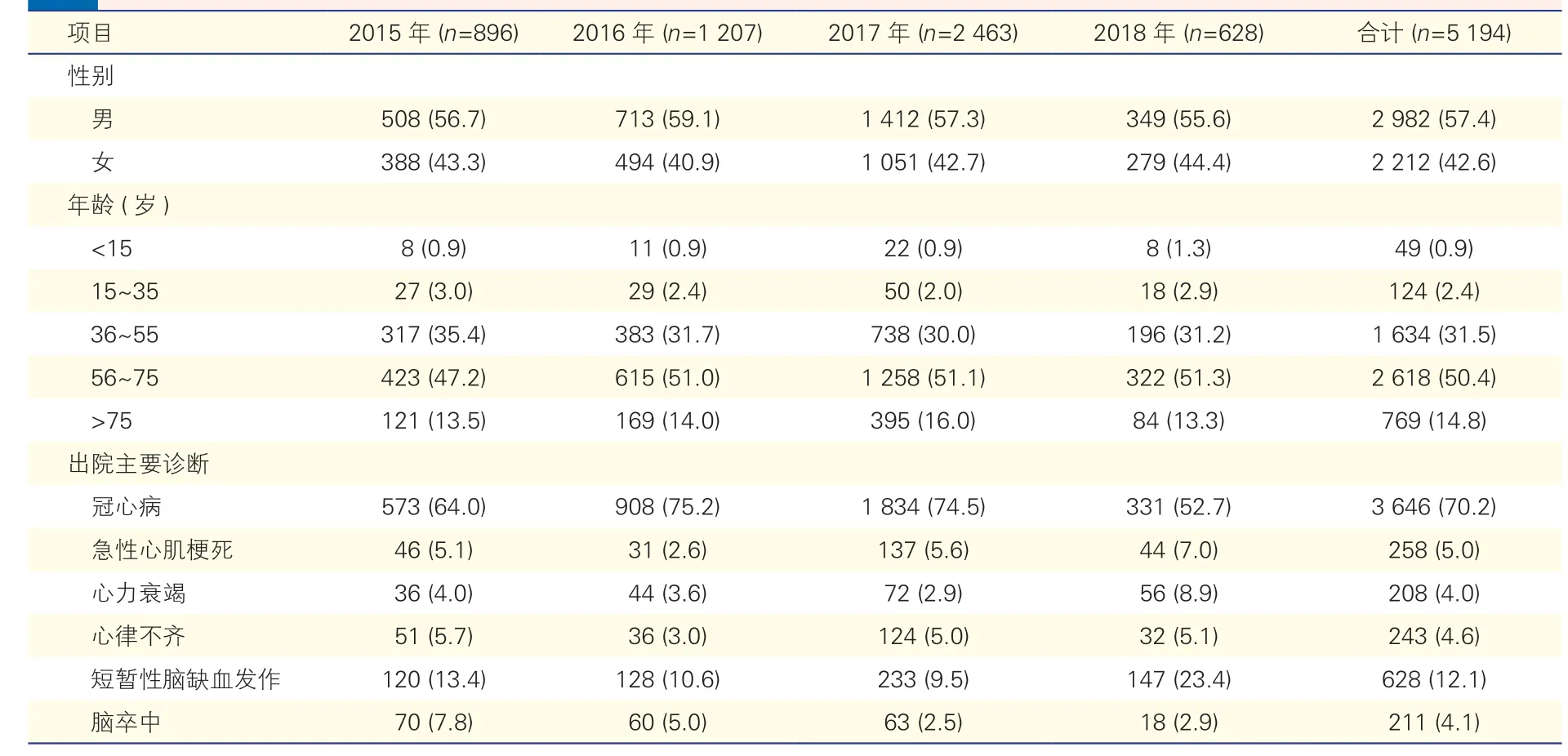
表1 研究人群基本特征[例(%)]
2015~2018 年郑州市主要大气污染物及气象因素的基本特征(表2):2015 年1 月1 日至2018 年6月26 日,郑州市PM2.5日均浓度平均值为80.8 μg/m3,PM10日均浓度平均值为145.5 μg/m3,臭氧日均浓度平均值为101.6 μg/m3,其他主要大气污染物及温度、湿度的同期基本情况见表2。
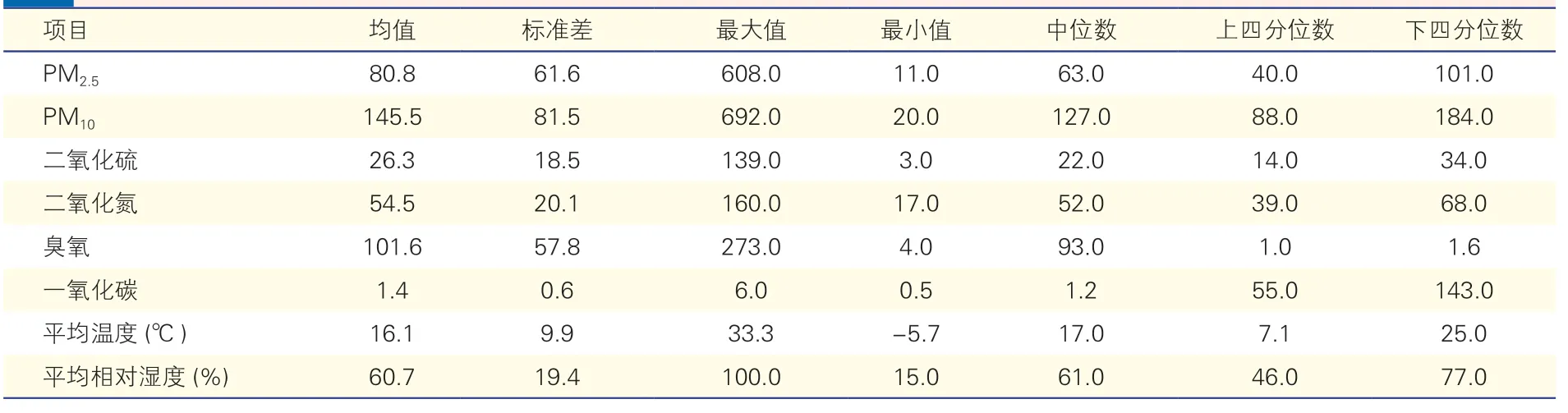
表2 2015~2018 年郑州市主要大气污染物及气象因素基本特征 (μg/m3)
主要大气污染物间Spearman 相关分析(表3):分析显示,郑州市6 种主要污染物之间,除O3外,其余均互呈正相关关系(P 均<0.05)。各污染物浓度间相关性较高。

表3 2015~2018 年郑州市主要大气污染物间的Spearman 相关分析
单污染物模型中PM2.5短期暴露对心脑血管疾病住院风险影响的滞后效应(图1A):在单污染物模型中,滞后2~5 天(lag2~lag5)及滞后8~13 天(lag8~lag13)的滞后效应对心脑血管住院风险有显著影响。在lag2~lag5 中,PM2.5日均浓度每升高10 μg/m3,其对应的OR 值分别为1.009(95%CI:1.001~1.018)、1.012(95%CI:1.003~1.022)、1.012(95%CI:1.002~1.023)、1.014(95%CI:1.002~1.026);在lag8~lag13 中,PM2.5日均浓度每升高10 μg/m3,其对应的OR 值分别为1.020(95%CI:1.007~1.034)、1.029(95%CI:1.015~1.043)、1.036(95%CI:1.021~1.051)、1.036(95%CI:1.021~1.051)、1.038(95%CI:1.022~1.053)、1.021(95%CI:1.005~1.038)。当滞后期为12 天时,OR 值达到最大,为 1.038。
多污染物模型中PM2.5短期暴露对心脑血管疾病住院风险影响的滞后效应(图1B):在多污染物模型中,调整PM10、SO2、NO2、CO、O3等污染物浓度后,PM2.5短期暴露对心脑血管疾病住院风险的影响不再显著。
单污染物模型中PM2.5短期暴露对心脑血管疾病住院风险影响的累积效应(图2):在单污染物模型滞后效应显著的两段滞后期内,累积效应整体均呈上升趋势(Ptrend<0.05)。滞后8~13 天时,PM2.5短期暴露的累积效应达到最大,累积β 值为0.177,PM2.5浓 度 每 升 高10 μg/m3,累 积OR 值 为1.194(95%CI:1.176~1.212)。
敏感性分析:本研究共纳入6 类心脑血管疾病作为复合终点,其中出院主要诊断为冠心病的患者数量最多,且人数超过70%,因此针对冠心病患者进行敏感性分析,观察PM2.5短期暴露对冠心病患者住院风险的滞后效应和累积效应是否稳健。分析结果显示,在单污染物模型中,滞后9~13 天时,PM2.5短期暴露对冠心病患者住院风险的滞后效应显著,且滞后12 天时OR 值最大。滞后9~13天 的OR 值 分 别 为1.033(95%CI:1.006~1.040)、1.030(95%CI:1.013~1.048)、1.033(95%CI:1.015~1.050)、1.036(95%CI:1.017~1.053)、1.021(95%CI:1.002~1.041)。在多污染模型中,滞后效应不显著。单污染物模型在9~13 天的滞后期内,PM2.5短期暴露对冠心病患者住院风险的累积β 值为0.140,累积OR 值为1.151(95%CI:1.140~1.161)。以冠心病为终点事件的分析结果与6 类疾病复合终点的分析结果接近。
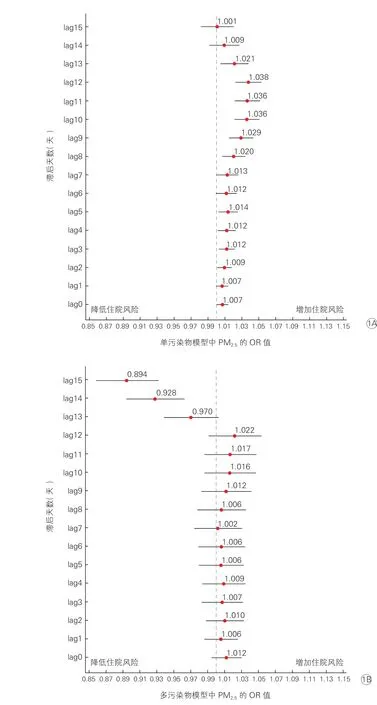
图1 单污染物(1A)和多污染物(1B)模型中PM2.5 浓度每升高10 μg/m3 对心脑血管疾病住院风险影响的滞后效应

图2 单污染物模型中PM2.5 短期暴露对心脑血管疾病住院风险影响的累积效应
3 讨论
本研究发现PM2.5短期暴露对心脑血管疾病住院风险的影响存在滞后效应和累积效应,且主要见于PM2.5浓度升高之后两周内。PM2.5短期暴露滞后2~5 天及8~13 天时显著增加心脑血管疾病的住院风险,滞后12 天时风险最大,PM2.5浓度每升高10 μg/m3,相应风险约增加4%。与之相似,在8~13 天的滞后期内,PM2.5短期暴露的累积效应达到最大,PM2.5平均浓度每升高10 μg/m3,相应的风险增加近20%。
本研究观察到,PM2.5短期暴露增加心脑血管疾病住院风险的最大滞后效应和最大累积效应发生时间均晚于既往文献报道,且累积效应对心脑血管疾病住院风险的增加作用明显大于既往文献报道。Pope 等[16]关于颗粒物污染短期暴露与缺血性心脏病发生风险的研究表明,滞后0、1 天时,PM2.5短期暴露对急性冠状动脉事件影响的滞后效应均比较显著,且滞后0 天即发病当天的滞后效应最大,PM2.5每升高10 μg/m3,急性冠状动脉事件的发生风险增加5%。Belleudi 等[17]关于颗粒物污染与心血管疾病急诊入院的研究表明,滞后0~6 天时,PM2.5暴露对心力衰竭住院影响的滞后效应均显著,且入院当天滞后效应最大,PM2.5浓度每升高10 μg/m3,心力衰竭急诊入院率增加2%。Xu 等[6]针对大气颗粒物污染对心血管急诊入院影响的结果表明,PM2.5暴露滞后0~5 天时的累积效应最大,PM2.5平均浓度每升高10 μg/m3,心血管疾病急诊入院率增加<1%。Yu等[18]针对5 545例心肌梗死患者开展的研究表明,PM2.5暴露滞后0~1 天时的累积效应最大,PM2.5平均浓度每升高10 μg/m3,心肌梗死入院率增加1%。
本研究与既往研究存在差异,考虑与连续或相近重污染天气叠加有关。本研究观察期间,PM2.5浓度超过100 μg/m3的天数超过1/4,意味着重污染天气连续或短期内叠加现象十分明显,使得累积效应可能实际上反映了多次暴露的叠加累计效应。此外,我国心脑血管疾病患者从发病到住院存在明显延迟[19],可能会使我们观察到的滞后效应和累积效应达峰时间较真实的PM2.5暴露对发病效应的达峰时间更滞后。一方面,患者对心脑血管疾病症状不了解,就诊不及时情况较普遍。另一方面,河南省人民医院作为大型三级甲等医院,住院床位使用率很高,部分患者发病后可能因病房无床而无法及时住院,先在急诊留观等待一段时间。
单污染物模型中,部分滞后期内PM2.5短期暴露的滞后效应显著,但多污染物模型中则均不显著。这一结果表明,PM2.5短期暴露与其他污染物对心脑血管疾病住院风险的影响不具有独立作用。由于污染物浓度间相关性较大,因此多污染模型得到的并不显著的滞后效应无法真实反映PM2.5短期暴露对住院风险的独立影响。
本研究存在以下局限性。首先,我们没有收集患者每日的室外暴露时间,当患者位于室内时,PM2.5的暴露水平将大大降低,这导致高估大气PM2.5的暴露浓度[20];其次,虽然采用经典的病例交叉对照的统计学方法可以平衡部分患者自身因素造成的偏倚,但仍存在部分特征在病例滞后期和对照滞后期内无法完全匹配,例如个体的精神、情绪状态等因素;第三,我们未能纳入郑州市全部住院数据。然而河南省人民医院规模很大,其就诊量在郑州市多家三甲综合医院中靠前[21],是郑州市居民重症住院的首选医院之一。最后,部分发病患者可能于住院前就已死亡,这将导致估算的整体OR 值偏低。
综上所述,PM2.5短期暴露会增加心脑血管疾病的住院风险,且这种风险存在滞后效应和累积效应。本研究为心脑血管疾病患者在重污染天气时的健康防护提供了科学依据和启示,建议心脑血管疾病较高风险者在重污染天气出现两周以内,应尽量减少户外活动,在户外活动时应采取佩戴口罩等明确有效的防护措施。

