多腺毛烟草K326品种基因编辑材料的创制与分析
潘 阳,王召军,李雪君,闫筱筱,张洪映,孙计平,崔 红*
1.河南农业大学烟草学院,郑州市文化路95号 450002
2.河南省农业科学院烟草研究所,河南省许昌市魏都区青梅路与永昌大道交叉口 461000
腺毛由植物表皮细胞分化而来,在植物抵御外界不良环境和次生代谢物质积累和利用中起重要作用[1]。烟草腺毛丰富,种类多样。西柏烷二萜和糖酯化合物是烟草腺毛分泌物的主要成分,这些成分不仅是重要的香气前体物质,而且对蚜虫也具有明显的趋避作用[2-4]。因此提高烟草腺毛密度是提高烟草抗性和改良烟叶品质的重要途径之一。烟草腺毛密度受光照[5]、温度[6]、水分[7]、土壤[8]、肥料[9-11]和生态环境[12]等多种条件的影响,但遗传因素对烟草腺毛密度仍然起决定性作用。不同烟草类型[13]、品种[14-15]、叶位及叶片发育时期[16-17]的腺毛密度和分泌物含量与组分均有较大差异,在一定程度上影响烟叶的品质和风格。培育高腺毛密度、高分泌型的烟草品种是烟草常规育种的重要目标之一。豫烟11号是以烟草叶面分泌物为育种目标系统选育出的特香型烤烟品种,其叶面分泌物总量高于K326、红大、翠碧1号、中烟100等烤烟品种,尤其赖柏当类二萜化合物含量显著增加[13]。该品种的审定和推广证明了腺毛分泌物含量增加对烟叶品质的显著贡献,而其“特香型”风格定位也体现了腺毛分泌物组分的改变对烤烟香气风格所产生的影响。然而烟草遗传背景狭窄,缺乏腺毛改良相关的遗传材料,通过常规育种手段进行腺毛改良进展缓慢。采用基因编辑技术提高烟草腺毛密度,能在不改变分泌物组分的前提下提高分泌物含量,既保证了烤烟原有的香气风格又提高了香气量,是进行烤烟叶面化学改良的一条有效途径。
植物B型细胞周期蛋白(B-type cyclins)参与细胞分裂过程中从G2向M期的转换,在植物生长发育过程中起重要作用[18]。拟南芥CycB1;2基因在腺毛中的特异表达,可使单细胞腺毛转变为丛生多细胞型腺毛[19]。番茄SlCycB2基因表达受到抑制后,多细胞非分泌型腺毛(Ⅲ型和V型)明显增多,而分泌型腺毛(I型)消失[20-21]。NtCycB2在烟草中过表达及在番茄中异源表达均出现腺毛密度明显减少的现象[22]。这些研究结果证明,NtCycB2基因对烟草腺毛的发生具有一定负向调控作用,可能成为利用基因编辑技术提高腺毛密度的理想靶点。但B型细胞周期蛋白在调控植物腺毛发生的同时,对植物生长发育也有多重影响,涉及根系发育[23]和种子萌发[24]等过程。在番茄中,SlCycB2基因的过表达可导致花器官异常、不育,抑制SlCycB2基因的表达对植株表型并无明显影响[22],但关于NtCycB2基因对烟株生长发育和物质积累的影响目前还未见报道。为此,以烟草品种K326为材料,通过基因编辑技术敲除NtCycB2基因后创制了高腺毛密度的K326纯合材料(HK326),并分析了NtCycB2基因敲除对烟株生长发育、叶面化学成分、烤后烟中性香气物质的影响,旨在探索NtCycB2基因在烟草叶面化学成分定向调控及烟草品种分子改良中的应用潜力。
1 材料与方法
1.1 试验材料
供试材料为烟草品种K326,无菌苗于光照培养箱中培养,培养条件为温度25℃、相对湿度60%,光周期16 h光/8 h暗。大田试验于2018年进行,地点设置在河南省许昌市河南省农科院烟草研究所试验田,于5月8日移栽,按照优质烤烟栽培规程进行田间管理。
1.2 试验方法
1.2.1 载体构建
根据已发表的烟草NtCycB2蛋白序列[22],在K326基因组序列数据库(https://solgenomics.net/organism/Nicotiana_tabacum/genome)中 进 行 Blast比对,获得NtCycB2基因的两个拷贝(Nitab4.5_0014697g0010.1和 Nitab4.5_0012062g0010.1)。借助CRISPR2在线软件(http://crispr.hzau.edu.cn/CRISPR2/),依据其同源序列设计 gRNA:GTGATCAACCACCCACAAG,合成二聚体后连入CRISPR-Cas9载体,并获得NtCycB2基因敲除载体。载体中gRNA由拟南芥U6启动子启动,筛选标记为潮霉素。
1.2.2 遗传转化
采用叶盘转化法进行烟草遗传转化[25]。将上述构建得到的NtCycB2基因敲除载体转入农杆菌GV3101菌株,于YEB培养基中培养至菌液OD600值为0.4~0.6,侵染预培养2 d的K326叶圆片8 min,黑暗条件下共培养2 d后转入筛选培养基[MS培养基 +0.15 mg/Lα-萘乙酸(1-Naphthalene acetic acid,NAA)+1.0 mg/L 6-苄氨基嘌呤(6-Benzylaminopurine,6-BA)+8 mg/L 潮 霉 素 B(Hygromycin B,Hyg)+50 mg/L 头 孢 噻 肟 钠(Cefotaxime sodium,CTX)]上分化,待长出不定芽后转入生根培养基(MS培养基+0.15 mg/L NAA+8 mg/L Hyg)继续培养,以获得抗性植株。
1.2.3 分子鉴定
采用CTAB法提取抗性植株的基因组DNA,在gRNA附近设计检测引物(F1:ATGAGCCGAAG AAATGGAAA,R1:CAACATCAAGCAAACAAGT AC),对T0代幼苗中NtCycB2基因gRNA区域进行扩增。PCR反应条件:94℃预变性5 min;94℃30 s,58 ℃ 30 s,72 ℃ 30 s;38个循环,最后72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后,切胶回收,连入pMD19-T载体,送金唯智公司测序,以鉴定其突变情况。得到的阳性植株自交留种,并获得T1代烟草种子。
烟草T1代种子采用漂浮育苗,待烟苗生长至三叶一心时,剪取T1代单株叶片,采用CTAB法提取基因组DNA。利用潮霉素抗性基因扩增引物(F2:CGAGAGCCTGACCTATTGCAT,R2:CTGCT CCATACAAGCCAACCAC)对T1代单株进行鉴定,并筛选出无转基因筛选标记的单株。
1.2.4 农艺性状调查
2018年3月将K326及去载体的NtCycB2基因敲除株系按照行业标准[26]进行育苗,5月8日移栽至河南省农科院烟草研究所试验田,并按照标准方法[27]进行大田种植与管理,保证各株系在相同条件下正常生长。依照烟草行业标准方法[28]在烟株现蕾期进行农艺性状指标的测量。
1.2.5 腺毛形态学分析
于旺长期取烟株上、中、下部的叶片进行化学染色、腺毛形态观察及密度统计。实验操作参考娄亚楠等[29]的方法,将叶片置于0.2%(W/V)的罗丹明B水溶液中浸染30 min,染色结束后用蒸馏水漂洗3次,冲洗掉未结合的染料。用滤纸吸干叶片表面水分后,置于超景深显微镜(VHR-5000,日本基恩士公司)下进行腺毛观察,并在叶片上表皮中部随机选择3个视野进行腺毛密度的统计。
1.2.6 叶面化学成分分析
烟株打顶4周后取中部叶片(第12叶位),在二氯甲烷溶液中浸提。浸提液加入1 mL内标(2.020 mg/mL的蔗糖八乙酸酯和2.542 mg/mL的正十七烷醇的混合溶液)后过滤,在旋转蒸发仪中浓缩后,在氮气保护下将溶剂吹干。加入500 μL 1∶1(V∶V)的N,N-二甲基甲酰胺(DMF)和N,O-双三甲硅基三氟乙酰胺(BSTFA),75℃水浴中进行衍生化反应60 min,然后加入N,O-双乙酰胺和吡啶各125 μL。采取GC/MS分析仪(美国Agilent公司,色谱仪型号HP-5890,质谱仪型号vc-70SE)进行样品化学成分的定性和定量分析,色谱参数检测参考王霄龙等[30]的方法。
1.2.7 中性香气物质成分分析
选取烤后中部烟叶,研磨,用孔径0.25 mm过滤筛过滤。称取10 g烟样置于500 mL圆底烧瓶中,并依次加入1 g柠檬酸和350 mL蒸馏水。另取40 mL二氯甲烷置于250 mL圆底烧瓶中并加入500 μL内标(硝基苯)。两个圆底烧瓶联通后同时加热蒸馏萃取,收集250 mL烧瓶中有机相,加入10 g左右无水硫酸钠摇匀至溶液澄清,水浴浓缩有机相至1 mL左右。所得样品采用GC/MS联用仪(美国Agilent公司 HP5890Ⅱ-5972)进行定性分析,参考邸慧慧等[31]的方法设定色谱参数。
1.2.8 数据处理
所有实验均分别进行3次独立测定,获得数据采用SPSS 17软件进行单因素方差分析及最小显著差法多重比较,用Excel 2013软件进行图表绘制。
2 结果与讨论
2.1 多腺毛K326的创制和筛选
采用农杆菌介导法将携带NtCycB2基因敲除载体的GV3101菌株转化烟草K326,获得了23株耐受潮霉素的阳性植株。表型鉴定发现,大部分阳性植株在形态上与对照没有明显差异,但其中1个单株腺毛浓密,整株呈毛茸状(图1B),被命名为多腺毛K326(Hairy K326,HK326)。

图1 HK326材料的创制Fig.1 Screening of HK326 line
HK326在T0代产生多腺毛表型,可能是NtCycB2的纯合突变所致。为验证这一推测,利用特异引物对HK326的gRNA区域进行扩增和PCR产物测序鉴定。结果发现,HK326中NtCycB2基因在gRNA区出现套峰(双峰),说明HK326中NtCycB2基因已经发生了编辑,但并未纯合(图2A)。考虑到K326中存在两个NtCycB2基因拷贝,因此HK326中这种杂合状态也可能是由于两个拷贝发生了不同突变造成的。为此,进一步对HK326中NtCycB2基因进行了单克隆测序,在测序的10个单克隆中总共检测到两种类型的突变体,分别缺失了4 bp(同时还发生了1个C/T碱基突变)和7 bp(图2B),但并没有检测到野生型序列,说明HK326中NtCycB2基因两个拷贝的突变都已经纯合。
为获得无转基因元件的敲除植株,将HK326自交繁种,利用潮霉素抗性基因筛选引物对HK326 T1代幼苗进行单株鉴定,结果如图2C所示。在所检测的80个单株中,有23株没有扩增出潮霉素抗性基因片段,去载体单株的比例为28.8%。χ2检测表明,含载体与去载体单株数量符合3∶1的比例,说明敲除载体在HK326基因组中为单拷贝插入。
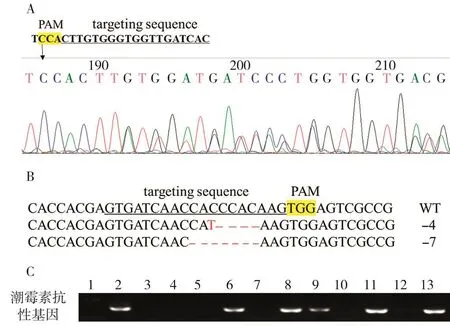
图2 HK326材料的分子鉴定Fig.2 Molecular identification of HK326
2.2 K326和HK326农艺性状的比较
为比较NtCycB2基因敲除对烟株生长发育的影响,将去载体后的HK326敲除植株与K326对照在河南省农业科学院烟草研究所试验田进行种植。农艺性状指标调查结果见表1。可以看出,与对照K326相比,HK326在株高和节距上表现出显著差异,而在茎围、最大叶长、最大叶宽和叶片数上HK326略高于对照K326。总体来看,HK326敲除植株生长势强于对照K326。
2.3 K326和HK326的腺毛密度比较
在烟株现蕾期分别对K326和HK326上部叶(第16叶位)、中部叶(第8叶位)和下部叶(第4叶位)进行叶面腺毛形态观察和密度统计,结果见表2和图3。可以看出,HK326与对照K326的叶面腺毛均由长柄分泌型、短柄分泌型和非分泌型3种类型组成,且均以长柄分泌型为主;随着叶片的生长发育,腺毛密度表现出逐渐减少的趋势,但腺毛类型保持不变。HK326与对照相比,腺毛密度增加,尤其是在上部叶中表现更为明显。除了非分泌型腺毛外,长柄分泌型和短柄分泌型均增加显著,同时长柄分泌型腺毛出现分枝现象,腺毛总数为对照的3倍。罗丹明B可与糖酯结合使其染色,根据染色深浅可以判断腺毛分泌能力的强弱,从图3中可以看出,长柄分泌型腺毛着色程度大于短柄和非分泌型腺毛,表明其碳水化合物含量丰富;HK326腺毛不仅着色比对照深,而且腺头饱满,发育完善,具有旺盛的物质合成和分泌能力。

表1 K326和HK326农艺性状调查结果①Tab.1 Agronomic traits of K326 and HK326
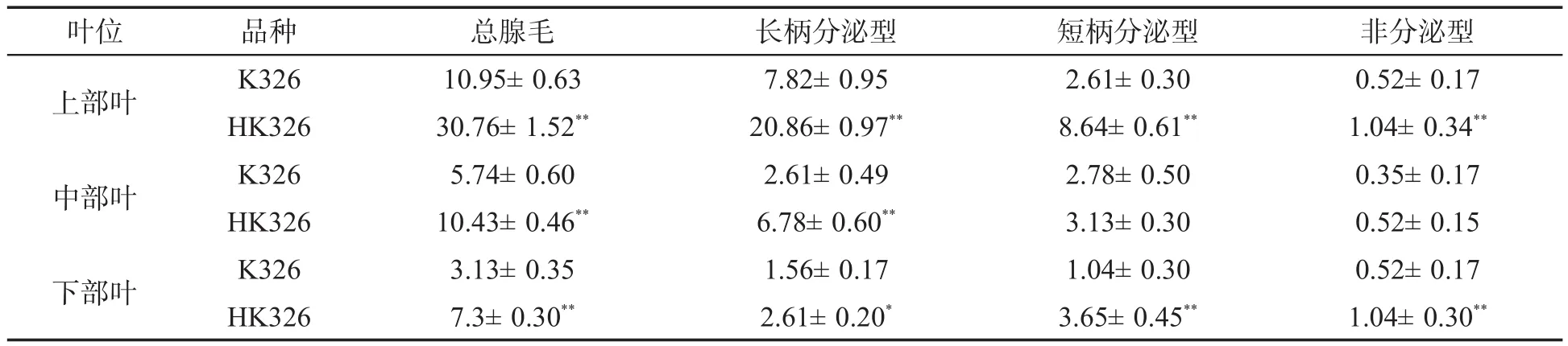
表2 K326和HK326各类腺毛的密度①Tab.2 Density of trichomes of K326 and HK326 (根/mm2)

A.长柄分泌型腺毛;B.短柄分泌型腺毛;C.非分泌型腺毛;D.长柄分枝腺毛(200×)
2.4 K326和HK326的二萜化合物分析
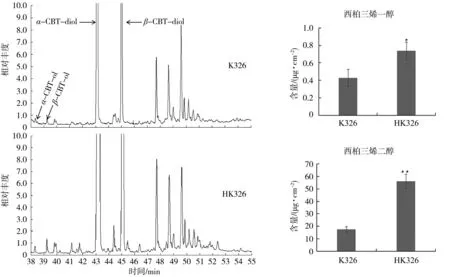
图4 K326和HK326叶面二萜化合物的含量Fig.4 Diterpenes contents in K326 and HK326
二萜化合物作为腺毛分泌物的主要成分,不仅是重要的香气前体物质,也对烟株抗性有重要影响[2,32]。为明确NtCycB2基因敲除对烟草二萜化合物组分和含量的影响,利用二氯甲烷萃取叶面化学成分并进行GC/MS检测,结果见图4。可以看出,HK326及对照的二萜化合物组成基本一致,均由西柏三烯一醇、西柏三烯二醇、西柏三烯二醇同分异构体组成,但含量变化较大。其中,HK326的西柏三烯一醇含量比对照提高72.09%;西柏三烯二醇比对照提高214.01%;西柏三烯二醇同分异构体比对照提高213.10%;从总量上看,HK326为151.01 μg/cm2,对照 K326 为 48.3 μg/cm2,提高 212.65%,可见HK326的二萜化合物含量远高于K326。
2.5 K326和HK326烤后烟叶中性香气成分分析
为比较NtCycB2基因敲除对烤后烟叶中性香气成分和含量的影响,对K326、HK326烤后烟叶的中性香气成分进行提取分析,结果见表3。
从表3可以看出,敲除株系HK326中性香气物质含量均高于对照K326,其中苯丙氨酸类物质含量比K326提高36.5%;棕色化产物类含量提高11%;类西柏烷类物质含量提高39.3%;类胡萝卜素类物质含量略高于对照K326;新植二烯含量提高59%。可见,NtCycB2基因敲除植株中性香气成分总量明显高于对照。
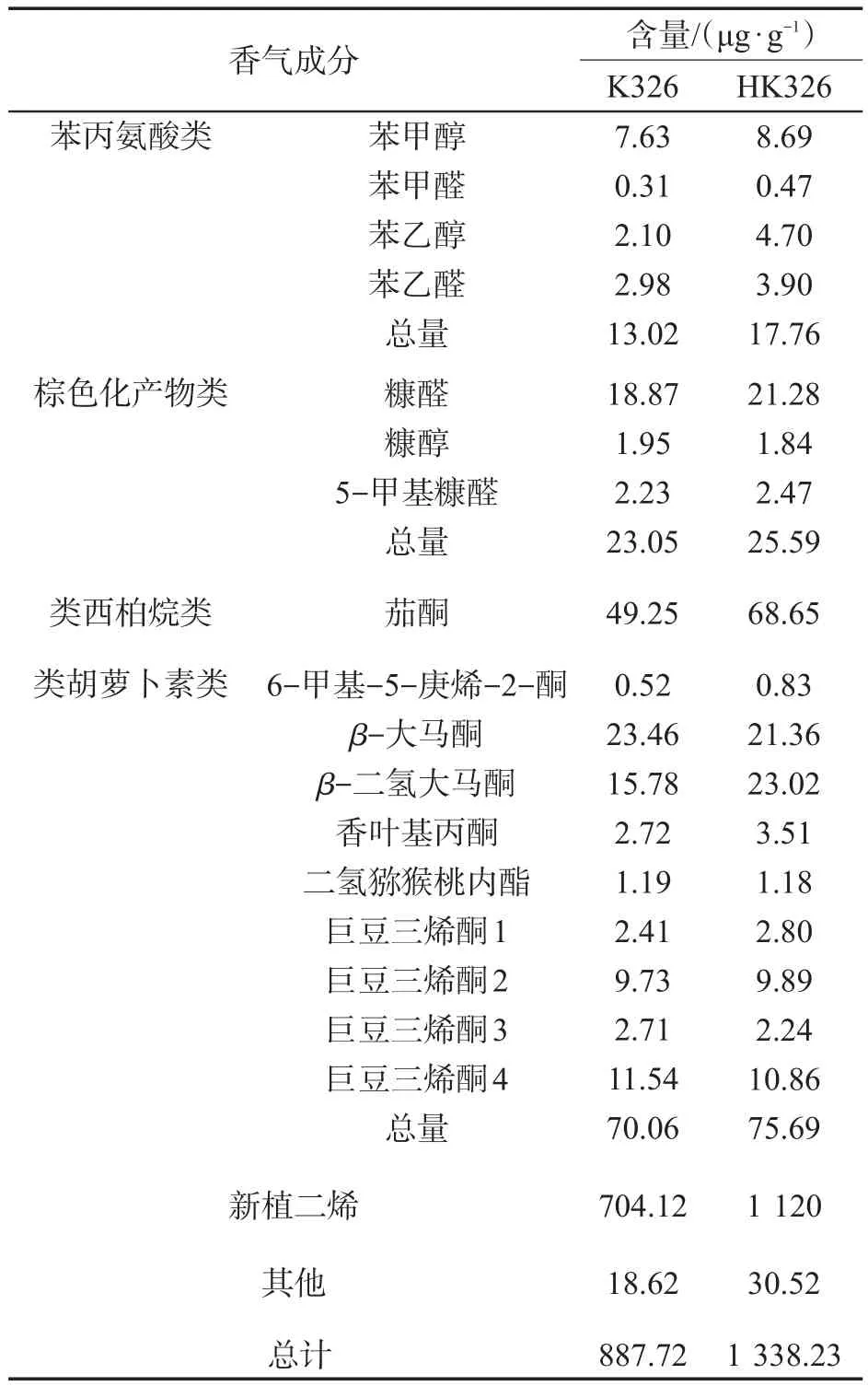
表3 K326和HK326中性香气成分含量Tab.3 Contents of neutral aroma components in K326 and HK326
3 结论
通过基因编辑技术获得了NtCycB2基因敲除且不存在任何转基因元件的K326定向改良材料HK326,该材料腺毛浓密,尤其是长柄分泌型腺毛密度显著提高。田间试验显示,HK326植株发育良好且生长旺盛。成熟期烟叶叶面化学成分分析表明,HK326腺毛分泌物含量显著提高,主要化合物西柏三烯二醇含量为对照的近3倍。在烤后烟叶中西柏烷类香气成分茄酮含量明显增加,其他中性香气成分也有不同程度增加,其中,新植二烯含量增加幅度较大。可见,在烟草中敲除NtCycB2基因可以增加分泌型腺毛密度,有利于腺毛分泌物积累和中性香气成分含量的提高,在烟草叶面化学改良中具有较大应用潜力。

