高致病性猪繁殖与呼吸综合征弱毒疫苗(TJM-F92株)安全性调查及有效性和干扰性试验
刘晓东,郝尧光,王宗升,王辉之,范根成,杜元钊,董雅琴,高 丰
(1. 吉林大学动物医学学院,吉林长春 130062;2. 动物基因工程疫苗国家重点实验室,山东青岛 266000;3. 中国动物卫生与流行病学中心,山东青岛 266032)
当前我国养殖环境较差,疾病错综复杂,单纯依靠药物治疗不仅不能有效控制疾病,还给猪场造成严重的经济损失。目前,猪繁殖与呼吸综合征病毒(PRRSV)在国内猪场的感染率已达70%以上,造成母猪流产、产死胎或弱仔、奶水质量差、返情、屡配不孕以及公猪精子活力弱、仔猪呼吸道症状严重等,后期可继发细菌感染,难以控制,严重时造成猪场大批猪只死亡[1-3]。
猪繁殖与呼吸综合征和古典猪瘟防疫是目前养猪业面临的难题,如何设计更加合理的免疫程序对其进行防控是目前急需解决的问题。为探讨高致病性PRRSV弱毒疫苗的安全性与有效性,确定更加合理的免疫程序,在山东省某规模化猪场开展了PRRSV 弱毒疫苗(TJM-F92株)安全性调查及有效性和干扰性试验。
1 材料与方法
1.1 材料
1.1.1 疫苗 试验疫苗选用高致病性PRRSV弱毒疫苗(TJM-F92株)与古典猪瘟病毒(CSFV)脾苗,利用疫苗专用稀释液稀释,疫苗来源于山东省青岛市某公司。
1.1.2 试验动物 安全性试验:选取母猪30头;有效性试验:选取不同阶段猪群各25头,共10组250头,包括母猪(空怀期、妊娠期、哺乳期)和仔猪(2、4、8、12、15、18、25周龄);干扰性试验:选取12头仔猪,分为2组,每组6头。各猪群免疫程序见表1。
1.1.3 试剂与仪器 PRRSV ELISA 抗体检测试剂盒、CSFV ELISA抗体检测试剂盒:购自美国IDEXX公司。其他试剂包括:ELISA反应板、洗涤液(10×)、阴性对照、阳性对照、样品稀释液、TMB底物、终止液等。酶标仪:型号为TECAN,购自瑞士帝肯公司;离心机:型号为TGL-16,购自湘仪公司;微量移液器、枪头、超净台等:由本实验室提供。

表1 不同猪群的PRRSV疫苗免疫程序
1.2 方法
1.2.1 安全性调查 2018年5月22日,对选取的30头母猪接种高致病性PRRSV(TJM-F92株)疫苗,然后分别统计免疫前后的采食量、体温变化情况;统计猪场近1年内43周龄母猪免疫该弱毒苗前后的返情比例、流产比例以及死胎、木乃伊胎产生率变化情况。
1.2.2 有效性试验 对3个阶段(空怀期、妊娠期、哺乳期)的试验母猪和7个生长周期(2~25周龄)的仔猪各25头,按表1程序免疫高致病性PRRSV(TJM-F92株)疫苗,然后利用ELISA方法进行PRRSV抗体水平跟踪检测。
1.2.3 干扰性试验 第1组(6头仔猪):在14日龄进行PRRSV(TJM-F92株)疫苗免疫,30、60日龄分别进行CSFV疫苗免疫,然后通过ELISA方法检测PRRSV及CSFV抗体;第2组(6头仔猪):在14日龄进行PRRSV(TJM-F92株)疫苗免疫,30日龄进行PRRSV疫苗与CSFV疫苗同时免疫(颈部肌内注射,一边一针),60日龄CSFV疫苗加强免疫。利用ELISA方法检测PRRSV及CSFV抗体。对两组数据进行对比,观察PRRSV(TJM-F92株)疫苗与CSFV疫苗间的相互影响。
1.2.4 检测及结果判定 按照各病毒试剂盒检测说明书进行操作。操作过程大体如下:被检样品加入与感作→洗涤→酶标二抗感作→洗涤→加入底物→加入终止液终止→OD值测定与分析。两种病毒抗体检测结果判定标准按说明书标准(表2)。
综上所述,优质护理在冠心病心绞痛护理中的应用效果确切,可减轻患者焦虑情绪和提高舒适度,改善心功能,缩短住院时间,满意度高。

表2 两种病毒抗体检测结果判定标准
1.2.5 数据处理 应用Excel 2013进行统计学分析。
2 结果与分析
2.1 安全性试验
2.1.1 采食量变化 对比发现,5月22日免疫PRRSV弱毒疫苗后,30头母猪的平均日采食量与免疫前相比几乎没有变化(图1),母猪采食行为正常。
2.1.2 体温变化 30头母猪5月22日免疫前后的平均体温均在正常范围内(图2),未出现高烧、低温等不正常现象。
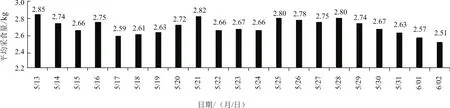
图1 猪群采食量监测结果

图2 猪群体温监测结果
2.2 安全性调查
2.2.1 返情率 该猪场母猪43周龄免疫PRRSV(TJM-F92株)疫苗后,返情率略有波动,但整体稳定(图3)。
2.2.2 流产率 猪场母猪43周龄免疫PRRSV(TJM-F92株)疫苗后生产情况基本正常,未发现流产增加现象(图4)。
2.2.3 死胎、木乃伊胎产生率 猪场母猪43周龄免疫PRRSV(TJM-F92株)疫苗后,没有发现死胎、木乃伊胎产生率大幅上升现象(图5)。
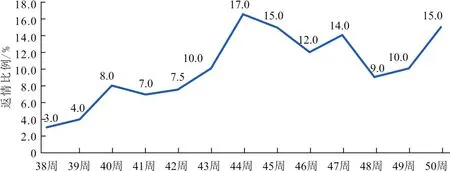
图3 母猪返情比例变化情况
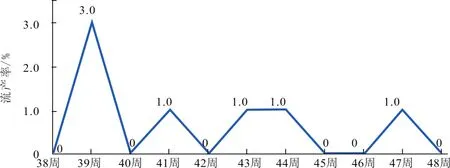
图4 母猪流产变化情况

图5 母猪的死胎、木乃伊胎产生率变化情况
2.3 有效性试验
2.3.1 免疫后PRRSV抗体平均值(S/P)及离散度(CV) 母猪每年3次免疫,仔猪14日龄免疫后,各阶段猪群抗体S/P值均在0.73~2.45之间;仔猪群免疫PRRSV疫苗后在15周龄抗体水平达到最高,母猪群在妊娠期抗体水平最高,哺乳期较低,表明猪群在妊娠期对PRRSV的抵抗力较强。免疫后各阶段猪群的抗体水平离散度在13.6%~61.7%之间;仔猪15周龄时的离散度最低,为13.6%,4周龄时最高,为61.7%(表3)。
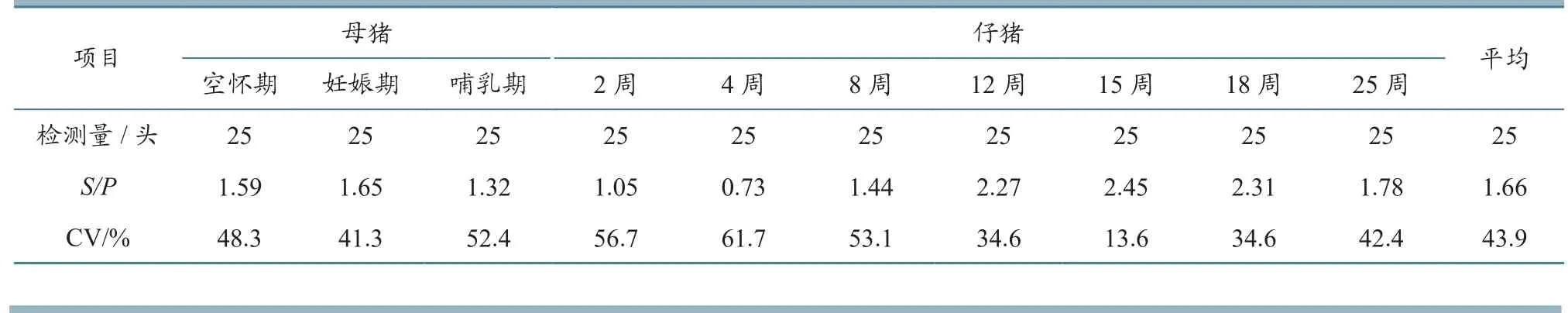
表3 各阶段猪群PRRSV抗体平均值(S/P)及离散度(CV)监测结果
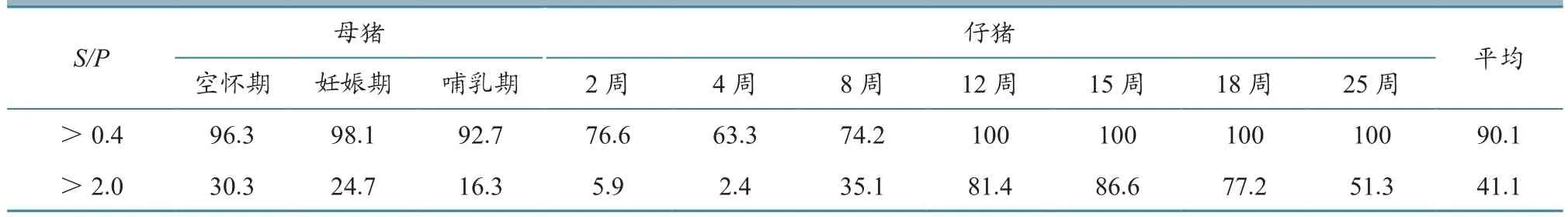
表4 PRRSV抗体(S/P)不同区间分布情况 单位:%
2.4 干扰性试验
2.4.1 分开免疫
2.4.1.1 CSFV抗体 对6头试验仔猪14日龄进行PRRSV疫苗免疫,30、60日龄进行CSFV疫苗免疫,发现CSFV疫苗免疫前的CSFV抗体阻断率平均值为22.7%,离散度为37.2%;一免后CSFV抗体阻断率平均值为52.8%,离散度为11.4%;二免后CSFV抗体阻断率平均值为67.0%,离散度为7.84%(表5)。由此可见:CSFV抗体在一免后较低,二免后才达到较高水平,且离散度也随之降低,说明CSFV疫苗二免保护效果远远好于一免。
2.4.1.2 PRRSV抗体 对6头试验仔猪14日龄免疫PRRSV疫苗,30日龄免疫CSFV疫苗后发现:免疫前PRRSV抗体S/P平均值为1.11,离散度为28.4%;一免后抗体平均值为2.13,离散度为12.5%(表6),说明14日龄时免疫1次PRRSV疫苗,30日龄后即可提供较高的保护。
2.4.2 联合免疫
2.4.2.1 CSFV抗体 对6头试验仔猪,在30日龄进行CSFV疫苗与PRRSV疫苗同时免疫,发现免疫前CSFV抗体阻断率平均值为18.5%,离散度为45.3%;一免后CSFV抗体阻断率平均为54.3%,离散度为14.9%;二免后CSFV抗体阻断率平均为66.5%,离散度为16.5%(表7)。这说明同时免疫CSFV活苗与PRRSV疫苗(TJM-F92株)后,CSFV抗体表现正常,未出现被PRRSV抑制的现象。
2.4.2.2 PRRSV 抗体 对6头试验仔猪30日龄时进行CSFV疫苗与PRRSV疫苗同时免疫,发现免疫前PRRSV抗体S/P平均值为0.99,离散度为39.2%;一免后PRRSV抗体S/P平均值为2.36,离散度为15.6%(表8)。此结果表明,30日龄时,CSFV疫苗与PRRSV疫苗同时免疫对PRRSV抗体产生无影响。

表5 免疫CSFV疫苗后抗体(阻断率)监测结果 单位:%
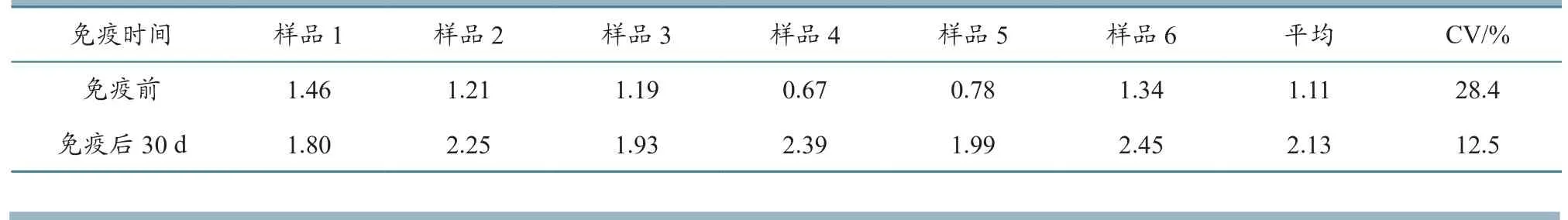
表6 免疫PRRSV疫苗后PRRSV抗体(S/P)监测结果
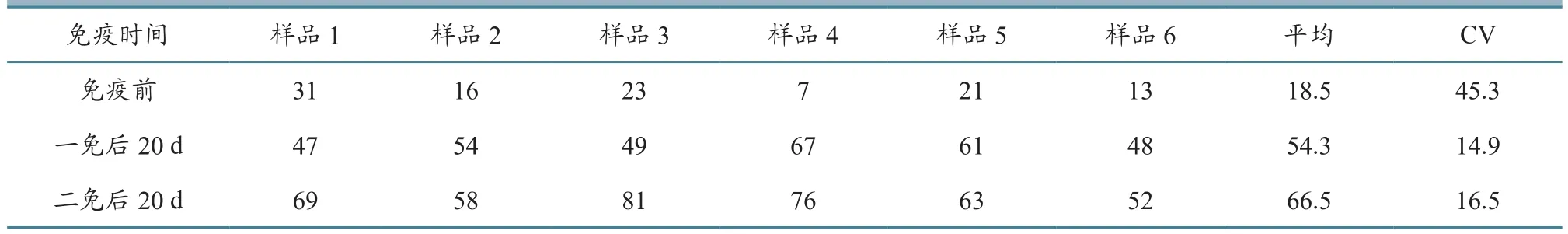
表7 同时免疫后CSFV抗体(阻断率)监测结果 单位:%
3 讨论
本次安全性试验和调查表明,高致病性PRRSV弱毒疫苗(TJM-F92株)对母猪免疫后,无论采食量、体温、返情率及死胎与木乃伊胎产生率均无变化,说明高致病性PRRSV弱毒疫苗(TJM-F92株)具有良好的安全性,这与王科文[4]的研究结论一致。

表8 同时免疫后PRRSV抗体(S/P)监测结果
利用高致病性PRRSV弱毒疫苗(TJM-F92株),按规定程序每头猪1头份肌内注射,可使各个阶段猪群均产生有效保护力,因此在实际应用中,不需加大免疫剂量。
传统理论认为,不同病毒疫苗同时免疫会产生干扰作用[5-6]。杜喜忠等[7]认为PRRSV弱毒苗和CSFV疫苗同时免疫的相互干扰影响最大。但本次试验发现,同时免疫高致病性PRRSV弱毒疫苗(TJM-F92株)和CSFV冻干疫苗的免疫效果与分开免疫并无差异,不会相互影响,由此认为高致病性PRRSV弱毒疫苗(TJM-F92株)与CSFV疫苗间的相互免疫抑制作用较小,可以在现场生产中优化免疫程序,实施同时免疫,从而节省人力,减少猪群应激。
因为PRRSV的发病机理以及免疫机制非常复杂,不同的试验条件、不同的试验猪群所得到的结果可能不尽相同,所以本试验结果具有一定局限性,需要后续开展系统试验进行验证。
4 结论
本次研究发现:高致病性PRRSV弱毒疫苗(TJM-F92株)具有优秀的安全性,可以对母猪进行普免,不会引起不良反应,对各阶段猪群均可产生有效保护,有效性较好;高致病性PRRSV弱毒疫苗(TJM-F92株)与CSFV疫苗同时免疫不会产生相互干扰,因而猪场可以尝试优化免疫程序,对两种疫苗同时免疫,以减少应激,节省人力。

