实验动物支气管鲍特杆菌检测能力验证结果与分析
邢 进 冯育芳 王 洪 岳秉飞
(中国食品药品检定研究院,实验动物资源研究所,北京 102629)
能力验证(Proficiency Testing)是利用实验室间比对,按照预先制定的准则评价参加者的能力。作为重要的外部质量评价活动,寻求并参加能力验证是合格评定机构的责任和义务。合格评定机构应结合自身需求参加能力验证以证明其技术能力[1]。中国食品药品检定研究院(以下简称中检院)作为CNAS能力验证提供者(Proficiency Testing Provider,PTP)已在实验动物质量检测领域开展了包括病毒[2-4]、细菌[5-7]和遗传[8-9]在内的多项能力验证活动。我们通过此前的能力验证活动积累了一些经验,得到了全国实验动物质量检测机构的支持。2017年,中检院依据CNAS-RL02《能力验证规则》和CNAS-RL03《能力验证提供者认可准则》(ISO/IEC 17043∶2010)[10]运作NIFDC-PT-107“实验动物呼吸道样品中支气管鲍特杆菌检测”的能力验证工作。支气管鲍特杆菌是感染实验动物的一种重要的呼吸道病原菌[11],大鼠、豚鼠和兔等易感,引起支气管肺炎症状[12],在实验用猪中是引发猪萎缩性鼻炎的主要病原之一[13]。通过对支气管鲍特杆菌的检测能力验证,初步评价参与实验室对实验动物呼吸道细菌的检测能力。现将本次验证的总体情况报道如下。
1 材料与方法
1.1 菌种
支气管鲍特杆菌(Bordetellabronchiseptica)ATCC 19395,产气巴斯德杆菌(Pasteurellaaerogenes)ATCC 27883,大肠杆菌(Escherichiacoli)CMCC 44110分别购自美国模式培养物保藏中心(ATCC)和中国医学菌种保藏中心(CMCC),三株标准菌株用作本次能力验证菌株,本实验室保存。
1.2 培养基及试剂
血琼脂培养基(Oxiod),DHL琼脂(北京三药科技开发有限公司),葡萄糖、蔗糖、三糖铁、靛基质、尿素、半固体等生化鉴定培养基(北京三药科技开发有限公司),API 20E生化鉴定条(梅里埃),革兰阴性细菌鉴定板(BD、Vitek),无菌脱纤维羊血(北京路桥技术股份有限公司)。
细菌保护液基础液(本院食品化妆品检定所提供)加入10%无菌脱纤维羊血制成此次比对样品保护液。
DNA提取试剂盒(Qiagen),DNA聚合酶(TAKARA),琼脂糖(TAKARA)。革兰氏染色液(梅里埃);兔抗支气管鲍特杆菌免疫血清由本实验室制备。
1.3 主要仪器
生物安全柜(Thermo Scientific A2)、恒温培养箱(Thermo Scientific Heratherm)、全自动细菌鉴定仪(BD Phoenix-100、梅里埃VITEK 2 Compact)、冷冻离心机(Hettich)、冻干机(Labconco)。
1.4 菌株的培养与鉴定
三株验证用菌种分别划线接种于血琼脂平皿(5%脱纤维羊血)复苏,至36 ℃培养24 h。挑取初代培养物中单个菌落再分别转种于血琼脂平皿,相同条件培养后备用。
根据伯杰氏系统细菌学手册[14]和国家标准[15]对三株验证用标准菌株进行生化鉴定。
同时提取三种菌株的基因组DNA,扩增其16S rDNA[16],经测序后与Genbank数据库比对,验证菌株的准确性。
1.5 样品制备
将支气管鲍特杆菌、产气巴斯德杆菌和大肠杆菌分别用无菌生理盐水制成菌悬液,与保护液按1∶10比例均匀混合,制成1份阳性和2份阴性样品。样品中菌含量约为107CFU/mL。三种样品分装于螺口1.5 mL无菌冻存管中,冷冻干燥,最终每管内固体含量约为50~120 mg/管。三种能力验证样品通过“国家认证认可监督管理委员会实验室能力验证平台”(http://nlyz.cnca.cn/lab/index.jsp)随机分组编号,每组3管样品,包含1管阳性和2管阴性样品,即包括支气管鲍特杆菌(阳性)、产气巴斯德杆菌(干扰阴性)和大肠杆菌各1管。实验室无法通过样品编号识别组别,可防止实验室间对结果的相互自行比对。
1.6 样品检验
1.6.1均匀性检验:在已制备的三种样品中分别随机抽取10管样品进行均匀性检验,每管样品重复测试2次。参照作业指导书和国家标准,在样品管中加入500 μL灭菌水,充分混匀。取10 μL样品悬液用灭菌生理盐水10倍梯度稀释至10-6,取稀释至10-5和10-6的样品液各100 μL均匀涂布于血琼脂平皿。36 ℃培养24 h,观察并计算菌落数。
1.6.2稳定性检验:设置五个温度条件(37 ℃、23 ℃室温、4 ℃、-20 ℃和-80 ℃),每种温度放置20组样品,检测样品在各温度下的稳定性。37 ℃和23 ℃室温中样品每天取样,4 ℃中样品每3天取样,-20 ℃中样品每周取样,-80 ℃中样品每月取样。参照作业指导书和国家标准,将样品管中加入500 μL无菌水,用10 μL接种环接种一满环菌液涂布于血琼脂和DHL琼脂上,36 ℃培养24 h,观察是否有足量的可见典型菌落生长。
1.6.3样品中杂菌的鉴定:制备样品所用组分未经过灭菌处理,除比对用标准菌株外,其中可能含有其他环境中的细菌。将空白细菌保护液接种于血琼脂平皿,36 ℃培养24 h,对生长出的杂菌进行鉴定。
1.7 样品的包装和运输
1.5 mL螺口样品管外层用封口袋包装,置于适宜大小的干冰泡沫箱中,冷链快递至参加实验室。
1.8 参加实验室
全国共25家实验室报名参加本次能力验证计划,均如期反馈结果。其中各级实验动物检测机构16家,省级疾病预防控制中心实验室1家,药检系统实验室1家,科研院校实验室6家,企业实验室1家。实验室所在地区分布见表1。
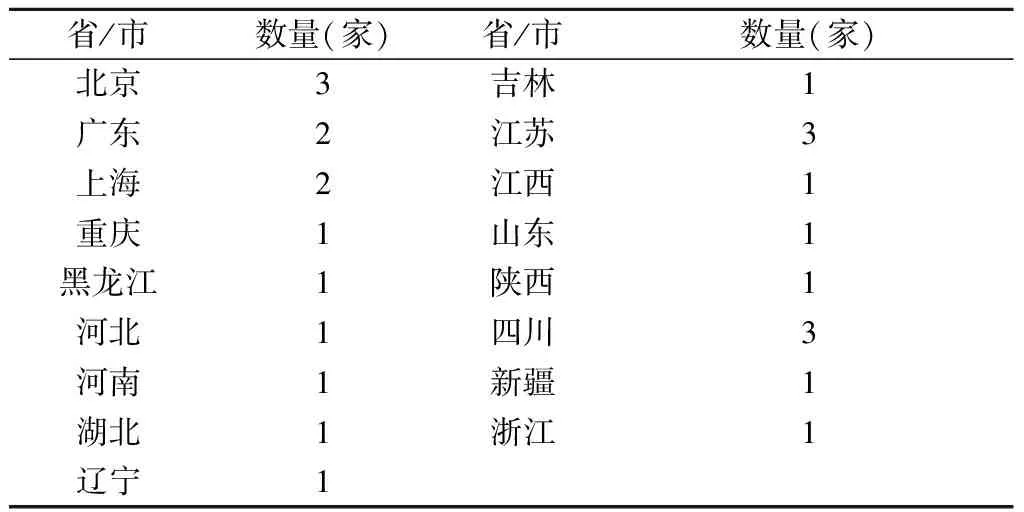
表1 参加实验室所在地区分布Table 1 Region of participating laboratories
1.9 检测方法和报告
本次能力验证未规定测试方法,可参考标准中的检测方法[13,15]。要求在收到样品后10个工作日内反馈结果,并在规定期限内提交完整的检测报告。
1.10 结果评价原则
本次计划中,每个实验室得到3份样本,3份样本的测定结果与标准结果完全一致时,即判定为满意结果;任何1份样品的测定结果与标准结果不一致时,即判定为不满意结果;实验室如未按时限反馈结果,亦判定为不满意结果。
2 结果
2.1 菌株鉴定
三株验证用菌株的菌落和菌体形态均符合各自特征。支气管鲍特杆菌在血琼脂上形成1 mm左右、灰白色、长时间培养可见轻微α溶血的菌落;革兰氏阴性短杆菌;在DHL培养基上能够生长,形成约2 mm无色半透明菌落。大肠杆菌在血琼脂上形成1~1.5 mm左右,灰白色略扁的菌落,不溶血;革兰氏阴性小杆菌,两端钝圆浓染;在DHL培养基上形成粉红色中等大小菌落。产气巴斯德杆菌在血琼脂上形成1.5 mm左右,灰白色圆润的菌落,不溶血;革兰氏染色阴性小杆菌,两极钝圆浓染;在DHL培养基上生长,形成粉红色中等菌落。
采用国家标准中的鉴定方法、API 20E、BD和Vitek细菌鉴定仪的鉴定结果准确、一致。血清凝集实验仅支气管鲍特杆菌与诊断血清发生凝集。16S rDNA序列比对结果与设定菌株相符。鉴定结果见表2。

表2 三种菌株鉴定结果Table 2 Identification result of three tested strains
注:A产酸(黄色),K产碱(红色);W弱反应
Note: A: acid (yellow); K: alkaline (red); W: weak reaction
2.2 均匀性
三种样品在血琼脂平皿上的菌落数均达到1×107以上的预期指标,满足均匀性要求。见表3。
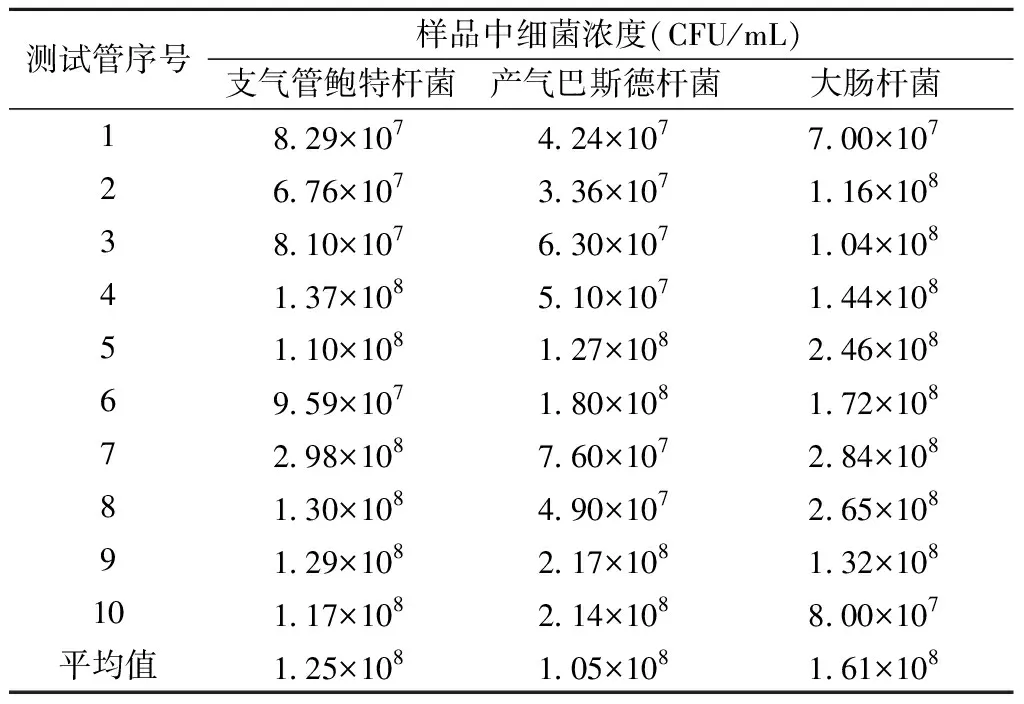
表3 三种样品均匀性验证结果Table 3 The homogeneity verification resultsof three kinds of samples
2.3 稳定性
三种样品在不同存放温度下定期取样,所制备样品在37 ℃条件下可稳定存放20 d,23 ℃室温下可稳定存放40 d,4℃下至少可稳定存放60 d,-20 ℃下至少可稳定存放180 d,-80 ℃条件下至少可稳定存放240 d。
2.4 杂菌鉴定
空白细菌保护液经培养后,在血琼脂上可见有两种杂菌生长,一种为1 mm左右白色菌落,不易乳化;革兰氏阳性短杆菌,呈梭形。另一种为1 mm左右黄色菌落,革兰氏阳性双球菌。经BD细菌鉴定仪鉴定,分别为格氏乳球菌(Lactococcusgarvieae)和变异库克菌(Kocuriavarians)。
2.5 结果反馈
根据结果评定标准,获满意结果的实验室22个,占参加单位的88%;不满意结果有3个,占参加单位的12%。不满意结果中,两个实验室漏检阳性样本结果,结果全部为阴性;另一个实验室将阴性干扰样品检为阳性。
3 讨论
3.1 方法的选择
在依据国家标准检测支气管鲍特杆菌时,血琼脂上初代菌落的α溶血现象常不甚明显,因此初代培养时以培养至40 h以上为宜。在初代培养时,同时接种DHL琼脂平皿有助于可疑菌落的筛选。采用培养法时,根据CNAS-CL09[17]要求需对购置的或自制的培养基进行质量控制。即用标准菌株验证相关培养基和试剂的有效性,避免培养基和试剂原因导致的培养和鉴定失败。
如不采用国家标准中的分离培养方法,PCR方法可以快速得出结果[18-20]。PCR方法已经写入猪病检测的行业标准,用于检测传染性萎缩性鼻炎中支气管鲍特杆菌的诊断[13],效果优于分离培养法[21]。本次能力验证参加实验室主要采用的仍是分离培养和生化鉴定的方法。两个实验室采用了PCR方法,且其中一个为荧光定量PCR方法,均获得了准确的结果。
3.2 不满意结果原因分析
通过查验不满意实验室原始记录和报告,检测错误的主要原因可能为操作时污染、可疑菌挑取错误、生化鉴定错误和原始记录记录不祥等几个方面。对样品的检测操作应在生物安全柜中操作,避免各种污染引入。处理样品时,应分装保留部分样品以备复检。熟知阳性菌落的形态和特征对挑取可疑菌至关重要,根据血琼脂和DHL琼脂培养基中的特征形态,充分挑取足够数量的可疑菌落,可以避免漏检。对于可疑菌的生化鉴定,本次比对中有19家单位采用的是手工生化检测,其中9家实验室在原始记录中未注明所使用生化试剂的品牌或来源,使用质量不稳定的生化试剂很可能误导检测结果的判断。有三个实验室采用自动生化鉴定仪,一个采用梅里埃API生化鉴定条,结果均准确。与此前能力验证情况相似,相比纯手工生化鉴定,采用自动细菌鉴定仪或鉴定条可以获得更准确、稳定的结果。值得注意的是支气管鲍特杆菌检测可能得出动力阴性的结果。主要原因是支气管鲍特杆菌在半固体培养基中延穿刺线生长缓慢,培养至7 d比较稳妥[22]。原始记录是反映实验结果的第一手资料,是对检测活动的客观反映,有助于检测结果的追溯。原始记录不详或者错误,可直接导致错误结论。
3.3 总结
一次能力验证的结果只能证明参加者在本次能力验证活动的情况,不能说明其正常的检测水平,只有持续参加同一项目的能力验证活动,其总体结果才能反映实验室的检测能力状况[1]。截止到本次能力验证,连续参加4次及以上的有14家单位,表明实验动物细菌能力验证活动已经得到了全国业内的认可。
本次验证中出现一例样品管破碎情况。经确认后对样品进行了补寄。样品破碎原因可能是由于干冰致使样品管变脆后受挤压导致。提示对样品管的材质应有更高的要求,也督促我们进一步完善和改进实验动物能力验证计划,努力提高能力验证样品的质量,促进实验动物质量检测事业更好发展。

