废弃药渣中青霉素钠降解菌的筛选
张永芳,周玉兴,张东旭,张 剑
(山西大同大学生命科学院,山西大同037009)
无论生物合成法还是生物化学合成法制成抗生素都会产生大量的废弃药渣。废弃药渣的主要成分是微生物菌丝体、其他营养物质以及残留的抗生素,所遗留的抗生素占抗生素药渣的3%~5%[1]。将抗生素药渣直接晾干后作为牲畜食物,不仅减少浪费,而且对饲养业的发展起到了良好的影响。由于抗生素药渣中含有的大量的有机物质和少量无机物,所以废弃药渣也被用来作为土壤肥料,并且得到了良好的效果[2-3]。但是,由于废弃药渣中含有少量的抗生素,将药渣作为肥料施在土壤中,相当于直接将抗生素排入土壤中。药渣作为牲畜饲料,也不能被动物肠道酶完全分解,通过粪便和尿液排入土地中,进而进入地表水,地下水[4-7]。大量报道指出地下水中抗生素严重超标[8]。所以,抗生素药渣作为再次资源利用时,首先要去除其残留的抗生素。目前处理残留抗生素的主要方法是物理、化学手段,所用方法周期长、成本高、效率低。尽管有利用降解菌降解抗生素药渣方面的研究但只是停留在实验室中,而是否适合自然环境中废弃药渣的治理,尚需解决。马玉龙等[9]人,提取出了降解泰勒菌素的菌株。刘力嘉等[10]对其降解能力进行了分析。说明土壤中的确有分解抗生素的微生物。微生物分解抗生素的方法由于快速、彻底、方便、环保。成为分解抗生素方法中的首选,也是我国制药工业可持续发展战略的要求,更是发展循环经济,搞好末端治理建设、建成环境友好企业的重要保障。
青霉素是从青霉菌培养液中提制的分子中含有β-内酰胺环的化学物质,能抑制革兰氏阳性细菌的细胞壁中肽聚糖的合成,故而抑制细菌细胞的指数期的生长。由于β-内酰胺类作用于细菌的肽聚糖,而不作用于动物细胞,故青霉素类抗生素不影响动物细胞生长发育。但是在自然界中,青霉素钠不易被分解,造成了严重的土壤污染和水体污染。所以,药渣中残留的青霉素钠需要利用微生物进行降解。少数研究者从各种实验材料中提取出了青霉素钠降解菌。如岳喜庆等[11]人从自制面肥中提取到一株青霉素钠降解菌,属于霍氏肠杆菌。韩磊等[12]从某制药厂污水处理站的活性污泥中筛选出2 株处理青霉素废水高效降解菌K1 和K2,并进行单菌株与混合菌株对青霉素降解特性实验,结果表明,混合菌株降解效果比单菌株降解效果好。目前关于长期堆放药渣的过程中土壤中是否会产生青霉素降解菌的研究几乎没有。本实验拟利用大同市威奇达药厂提供的青霉素钠废弃药渣为材料,经过在土壤中长期堆放,通过筛选、驯化等手段建立降解该药厂各种抗生素的降解菌资源库,从中筛选出快速降解青霉素钠,并以青霉素钠为唯一碳源的的复合菌株,以找到用微生物方法原位治理药渣残留抗生素的方法与技术,为抗生素药渣资源再利用奠定科学理论基础,为其它抗生素废弃药渣废水综合治理提供技术支撑,开辟制药企业废弃物合理利用的新途径。
1 实验材料
1.1 药渣
大同市威奇达药厂提供的青霉素钠废弃药渣。
1.2 土壤
大同大学校园内取土。
1.3 缓冲液
pH=7.0,磷酸二氢钠-磷酸氢二钠缓冲液。
1.4 培养基
驯化培养基(按周期有4种不同的驯化培养基)见表1。
LB 培养基:胰蛋白胨10 g,酵母膏5 g,NaCl 10 g,用蒸馏水定容至1 L。
1.5 仪器
Apr-80大容量离心机(广州沪瑞明仪器有限公司),UV-1200紫外、可见分光光度计(北京尼雅科技有限公司),HPX-9272MBE 数显电热培养箱(上海联德科教仪器设备有限公司),SH2-82水浴恒温振荡器(上海博讯实业有限公司医疗设备厂),SPX-1508-Z 生化培养箱(江苏天由有限公司),SW-CJ-2F 洁净工作台(上海博讯实业有限公司医疗设备厂),HZQ-F160 全温震荡培养箱(江苏太仓市实验仪器厂),LS-75LJ 立式压力蒸汽灭菌器(江阴滨州实验仪器厂)。
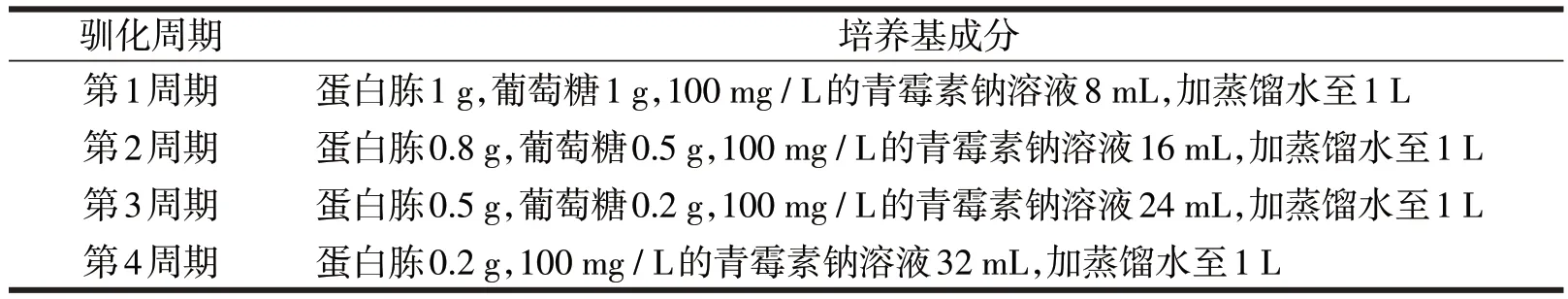
表1 驯化培养基的配制
2 实验方法
2.1 药渣堆放
取青霉素钠药渣置于土壤之上堆放,并且每隔1周在土壤周围施一次50 mg/L青霉素钠溶液保持土壤湿润。持续堆放30 d。
2.2 取土壤浸出液
称取土壤样品10 g,90 mL的pH=7.0的磷酸缓冲液,在水浴恒温振荡器震荡24 h,打散土壤样品,然后过滤,取土壤浸出液。土壤浸出液中含有待筛选的青霉素钠降解菌。
2.3 废弃药渣中青霉素钠降解菌的筛选与驯化
2.3.1 接种
以10%的接种量将土壤浸出液中的菌样接入基础培养基中,即取10 mL 土壤浸出液接入90 mL培养基中,在37 ℃、120 r/min 的立式全温震荡培养箱中培养72 h。
2.3.2 菌种驯化
菌种驯化共有4 个周期(见表2),每个周期120 h。取10 mL筛选出的菌种移入90 mL第1周期的驯化培养基中,在37 ℃、120 r/min 的立式全温震荡培养箱中培养120 h。然后,取10 mL培养液移入90 mL第2周期的驯化培养基中。第3、4周期同上。驯化培养基逐渐增加青霉素钠含量并相应减少葡萄糖和蛋白胨的含量,从而筛选出能在高浓度青霉素钠环境中生长并且以青霉素钠为主要营养物质的菌种。

表2 青霉素钠降解菌的驯化
2.3.3 菌种筛选
配制LB固体平面培养基并同时加入1 000 mg/L青霉素钠,倒平板,待凝固后,将第4 驯化周期得到的培养液D1和D2分别用稀释涂平板法涂到培养基上,37 ℃恒温箱中培养。
2.3.4 菌种分离与纯化
混合菌种在LB 固体平面培养基中培养72 h。之后,对筛选出的菌种进行平板划线分离。直至培养出单个菌落。并且每隔一段时间观察菌落的形态。
2.4 培养时间与青霉素钠浓度的关系
将筛选出的青霉素钠降解菌接种到含1 000 mg/L青霉素钠的LB 液体培养基中,按照时间的推移,每隔1 d 检测一次青霉素钠的浓度,并绘制其降解曲线。
2.5 培养温度与青霉素钠浓度的关系
将筛选出来的青霉素钠降解菌接种到含1 000 mg/L青霉素钠的LB 液体培养基中,分别放置到27、30、34、37、40、45 ℃的恒温震荡培养箱中进行培养72 h。之后测定培养基中青霉素钠的浓度,以分析培养温度对青霉素钠降解菌降解能力的影响。
3 结论
3.1 划线分离得到的菌落的形态特征
划线分离最终得到2 种菌落。在LB 固体平面培养基上,第1 种菌落为直径1 ~4 mm 的圆形菌落,表面湿润,光滑,中间隆起,乳白色,边缘整齐。第2种菌落为直径1 ~2 mm的圆形菌落,表面湿润,光滑,中间隆起,淡黄色。可以初步判定两种菌株都是细菌。将第一种菌种命名为Q1,第二种菌种命名为Q2。
3.2 菌种驯化各周期剩余青霉素钠含量
每个驯化周期(120 h)过后检测培养基中青霉素钠的浓度。
检测方法:通过前人研究得知青霉素钠磷酸盐溶液在228 nm 下有最大吸收波长。在228 nm 波长下, 以磷酸缓冲液为空白对照,分别测0.025、0.05、0.075、0.1、0.125、0.15 mg/ mL 浓度的青霉素钠磷酸盐溶液的吸光值,以青霉素钠浓度为横轴,以吸光度值为纵轴,得到回归方程,y=43.693x+0.057 4。如图1所示。取15 mL的培养基离心得到上层透亮液体。将上层透亮液体与pH=7.0的磷酸二氢钠-磷酸氢二钠缓冲液以1∶1 的比例混合,得到青霉素钠磷酸盐溶液,并且稀释10倍,在228 nm波长下测其吸光度值,根据方程计算青霉素钠的浓度。
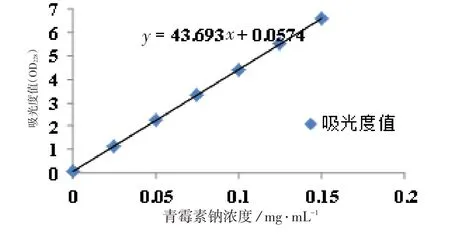
图1 青霉素钠浓度与吸光度的关系
驯化过程中青霉素钠降解菌的降解效果如表3所示。
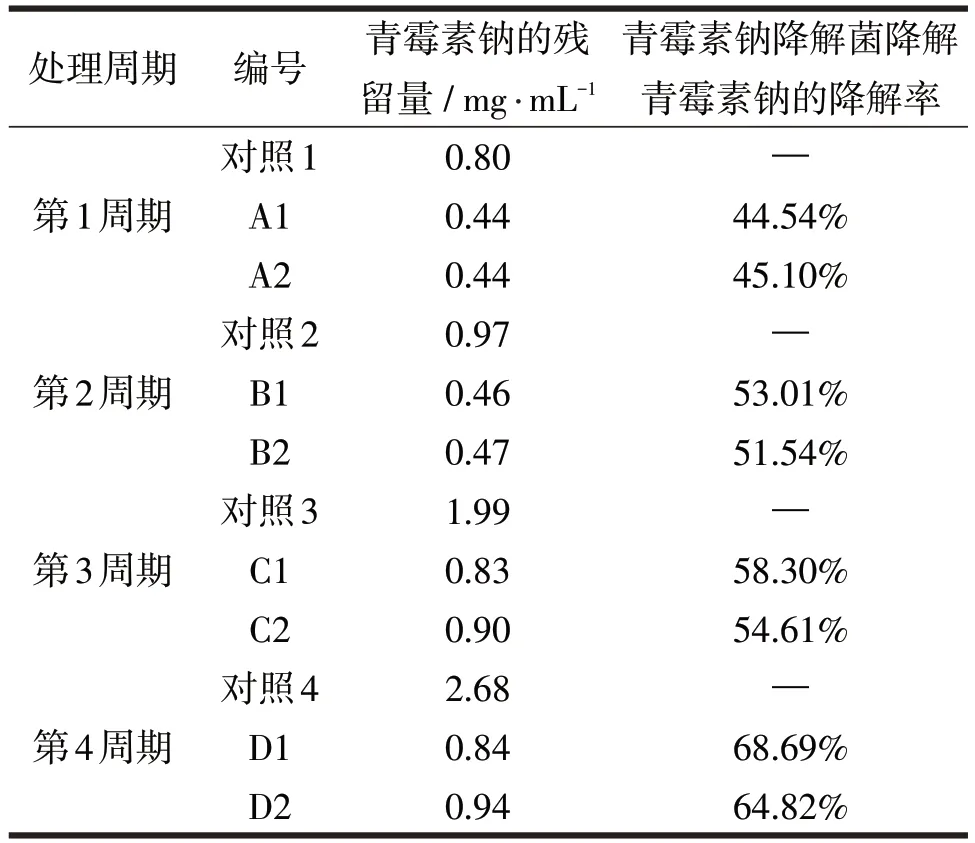
表3 驯化过程中所得到的菌株对青霉素钠的降解效果
由表3知:第1 ~3周期的培养基中含有葡萄糖和蛋白胨作为青霉素钠降解菌的主要的碳源和氮源,第4周期的培养基中不加葡萄糖只加少量蛋白胨,并且青霉素的含量越来越高。从表中得知青霉素钠的降解率从第1 驯化周期的45%(取2 个处理组的平均值)到第4 驯化周期增加至67%,说明青霉素钠降解菌的降解效率随着菌种驯化的进行不断变高。并且,以D1组的讲解效果最佳。另外,在第4周期中并未添加碳源,只添加了少量蛋白胨作为氮源,并添加了较高含量的青霉素钠。结果可知第4周期青霉素降解量较高,说明青霉素钠降解菌可以青霉素钠作为唯一的碳源进行生长和繁殖。
3.3 培养时间对青霉素钠浓度的影响
将筛选得到的能在较高浓度青霉素钠下生存并且降解青霉素钠的菌种在液体培养基中进行培养,每隔24 h测定青霉素钠浓度。见图2。
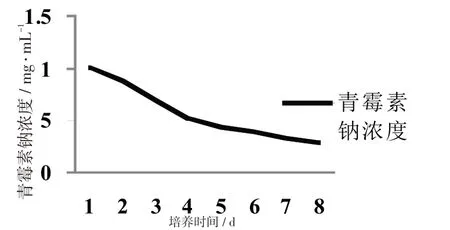
图2 青霉素钠浓度与培养时间的关系
由图2 实验数据可知在37 ℃,120 r/min 的条件下培养,青霉素钠的浓度随着时间的增加逐渐降低,不同时间段内下降速度不同,1 ~4 d 内青霉素浓度下降快,4~6 d青霉素钠浓度下降较快,6~8 d内青霉素浓度下降缓慢。第8 d时青霉素降解率达到70.94%。分析原因:1 ~4 d 青霉素钠浓度下降快,可能是因为青霉素钠降解菌在高浓度青霉素钠中需要一定量的青霉素钠作为底物诱导青霉素降解酶的产生;4 ~6 d 青霉素浓度下降较快,可能是因为青霉素钠降解菌产生的酶量增加降解的青霉素钠含量也增加;6 ~8 d 青霉素钠浓度下降缓慢,有可能是因为青霉素钠降解酶含量达到最高值青霉素钠降解量达到最大。所以,以4~6 d内降解能力最为稳定,易检测;第8 d青霉素钠降解率最高。
3.4 培养温度对青霉素钠浓度的影响
将筛选得到的菌种以10%的接种量接种到含1 000 mg/L青霉素钠的LB培养基中,分组,分别放置在不同温度的恒温震荡培养箱中,72 h后分别检测各组培养基中的青霉素钠浓度,结果如图3所示。
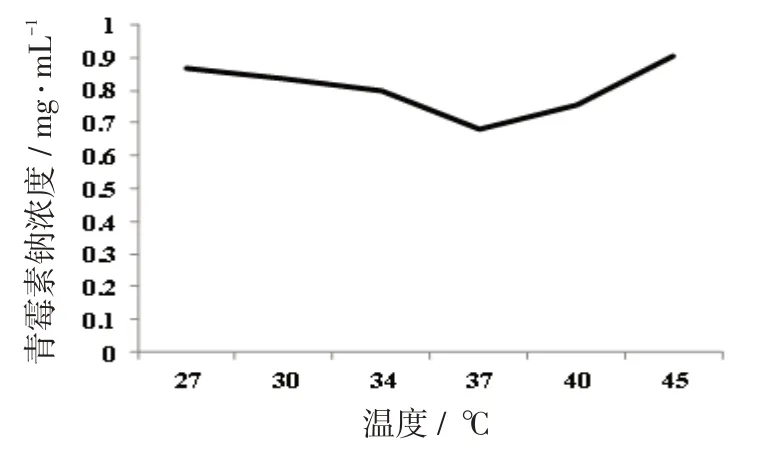
图3 青霉素钠浓度与培养温度的关系
由实验数据可知,培养温度不同青霉素钠的浓度也不相同,青霉素钠浓度并不是随温度的增高而降低。培养温低于37 ℃时,增高温度,青霉素钠的降解量随温度的增高而增加,37 ℃时降解量最大,之后青霉素钠的降解量随温度的增加而降低。分析原因是影响降解效率的因素是青霉素钠降解菌产生的青霉素降解酶催化活性受温度的影响。酶的催化活性在低温时受抑制。温度过高会破坏酶分子的结构,从而影响酶的活性。37 ℃时青霉素钠降解菌的降解效率最高。所以,37 ℃为最有利于青霉素钠降解菌生长的温度。
4 讨论
青霉素由青霉菌产生。产生的药渣成分主要是青霉菌的菌丝体,也有极少部分青霉素。利用青霉素钠作为二次利用资源时,首先要除去其中残留的青霉素钠。
本实验通过长期堆放青霉素钠药渣,最终得到了2株降解青霉素钠的优良菌株。通过4个驯化周期提高了青霉素钠降解菌的降解性能,表现为对青霉素的降解效率越来越高,对青霉素的耐受能力也逐渐增强。并且最终得到了可以以青霉素钠作为唯一碳源进行生长繁殖的青霉素钠降解菌。经过实验得到混合菌株的最合适培养温度是37 ℃。将混合菌株在37 ℃,120 r/min的条件下培养4 ~6 d内降解能力最稳定,培养至8 d 时降解率可达到70.94%。
马玉龙等[9]从土壤中提取出了泰乐菌素降解菌,该菌株以10%的接种量,在30 ~35 ℃,PH 为7 的条件下,处理泰乐菌素药渣120 h 后,无法检测出泰乐菌素的存在。本实验青霉素钠最高降解率仅达到70.94%。分析原因,可能是由于抗生素的种类不同导致的,也可能是由于实验条件不同导致的。岳喜庆等[11]从自制面肥中提取到一株青霉素钠降解菌株,该菌株在37 ℃培养9 h 后,可将含有0.01 mg/mL 的青霉素钠的培养基中的青霉素钠完全降解。本实验中提取的青霉素钠降解菌降解率最高达到70.94%。分析原因,可能是由于菌种提取的原料不同导致的。自制面肥中存在的微生物种类原始与土壤中存在的原始微生物种类并不相同。所以,两个实验提取出的菌种并不相同。本实验从长期堆放青霉素钠药渣的土壤中筛选出了优质的青霉素钠降解菌株,这为青霉素钠降解菌提供了一个新的提取源,为青霉素钠的资源化利用提供了实验依据。

