短时低氧处理后表皮细胞差异表达基因及相关通路分析
燕荣帅 周鑫 陈鑫 樊东力 张一鸣
创面愈合是烧创伤的基本问题,促进皮肤创面的修复是烧创伤治疗的主要任务[1-2]。在当前的临床治疗中,创面的再上皮化是创面愈合的关键标志,表皮细胞的增殖及迁移又是创面再上皮化的重要步骤[3-5],表皮细胞的增殖及迁移在创面愈合的调控过程显得极其重要。
在急性创面早期,由于细胞的高氧耗状态,使得创面周围常处于低氧或缺氧微环境[6-7]。大量的研究已显示,这种短时的低氧微环境对创面的愈合起着极大的促进作用[8-9],但目前其具体的分子调控机制并不清楚。本研究拟采用基因芯片技术,探究短时低氧处理后表皮细胞HaCaT转录组表达调控变化,找出其关键调控因子,同时探究其可能的信号调控方式。本研究对进一步阐明皮肤创面愈合机理,并进行有效地干预、进一步促进创面愈合具有重要的作用,同时也可为促进烧、创伤创面愈合提供新的思路与策略。
材料与方法
一、细胞株及关键的试剂、仪器及电脑软件
本研究所采用的表皮细胞株为购置于中国科学院上海细胞库的人正常皮肤永生化角质形成细胞株(HaCaT细胞)。细胞培养基为美国Hyclone公司 MEM/EBSS培养基,胎牛血清(美国Gibco公司),双抗 Penicillin-Streptomycin(美国Hyclone公司)。TRIzol Reagent(美国Invitrogen公司)。反转录及Taq聚合酶等试剂盒(大连TaKaRa公司)。基因芯片[美国Affymetrix公司GeneChip®Human Transcriptome Assay 3.0(Clariom D human)]。 此外在基因芯片步骤还用到的试剂有美国Affymetrix公司GeneChip WT Terminal Labeling and Controls Kit、Ambion WT Expression Kit以及GeneChip Hybridization,Wash,and Stain Kit。基因芯片步骤中用到的仪器包括芯片洗脱工作站GeneChip Fluidics Station 450、基因芯片杂交炉GeneChip Hybridization Oven 645、基因芯片扫描仪GeneChip Scanner 3000 7G以及GeneChip GCOS软件Affymetrix GeneChip Operating Software。
二、方法
(一)细胞培养及低氧处理
HaCaT细胞采用10%胎牛血清、1%双抗的MEM/EBSS培养液,置于常规细胞培养箱中培养(37 ℃,5%CO2,10%O2,85%N2)。待细胞生长至对数生长期时胰酶消化传代,分别置于常规培养箱及低氧培养箱(37 ℃,5%CO2,1%O2,94%N2)继续培养。在放到低氧培养箱之前,细胞更换提前在低氧培养箱中放置处理的培养液。
(二)RNA提取及逆转录
待细胞在低氧或常氧条件下培养30 min后取出培养皿,在低氧条件下培养为低氧组,常氧条件下培养为常氧对照组。采用Trizol法提取两样本总RNA。其后保存于无RNA酶的EP管中,然后冻存在-80℃冰箱备用。取一管采用NanoDrop检测RNA浓度,A260/A280的比值在1.8 ~ 2.0之间为符合要求,进一步采用琼脂糖凝胶电泳检测RNA完整性。对符合要求的总RNA进一步采用逆转录试剂盒按照步骤要求进行逆转录进入下一步的实验。
(三)基因芯片的检测
本研究采用Affymetrix WT芯片推荐试剂盒GeneChip WT Terminal Labeling and Controls Kit、Ambion WT Expression Kit以及 GeneChip Hybridization,Wash,and Stain Kit,按照标准步骤对总RNA进行放大、标记及纯化,同时获取标记生物素的cDNA。按照Affymetrix表达谱芯片配套的杂交标准流程在滚动杂交炉GeneChip Hybridization Oven 645中45℃、16 h滚动杂交,杂交完成后再在洗涤工作站GeneChip Fluidics Station 450洗涤,芯片结果采用GeneChip Scanner 3000 7G进行数据扫描,进一步采用GeneChip GCOS软件Affymetrix GeneChip Operating Software读取原始数据,各项满足要求的数据采用Expression Console™Software进行归一化处理。低氧和常氧对照样本均制备3个生物学重复,并根据基因芯片扫描结果与常氧对照,利用微阵列置信度分析软件SAM筛选出显著差异基因。
(四)GO与KEGG Pathway分析
GO全称为Gene ontology,中文名为基因本体论,主要用于分析差异基因。KEGG全称为Kyoto Encyclopedia of Genes and Genomes,中文名称为京都基因和基因组百科全书。通过前期筛选出显著差异基因,将差异基因采用GO及KEGG的方法进行分析,筛选出各富集结果关键基因。
(五)qRT-PCR
使用Trizol试剂盒采用上述方法重新提取RNA,进一步按照试剂盒要求反转录。选用基因芯片中具有显著性差异的CCL20、IL6及DDIT3共3 个基因进行验证,引物由生工生物工程(上海)股份有限公司合成,序列如下表1所示。GAPDH为内参基因,相关基因表达水平采用2-ΔΔCt法进行计算。

表1 各基因引物序列
三、统计学分析方法
为了统计显著差异的基因,对每个基因以1个统计量衡量其在相应的低氧情况下与常氧条件下之间的相关程度,然后模拟统计量在随机状态下的分布情况,结合低丰都基因方差的影响及基因间的相关性,进一步通过调整统计量的计算与显著性评判方法来得到基因的显著性水平。关于误判率的控制,通过调整多重检验的P值,通过构建一系列离散化拒绝域的方法来计算Q值并以此进行。
在GO和KEGG分析中,采用统计检验的方法计算每个GO条目中差异基因富集的显著性,按照生物学过程、细胞组成以及分子功能3个方面列表注释。进一步通过KEGG数据库,对通路显著性分析,统计出各条目基因数目。以P< 0.05为差异具有统计学意义。
结 果
一、 差异基因筛选结果

图1 表皮细胞经过低氧处理30 min后各RNA相关表达基因聚类
采用Clariom D human基因芯片对低氧处理30 min与常氧条件下差异进行了分析,通过分析,其mRNA、lncRNA、microRNA以及small RNA聚类结果如图1所示。所有图中颜色反映相对表达水平,红色代表高表达,绿色代表低表达,从图中可以看出各样本均能得到较好的聚类。进一步分析显示,低氧处理0.5 h后,与对照组相比,上调基因数目为5 416个,下调基因数目为5 060个,其中上、下调大于1.2倍且P< 0.05的基因数分别为3 866、4 181个,mRNA、lncRNA、microRNA、small RNA以及其他类别上、下调数目如表2所示,表达倍数排前20的基因如表3所示。从表3中可以看出,上下调表达倍数排前20位的基因中与炎症及转录调控有重要关系的基因占大多数。
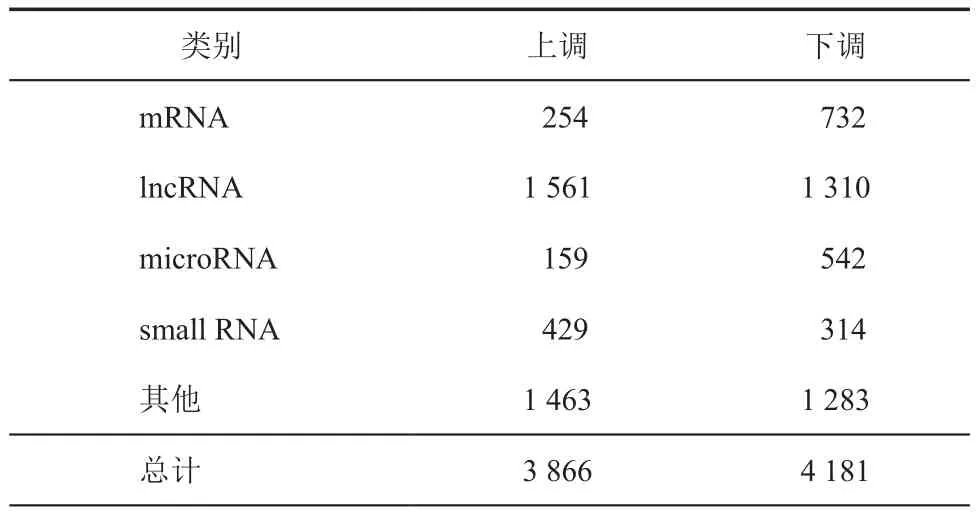
表2 基因芯片检测差异基因数目情况
二、GO及KEGG Pathway分析结果
对所有差异基因采用GO及KEGG进行分析,GO分析结果显示,迁移调控相关基因、氧化应激、细胞凋亡、炎症及免疫反应等相关基因具有显著性差异。因此,GO结果中反应出,短时低氧微环境在表皮细胞的迁移运动、炎症等反应中起着极其重要的作用。差异表达基因主要的GO分析结果如下表4,从各条目富集到的基因情况可以看出,DDIT3、CCL20以及IL6基因出现频率较高。进一步对差异基因进行KEGG分析,结果如表5所示,KEGG结果显示TNF、IL-17以及细胞因子等结果具有显著性差异,此外,从表中也反应出CCL20、IL6以及DDIT3在低氧条件下表皮细胞调控中扮演着重要的作用。综合GO及KEGG结果,可以看出DDIT3、CCL20以及IL6基因是低氧条件下表皮细胞的重要调控分子,具有重要的研究价值。
三、 芯片结果验证
采用qRT-PCR技术对芯片结果中显著性差异基因进行验证。通过分析表达倍数差异发现,qRT-PCR结果与基因芯片结果表达趋势一致,结果如图2所示。这进一步说明基因芯片数据的有效性。
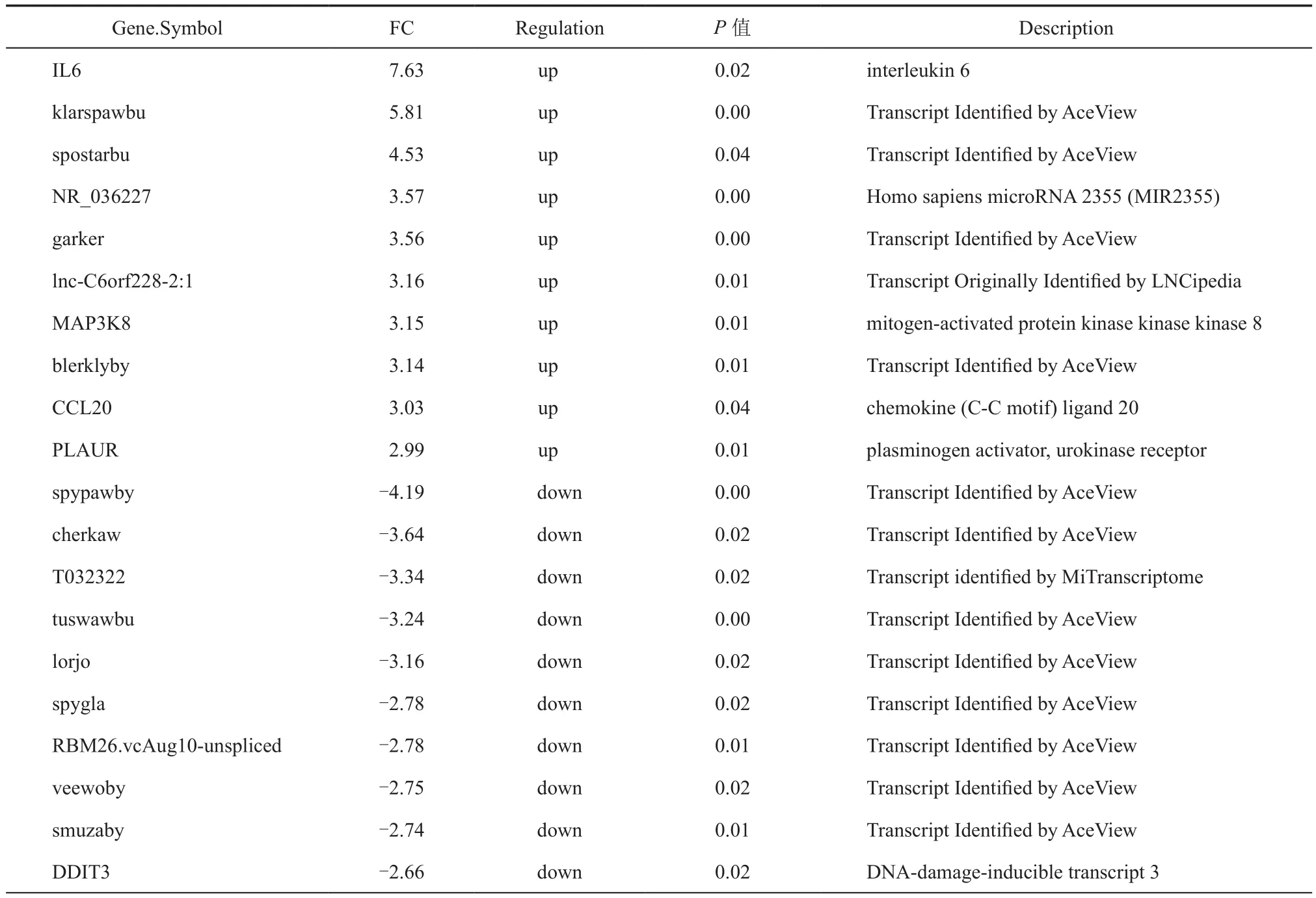
表3 上下调排前10位的基因情况

表4 差异表达基因主要GO分析结果
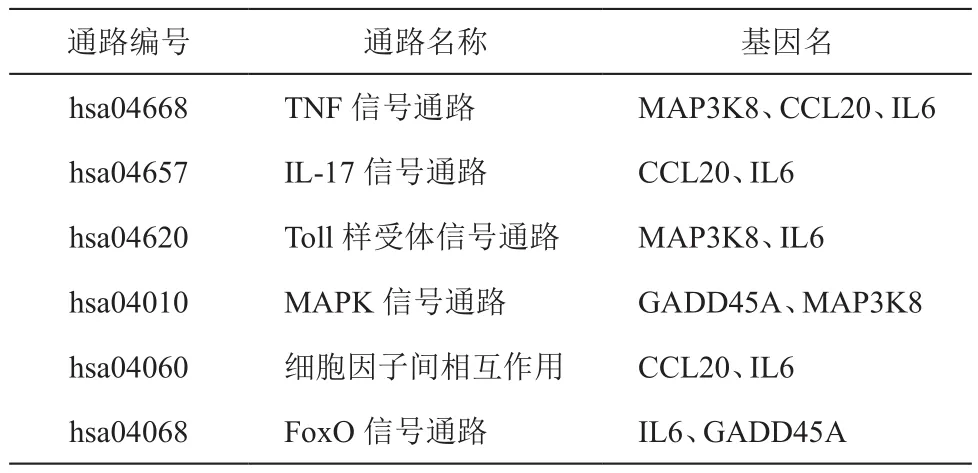
表5 差异基因主要的KEGG分析结果
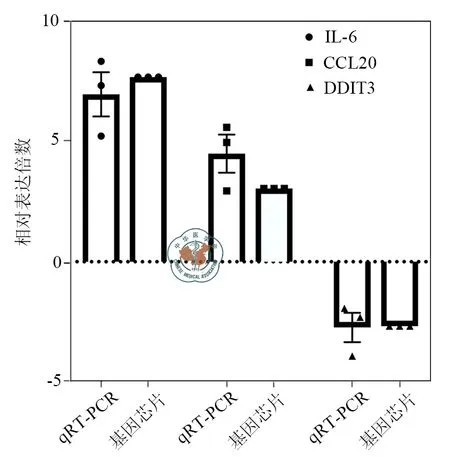
图2 基因芯片与qRT-PCR检测结果对比
讨 论
表皮细胞是创面愈合的关键,对其习性行为的研究对了解创面愈合过程,促进创面愈合具有极其重要的意义[10]。在急性创面早期,由于创周细胞的高氧耗状态,使得创面微环境常处于低氧或缺氧微环境。大量的研究已经显示,创面低氧微环境对创面表皮细胞的习性起着重要的调控作用,但具体分子作用机制尚不清楚。本研究对短时低氧处理前后表皮细胞HaCaT转录组表达差异进行了探讨。其结果显示炎症、细胞迁移及转录调控相关基因在低氧微环境下表皮细胞的调控中起着极其重要的促进作用。进一步GO以及KEGG分析发现,DDIT3、CCL20以及IL6基因在相关调控中起到极其重要的作用。
趋化因子是一种小分子的多肽,与细胞膜表面上G蛋白偶联受体结合,在各种细胞调控及免疫应答中发挥作用,使细胞发生向刺激物方向定向运动[11-12]。趋化因子CCL20是β趋化因子家族一员,最早是在巨噬细胞上清液中发现,主要表达于肝、结肠和皮肤等组织,在皮肤组织中主要存在于角质形成细胞、成纤维等细胞中[13-14]。已有研究显示,人外周血单核细胞在1%O2条件下处理16 h后CCL20呈现高表达趋势,且CCL20的转录受免疫相关基因IL-6、IL-23等的调控,它与肿瘤的侵袭转移密切相关[15];也有报道显示,CCL20还可以促进具有过表达受体CCR6的HepG2细胞形成伪足,增强其迁移能力[16]。本研究也通过基因芯片技术发现表皮细胞中短时低氧促进CCL20的表达,同时也发现IL-6的高表达,在芯片数据中还发现细胞迁移相关的基因呈现出较高表达趋势。课题组前期的研究显示,低氧条件下表皮细胞迁移能力增强[7]。本次基因芯片分析的结果也进一步证实了前期研究,同时也发现低氧条件下表皮细胞受IL-6等调控影响CCL20表达进而调控表皮细胞迁移,对创面愈合起着极其重要的作用。
创面表皮细胞的迁移是创面愈合的一个重要步骤,本研究发现这些细胞迁移相关基因呈现出高表达趋势;在课题组前期的研究过程中,采用划痕实验及活细胞工作站实验也发现,在短时低氧条件下表皮细胞迁移能力明显增强[7],结合本次芯片分析结果,提示低氧导致的CCL20增高可能是表皮细胞迁移调控在创面愈合中发挥重要作用的关键。在基因芯片结果中,除IL-6及CCL20呈现出高表达以外,DNA损伤诱导转录因子3(DDIT3)呈现出明显的低表达,且对低氧条件下表皮细胞的调控起着关键的作用。DDIT3是转录因子C/EBP家族中的一员,在各种如药物影响等DNA损伤处理中出现高表达,诱导细胞凋亡、促进分化及周期阻滞发挥作用[17-18]。然而,在本研究中发现,在短时低氧处理条件下,DDIT3出现明显低表达,且DDIT3参与低氧条件下表皮细胞的关键调控中。因此推测,DDIT3的低表达抑制细胞凋亡进而增强细胞迁移等能力,并进一步参与创面愈合过程。
综上所述,本研究采用基因芯片技术对低氧微环境下表皮细胞转录组情况进行了分析,其结果表明,低氧微环境上调基因5 416个,下调基因为5 060个。进一步对低氧及常氧差异表达基因分析表明,低氧微环境下除氧化应激、炎症等基因有调控外,细胞迁移相关基因也在低氧微环境下起重要调控作用。进一步分析发现,DDIT3、CCL20以及IL6基因在上述调控通路中有重要作用,提示在低氧微环境下表皮细胞调控中扮演着重要作用。这些基因分子的发现对于进一步阐明皮肤创面愈合机理,并进行有效地干预、促进创面愈合具有重要的意义。

