紫菜半乳聚糖结构与生物活性研究进展
张忠山,王晓梅,毛根祥,杨志红,潘永良
(1.湖州师范学院,浙江省省媒介生物学与病原控制重点实验室,浙江湖州 313000;2.浙江医院,浙江省老年医学重点实验室,浙江杭州 310013)
紫菜(Laver)作为中药在中国的药用历史悠久,早在《本草经集注》中有治“瘿瘤结气”的记载,之后被李时珍列为《本草纲目》菜部二十八卷菜之四项,对紫菜的集解、气味、主治等做了详细介绍。在《现代实用中药》中对紫菜的主治范围进一步明确,提到“甲状腺肿、慢性气管炎、咳嗽”等疗效[1]。紫菜优异的药理活性与其营养成分有密切的关系。现代研究发现,紫菜营养成分丰富,富含蛋白质、碳水化合物、脂肪酸、氨基酸、微量元素等,具有极高的营养价值[2]。紫菜中碳水化合物占藻体干重的25%以上,是主要的营养成分之一。紫菜中的碳水化合物主要包括半乳聚糖、膳食纤维、红藻淀粉及红藻糖苷等,其中半乳聚糖是研究最多的组分。近二十年来,国内外学者包括本课题组对紫菜半乳聚糖的生物活性与药理作用做了大量深入的研究,现做一综述,为紫菜半乳聚糖的应用提供基础。
1 紫菜半乳聚糖的结构
紫菜藻体是由一层或两层细胞组成的膜状体,胞内具有一星状色素体,附近即是红藻淀粉粒[3]。同褐藻与绿藻的细胞壁组成不一样,紫菜的细胞壁分为内外两层,内层是纤维物质,也是紫菜主要碳水化合物成分。外层是半乳聚糖,因其硫酸化程度较高,无法形成琼胶,是红藻中非产琼胶藻的主要多糖形式。但如果经过碱处理脱去硫酸基,3,6-内醚半乳糖含量上升,即可形成琼胶的形式[4]。目前紫菜半乳聚糖的提取方法主要是传统的水提法[5-6]。在此基础上,也发展了一些新的提取辅助方法,如微波提取[7]、酶法提取[8-9]、超声波提取[10]、超临界CO2脱脂[11]等。不同紫菜种类以及不同的提取方法,得到的半乳聚糖结构和组成也略有不同。
紫菜半乳聚糖属于双糖重复单元的多糖硫酸酯,早在上世纪50~60年代,Nunn等[12]和Peat等[13]就分别从好望角紫菜(P.capensis)和脐形紫菜(P.umbilicalis)中分离得到并初步认定半乳聚糖主要有半乳糖、6-O-甲基半乳糖、3,6-内醚半乳糖和硫酸基组成。此后Rees等[14]发现紫菜属下不同品种紫菜在不同季节和生长条件下,半乳聚糖组成差别较大,而且紫菜接触空气部分较海水浸没部位的3,6-内醚半乳糖含量高,推测该组分可能是紫菜抵抗物理振动的应答分子。Turvey 等[4]对脐形紫菜多糖的结构做了深入研究,并采用碱处理法得知紫菜半乳聚糖与琼胶转化的特征变化,总结了紫菜半乳聚糖的几种基本结构单位,见图1。

图1 紫菜半乳聚糖部分结构单元
除了主链的研究之外,也有学者对支链有所报道。Vallarroel 等[15]发现智利楼斗紫菜(Porphyracolumbina)存在大量以前未知的支链残基,比如2,4,6-三-O-甲基-D-半乳糖、2,3-二-O-甲基-D-半乳糖和2,3,4,6-四-O-甲基-D-半乳糖等。Grets等[16]在研究白点紫菜(P.leucosticta)丝状体多糖时提出随着藻体的生长发育,紫菜中的L-半乳糖逐渐进行3,6-内醚化,结构单元趋向于琼胶。在高洪峰等[17]的初步研究基础上,吕燕等[18-19]对坛紫菜半乳聚糖及其分级组分做了深入解析,发现结构单元的糖苷键链接方式基本有(1→4)、(1→3)、(1→2)三种方式,对坛紫菜的结构特征有了清楚的认识。张伟云等[20-21]对条斑紫菜半乳聚糖的分级组分做了系列研究,基本单元同坛紫菜半乳聚糖,同时发现支链的一些特征,比如支链上有规律存在木糖。之后国内外学者关于紫菜半乳聚糖的报道基本上延续了上述主要糖链结构,只是在单糖组成比例、甲基化程度和硫酸基的位置等方面有所差异[22-25]。碱提紫菜多糖目前报道很少。白日霞等[26]在紫菜中以0.1 mol·L-1氢氧化钠得到一种侧链连有葡萄糖和甘露糖的(1→4)甘露聚糖,该结构未有所报道过,值得关注。
综上报道,水提紫菜半乳聚糖基本结构是1,3连接的β-D-半乳糖与1,4连接的α-L-半乳糖-6-硫酸基组成的二糖重复单位,其中部分L-半乳糖残基被3,6-内醚-α-L-半乳糖所更替。在部分D-半乳糖的C6位和L-半乳糖的C2发生甲基化。
2 紫菜半乳聚糖的生物活性
2.1 抗肿瘤活性
紫菜半乳聚糖对多种类型的肿瘤细胞系具有抑制作用。表1列出了已报道的紫菜半乳聚糖抗肿瘤作用及相关机制。由表1看出,目前紫菜半乳聚糖抗肿瘤活性研究的报道主要品种集中在条斑紫菜。紫菜半乳聚糖主要通过诱导肿瘤细胞分化或凋亡和影响肿瘤细胞周期这两个方面发挥抗肿瘤作用。
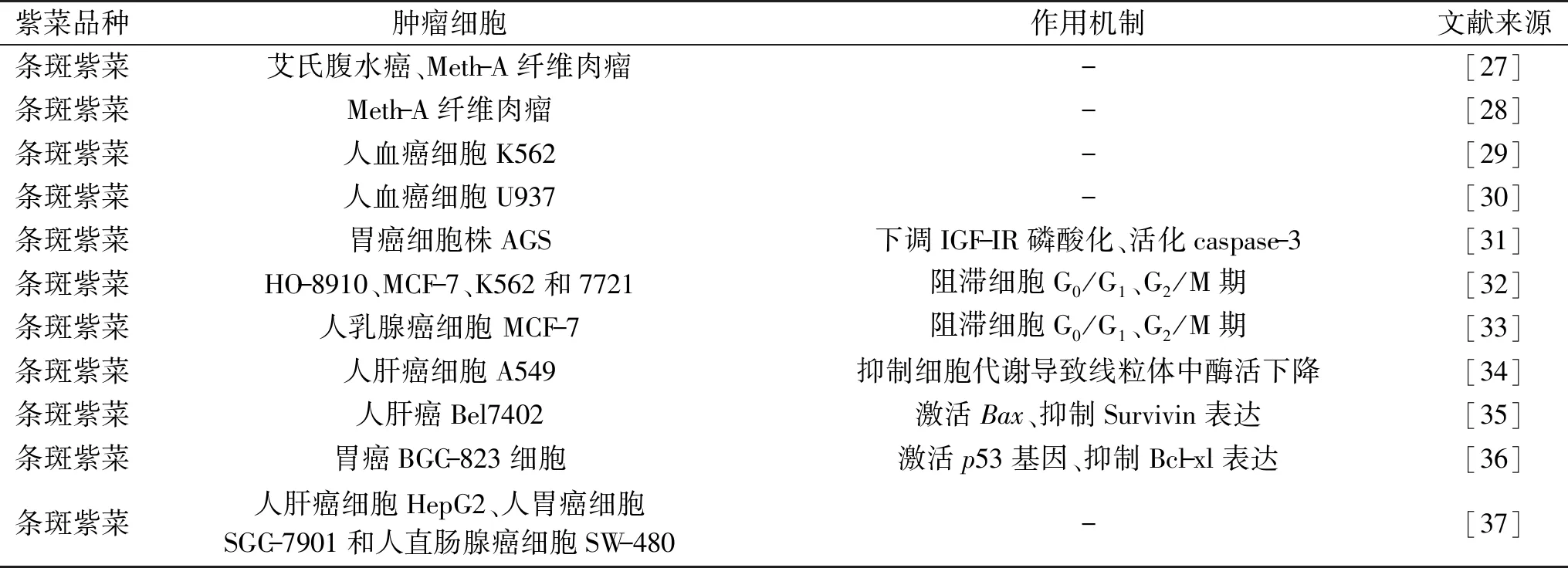
表1 紫菜半乳聚糖抗肿瘤活性及机制
紫菜多糖与其他藻类或非藻类多糖的混合多糖往往具有协同作用,比单一多糖活性更佳。谢好贵等[38]将坛紫菜多糖与龙须菜多糖、毛头鬼伞多糖以一定比例混合组成复合多糖,在剂量为1000 g·mL-1时,对人宫颈癌HeLa细胞抑制率达76.30%,而同剂量的坛紫菜多糖的抑制率仅为35.64%。同时发现复合多糖能提高HeLa细胞中凋亡蛋白酶基因caspase-10、caspase-3表达水平,从而诱导细胞凋亡。
利用多糖与抗肿瘤药物交联或偶联成为高分子前药成为提高生物利用度和降低毒副作用的重要方法。Zhang等[39]把5-氟尿嘧啶(5-Fu)负载在低分子量坛紫菜多糖上形成复合物,其释放5-Fu机制属于典型的Fickian扩散。该复合物在缓冲液中容易缓慢释放出5-Fu,抑瘤率可达到49.3%,高于两者混合物的抑瘤率[40],对于开发低毒缓释的抗肿瘤药物具有借鉴意义。
多糖在药物基因递送载体领域的应用引起广泛关注。Venkatpurwar 等[41-42]以紫菜半乳聚糖为载体,在四氯金酸溶液中制备形成纳米金体系,然后将抗癌药物盐酸阿霉素(DOX)通过氢键键合在金纳米粒子上。实验显示,人胶质瘤细胞系(LN-229)分别与0.01%的多糖药物递送载体和同浓度的紫菜半乳聚糖孵育72 h后,其存活率分别为10%和40%,表明该药物递送载体对LN-229具有强的细胞毒作用,表现出广阔的应用前景。Lima等[43]利用一锅法合成了紫菜半乳聚糖纳米金(CPE/AuNps-PFR),作为电化学生物传感器检测5-Fu含量,测定结果准确方便,具有良好的回收率(96.6%~101.4%)。Yu等[44]将条斑紫菜半乳聚糖阳离子化修饰后,与pWnt3a反应合成了一种球形纳米颗粒,结果表明在两者比例40∶1条件下形成的纳米粒对人脐带间充质干细胞无毒性,转染效率显著高于对照品脂质体2000,可以被开发成一种安全、经济、高效的非病毒基因载体。
肿瘤是因相关基因突变产生的,基因突变会使相关蛋白质的结构或功能产生变化,从本质上来说肿瘤也是一种基因病,因此抗突变是抗肿瘤的前提。紫菜半乳聚糖具有明显的抗突变活性。周慧萍等[45]发现紫菜多糖能有效的对抗环磷酰胺引起的白细胞下降,抑制率可达到79%以上。张忠山等[46]研究发现紫菜半乳聚糖及其硫酸酯衍生物能明显的抑制环磷酰胺和丝裂霉素C诱导的大蒜根尖细胞微核率,硫酸酯衍生物的抑制活性更强。
以上报道表明,紫菜半乳聚糖可通过直接杀灭细胞或间接提高免疫能力发挥抗肿瘤活性,具有成为抗肿瘤物质的潜力。
2.2 免疫调节活性
作为多糖的重要生物功能,免疫调节活性一直是人们研究的热点。紫菜半乳聚糖的免疫调节活性表现在多个方面,如对T、B淋巴细胞、巨噬细胞及抗炎因子的影响等。
T、B淋巴细胞是机体主要免疫细胞,在免疫应答过程中起着核心作用。研究发现,在体外细胞培养实验中,紫菜半乳聚糖或者其分级组分均具有促进脾脏混合淋巴细胞或T、B细胞增殖及支持生长的功能,且均具有剂量依赖性[47-50]。但是张伟云等[51-52]由条斑紫菜多糖分级获得一个不含3,6-内醚半乳糖的特殊组分PY2以及含少量3,6-内醚半乳糖的PY4,均能明显抑制体外培养的小鼠脾脏淋巴细胞、胸腺淋巴细胞增殖。由于体外细胞实验环境单一,该结果尚需在动物实验中验证。赵婷婷等[53]还发现降解后的坛紫菜半乳聚糖能显著增强T细胞增殖,抑制B细胞增殖,免疫调节活性优于高分子原料。这种对T、B细胞影响作用不一致的结果也在其他多糖的免疫实验中报道[54],可能与多糖结构和细胞功能有关系。毕薇薇给予小鼠腹腔注射野生紫菜多糖PP,发现0.25 g·kg-1的浓度能显著促进小鼠分泌IL-2,并且在48 h内分泌量达到高峰,推测与PP可以增强活化T细胞而导致IL-2受体表达有关[55]。
巨噬细胞和自然杀伤细胞(NK细胞)是机体固有免疫中的重要防御细胞,多糖的免疫功能多与两者有关。邱伟芬等[56]用酶法辅助水提提取得到条斑紫菜多糖的几个分级组分,均能不同程度促进小鼠巨噬细胞RAW264.7的中性红,其中硫酸基含量高的PYP-2组增殖活性最强,表明硫酸基可以提高免疫活性。Yoshizawa等[57]用pH=2的HCl溶液提取获得条斑紫菜多糖PASF,脱掉硫酸基越多的样品可以显著降低C57BL/6小鼠腹腔巨噬细胞中葡萄糖和NO含量,但是多糖被硫酸酯化后表现出无活性。在作用机制方面,研究发现紫菜水提多糖可以显著增强RAW264.7的吞噬能力,有效促进细胞释放NO、NF-κB、TNF-α、IL-6、IL-10等因子,表明该多糖主要通过JNK和JAK2两条信号通路提高活性的[58-64]。在NK 细胞活性方面,李胜军等[65]发现0.15 g·kg-1紫菜多糖注射组小鼠的脾细胞分泌 IFN-γ水平及NK 细胞杀伤活性高于生理盐水对照组,表现出优异的免疫增强活性。
紫菜多糖对正常小鼠或免疫抑制剂诱导的免疫低下小鼠均具有增强免疫作用。张迅捷等[66]给予正常小鼠口服不同剂量的紫菜多糖,发现紫菜多糖能明显增强DNFB诱导的迟发型变态反应,促进白介素2的含量。闫建忠等[67]给予环磷酰胺造成的免疫功能低下小鼠腹腔注射紫菜多糖,发现0.15 g·kg-1浓度溶液显著增强脾细胞IFN-γ及NO水平。Nishiguchi等[68]研究了紫菜多糖分级组分F1对LPS诱导的内毒素休克小鼠免疫系统的作用,发现多糖能抑制血清NO和TNF-α、肝脏MDA水平,体内实验效果明显。
作为免疫机制介导的食物不良反应,过敏性疾病也是人们关注的焦点。Shi 等[69]发现紫菜多糖可以显著降低原肌球蛋白TM诱导的过敏小鼠血清IgE和IgG1的水平,升高IgG2含量。在细胞和分子水平上,紫菜多糖显著抑制小鼠Th2的细胞因子(IL-4、IL-5、IL-13)水平,促进Th1因子(IFN-γ、IL-10),推测紫菜多糖是通过JNK和JAK2信号通路起作用。Ishihara等[70]研究了甘紫菜和条斑紫菜半乳聚糖对接触性皮炎Balb/c小鼠模型的抗过敏反应,发现紫菜多糖不仅能抑制炎症小鼠的耳廓肿胀,而且能显著降低耳垂和血清中的IgE和IFN-γ含量,具有显著的抗过敏效应。因此推测紫菜半乳聚糖具有成为重要免疫调节剂和抗过敏物质的潜力。
2.3 抗心脑血管病
心脑血管疾病是一类由高血压、高血脂、动脉粥样硬化等导致的心脏、脑组织和血管发生的疾病,是世界上发病人群最多和死亡率最高的疾病。早在《随恳居饮食谱》中就记载紫菜能“和血养心”。众多研究表明,紫菜多糖在治疗和预防心脑血管疾病方面效果显著。
紫菜半乳聚糖降血脂活性报道较多。梁桂宁等[71]将紫菜多糖中加入胆固醇和胆汁时发现,离心管中胆固醇微胶粒形成量减少,加入多糖浓度越高,形成微胶粒越少。在健康动物实验中,周慧萍等[72]发现紫菜多糖组小鼠血清胆固醇(TC)含量比对照组降低44%。Tsuge等[73]分别给予健康SD大鼠喂食不同硫酸基含量的紫菜半乳聚糖和琼脂,发现喂食琼脂的大鼠的脂肪组织重量和血清胆固醇水平未发生变化,而紫菜多糖组大鼠上述指标显著下降,并且粪便中中性甾醇的排泄量显著提高(p<0.05);低硫酸基多糖组中性甾醇排泄量高于高硫酸基多糖组。在高脂血症大鼠实验中,国内外学者均发现喂食紫菜半乳聚糖的实验组小鼠血清胆固醇、油脂、TG 和LDL-C 含量显著降低,HDL-C含量显著提高[74-78]。推测紫菜半乳聚糖降脂机制是含有丰富的羟基(吸酯性基团),抑制脂质吸收,并促进胆酸排除。Cao等[79]报道认为紫菜半乳聚糖通过影响与脂肪代谢相关酶(如丙氨酸氨基转移酶、天门冬氨酸氨基转移酶和碱性磷酸酶)的活性和含量来加速脂肪分解,减轻脂质沉积。Inoue等[80]研究了紫菜多糖对HepG2细胞载脂蛋白B100分泌和脂代谢的影响,发现相对于对照组来说,多糖组细胞载脂蛋白含量下降23%,同时细胞内游离胆固醇、胆固醇酯和TG含量明显下降,提示紫菜半乳聚糖可以通过调节载脂蛋白来影响脂质转运或分布达到降脂作用。
紫菜半乳聚糖在降血糖活性方面效果明显。王茵等[81]通过酶解坛紫菜获得含有多糖含量为10.8%的产品灌胃糖尿病小鼠模型时,中高剂量组小鼠血糖值保持稳定,且可改善糖耐量,表现出优异的调节血糖的能力。Cao等[82]发现从残次坛紫菜中提取的半乳聚糖能够修复糖尿病小鼠的胰岛β细胞,促进胰岛素分泌,达到降糖目的。杨旭东等[83]发现条斑紫菜半乳聚糖可以抑制糖尿病大鼠脑组织中的p35基因表达,促进bcl-2基因表达,从而降低脑损伤。Kitano等[84]将条斑紫菜半乳聚糖喂食KK-Ay 2型糖尿病小鼠后发现,样品组小鼠的血清脂联素水平明显提高。近年来多项研究证实血清脂联素是2型糖尿病发病的独立危险因素,其水平能预示2型糖尿病和冠心病的发展[85],推测调控脂联素水平是紫菜半乳聚糖降血糖的主要机制。另外,该报道还发现紫菜半乳聚糖能调控糖尿病小鼠的肠道菌群,样品组小鼠盲肠拟杆菌属数量显著增多,而球状梭菌数量显著下降,并且盲肠中吲哚丙酸的含量激增。研究发现,吲哚丙酸是肠道细菌的代谢产物,其可以通过胰腺β细胞,促进胰岛素的分泌[86],因此可以解释紫菜半乳聚糖预防糖尿病的机制。
在脑血管疾病方面,张海红等[87]通过紫菜半乳聚糖给予灌胃反复脑缺血/再灌注损伤小鼠,发现该多糖不仅能提高小鼠脑组织中SOD和GSH-Px活性,同时可以降低血浆IL-1β、IL-6水平、有效组织神经元超微结构损伤,表现出优异的脑缺血保护功效。
另外,也有报道表明紫菜半乳聚糖在抑制血栓形成和增强心肌收缩力[88]、抗凝血[89-90]等方面的优异活性。
由此看出,紫菜半乳聚糖在心脑血管疾病方面研究比较深入,具有进一步开发成为相关产品的潜力,同时应注重机制的探讨。
2.4 抗消化系统病
消化系统包括胃肠等消化道和肝胰等消化腺,是影响人体机能的重要系统之一。研究发现紫菜半乳聚糖对胃肠疾病和肝损伤保护均有显著效果。
过度饮酒会对机体消化系统造成不同程度的损伤。梁桂宁等[91-92]研究了紫菜多糖对急性酒精灌胃小鼠胃组织保护机制,发现灌胃紫菜多糖后,小鼠胃溃疡指数显著下降,胃组织SOD、GSH-Px、前列腺素 E2(PGE2)和NO含量显著升高。研究证实后两者是重要的胃黏膜防御因子,能调节胃酸和胃粘液的分泌促进溃疡愈合[93],因此推测紫菜多糖主要是通过抗氧化和调节防御因子治疗胃溃疡。
肠道菌群失衡是当前学者关注的热点。据2018年《Nature》报道,研究人员发现了一种消化紫菜多糖的拟杆菌,并且当给小鼠喂食富含紫菜多糖的食物时,这种细菌菌株能强健地定植到所有小鼠中,证实了能够通过增加小鼠摄入的海藻数量来精确地调整这种定植的细菌群体大小[94]。刘波等[95]将紫菜多糖注射到小鼠体内后再进行肠产毒大肠杆菌致小鼠腹泻时,发现多糖组小鼠无腹泻现象,其粪便中双歧杆菌数量比模型组高1.8%,乳杆菌数量高3.4%,而大肠杆菌数量降低2.9%,表明紫菜多糖在预防腹泻方面具有较大潜力。Zhang等[96]将低分子坛紫菜半乳聚糖灌胃健康小鼠后,发现小鼠粪便菌群多样性和丰度上升,其中双歧杆菌、乳酸杆菌等有益菌显著增多,而柔嫩梭菌、肠杆菌等显著下降。
肝脏是人体最重要的解毒器官,也是各种毒物损伤的靶点。Guo等[97]建立四氯化碳导致的小鼠肝损伤模型后给予灌胃条斑紫菜半乳聚糖,结果发现高剂量多糖组与模型对照组相比,小鼠血清和肝中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)活性和MDA含量分别降低65.4%、34.5%和25.8%。组织学检查显示多糖可减轻肝坏死程度,减少炎症细胞的迁移。牛培勤等[98]采用刀豆蛋白A(ConA)诱导的急性肝损伤探索紫菜多糖的保护作用,发现紫菜多糖各剂量组的指标ALT、AST及TNF-α、IFN-γ水平均显著下降。免疫组化染色结果表明,多糖组Bcl-2表达水平下降而Bax表达水平上升,揭示紫菜半乳聚糖的肝损伤保护机制可能与抑制上述因子介导的线粒体内源性凋亡有关。
消化系统疾病是目前常见的疾病,上述研究发现紫菜半乳聚糖的抗消化系统疾病的作用对于研发相关保健食品具有重要意义。
2.5 抗衰老与神经保护
据记载,在宋朝,紫菜是专供皇帝享用的贡品,被称为“神仙菜”、“长寿菜”。现在研究表明,紫菜中丰富的多糖是其发挥抗衰老作用的主要因素。
近年来抗衰老活性主要集中在坛紫菜半乳聚糖的研究。Zhang等[99]发现坛紫菜半乳聚糖的分级组分F1和F2均能够显著提高衰老小鼠的脾脏指数和胸腺指数,而且它们的作用均具有剂量依赖性。此后Zhao等[100]采用双氧水降解法获得低分子量坛紫菜半乳聚糖,并观察对黑腹果蝇生命力的影响,结果发现所有多糖样品均能延长果蝇寿命和提高性活力,而且降解后多糖的效果更明显。同时发现几种降解多糖均能提高小鼠体内肝糖原含量,且能显著延长小鼠的游泳和爬杆时间,表现出优异的抗疲劳活性[101]。顾佳雯等[102]也发现条斑紫菜半乳聚糖的抗疲劳活性,另外还有南非紫菜的抗衰老活性的报道[103]。
学者们往往采用细胞模型探索多糖抗衰老和神经保护活性机制。Zhang等[104]用H2O2作用于年轻的人二倍体成纤细胞WI-38建立了早熟性细胞衰老模型,发现低分子量坛紫菜半乳聚糖显著逆转H2O2诱导的衰老样改变,降低SA-β-Gal染色阳性率,显著上调衰老相关蛋白p53和p21,这是首次揭示坛紫菜半乳聚糖抗衰老机制的报道。Yu 等[105]将紫菜多糖阳离子化合成了乙二胺阳离子化紫菜多糖(Ed-PYP),将Ed-PYP与神经相关转录因子混合制成纳米粒用于转染成纤维细胞,结果显示该纳米粒可将成纤维细胞直接重编码为神经细胞,为细胞移植治疗神经系统相关疾病提供了细胞来源。叶翠芳等[106]发现紫菜多糖对小鼠成纤维细胞NIH 3T3有显著促进增殖的作用,且能提高UVA 辐射损伤的成纤维细胞的存活率。
帕金森病是中老年人常见的神经系统变性疾病,研发抗帕金森病的药物具有重要意义。紫菜半乳聚糖抗帕金森病的研究也有新进展。Wang等[107]研究了坛紫菜半乳聚糖不同衍生物对6-羟基多巴胺(6-OHDA)所致MES23.5神经细胞损伤的保护作用,发现乙酰化和磷酸化衍生物能减轻低浓度(25 μmol/L)6-OHDA 所致的细胞毒性。此后Liu等[108]深入研究了坛紫菜寡糖(OP)对MPTP造成的小鼠黑质多巴胺能神经元损伤的保护作用,结果表明该聚合度为2~8的半乳寡糖能明显改善帕金森小鼠运动协调能力,显著降低神经元细胞中caspase-3和聚腺苷二磷酸核糖聚合酶(PARP)表达量,上调磷酸化-Akt、Bc1-2及磷酸化-Bad表达,表现出优异的抗帕金森病活性。
紫菜半乳聚糖在抗衰老和神经保护方面的应用是近年来的重要研究方向,也为其高值化利用提供了新思路,但是作用机制仍然不清楚,下一步需对该方面深入探究。
2.6 其他活性
与其他植物海藻多糖一样,紫菜半乳聚糖具有优异的体内外抗氧化活性。已有报道的有残次紫菜多糖[109]、不同分子量紫菜多糖[111]、紫外降解的紫菜多糖[112]、衍生化多糖[113-114]等。
紫菜半乳聚糖也具有抗病毒活性。肖美添等[115]采用硫酸降解坛紫菜多糖后获得低分子酸性多糖,在浓度5 mg·mL-1可以完全抑制甲1型流感病毒生长,并与金刚烷胺具有协同抗病毒作用。田冰等[116]建立肠道病毒71型(EV71)乳鼠模型后,给予灌胃紫菜半乳聚糖,乳鼠的CD4+和CD8+T细胞比例明显升高,两者比值明显降低,IL-6、TNF-α水平明显降低,同时IL-10、IFN-α水平明显升高,表现出对EV71感染的免疫干预作用。
在抗真菌活性方面,Bhatia等[117]采集处于低潮区和高潮区的Porphyravietnamensis(越南紫菜)通过冷水、酸提、碱提、紫外降解等方式获得了14个多糖样品,测试了体内外抗白色念珠菌活性,结果显示碱提的低潮区紫菜多糖样品拥有最低分子量和高含量硫酸基团,体外杀真菌IC50为2.7 μg·mL-1(48 h),此样品在动物实验活性远高于对照品壳聚糖,该研究表明紫菜碱提多糖在抗真菌活性方面拥有较大潜力。
在治疗肾衰方面,Wang等[118]建立了甘油致大鼠肾衰模型,给予灌胃酸解获得的紫菜寡糖(聚合度1~8),发现该寡糖能减轻大鼠肾脏病理改变,显著升高肾衰大鼠的血尿素氮和肌酐水平,降低血液和尿液中的部分离子水平(如K+),有关机制需进一步研究。
紫菜半乳聚糖在水产品生长和保藏方面有所应用。将紫菜半乳聚糖处理的对虾和鲈鱼贮存在4 ℃冰箱8 d,结果发现处理组对虾和鲈鱼的细菌总数、pH、挥发性盐基氮、硫代巴比妥等显著低于对照组,还能延长货架期3~5 d[119-120]。将紫菜粗多糖加入饲料中喂食斜带石斑鱼后,体内增重率、特定生长率、肥满度显著提高,适当剂量紫菜粗多糖对斜带石斑鱼超氧化物歧化酶、过氧化氢酶、补体C3有促进作用,明显促进斜带石斑鱼IL-6、IFN-α、IL-2的生成和肠道蔗糖酶活性,表现出良好的促进生长作用[121]。
3 结语
紫菜半乳聚糖在医药方面具有优异的活性,但是目前的研究仅限于细胞与动物模型,未有进一步药用开发的研究报道。主要原因是,一方面紫菜半乳聚糖是杂多糖,其糖链连接与高级结构远比琼胶和卡拉胶复杂,并且分子量大、粘度高,开发成药的障碍较大。目前应用开发仍聚集在紫菜全藻食用,高值化利用价值较低。另一方面,生长环境、分子量、取代基团等因素与半乳聚糖活性关系较大,构效关系也是研究的重点。当前生物活性研究方面虽广泛,但分子机制研究不够深入,下一步的研究重点应聚焦在半乳聚糖在体内细胞的受体、信号通路等领域,并且深入研究多种生物活性之间的关联,对于紫菜半乳聚糖的开发具有重要指导意义。

