不同孵化时期鸡蛋蛋清小分子多肽的鉴定及功能分析
朱方莉,孙浩浩,何钟瑜,陈 璨,邱 宁,*
(1.国家蛋品加工技术研发分中心,湖北武汉 430070; 2.华中农业大学食品科技学院,湖北武汉 430070)
鸡胚蛋是指受精蛋在适宜条件下进行孵化一段时间后,并未破壳且具有生命力、可食用的鸡蛋[1]。受精蛋在孵化过程中只与外界进行气体及热量交换,鸡蛋本身提供胚胎生长所需的全部营养物质。蛋清和蛋黄中的蛋白质以完整蛋白的形式或降解成肽段进入鸡胚,为其生长发育提供营养[2]。目前研究表明,鸡胚蛋孵化早期粗蛋白含量逐渐增多,中期趋于平稳,在孵化第14 d时其含量达到最高值,后期蛋白质开始被鸡胚所吸收利用,故在此阶段呈降低趋势[3]。然而,目前对于鸡胚蛋中蛋白质或肽段何时进入胚胎,且在其中如何发挥的功能还有待研究。
大部分关于鸡蛋蛋白质的研究大多是基于其功能活性,如分离提取鸡蛋蛋清中抗氧化性活性肽和抗血管紧张素转化酶肽[4-5],以及对鸡蛋黄浆质的肽组学研究等[6],但关于鸡胚蛋中蛋清产生的多肽种类以及与鸡胚发育之间的联系还未见报道。研究表明利用蛋白酶水解的卵转铁蛋白抗菌活性肽与完整蛋白均具有较好的抑菌活性[7],也有文献[8-9]报道鸡蛋蛋白质水解物中的多肽同样也能够影响鸡胚心血管、骨骼和免疫系统的发育。实验室前期研究发现,在孵化以及贮藏过程中,高分子量的蛋白质会发生互相作用,通过质谱鉴定发现其成分是蛋白与肽的结合产物[10];另外在鸡胚蛋孵化前期发现蛋清中的蛋白质在内源酶作用下能够发生不同程度的降解[11],因此有必要对孵化过程中蛋清蛋白质所降解的小分子多肽进行分析。
本文通过SDS-PAGE和MALDI-TOF MS/MS串联质谱鉴定技术,采用“自上而下”的方法对不同孵化时期蛋清中的小分子多肽进行研究,分析孵化过程中蛋清产生肽段与鸡胚发育之间的内在联系,为开发鸡胚蛋蛋清天然活性肽提供了一定的理论基础。
1 材料与方法
1.1 材料与仪器
白来航受精蛋(选用鸡龄相同,同一批次生产的24 h内新鲜鸡蛋) 华中农业大学动物实验中心;考马斯亮蓝R-250 北京索莱宝科技有限公司;蛋白质电泳预染Marker Thermo Scientific公司;SDS-PAGE试剂盒 武汉谷歌生物科技有限公司;尿素、硫脲、三羟甲基氨基甲烷、丙烯酰胺、乙腈、乙醇、冰醋酸、四甲基二乙胺 均为国产分析纯(AR),国药集团化学试剂有限公司;STD缓冲液、尿酸(UA,8 M尿素;150 mmol/L Tris-HCL)、吲哚-3-乙酸(IAA)、CHCA基质溶液(50%乙腈,0.1%三氟乙酸) Sigma公司。
ALPHAI 1-4型真空冷冻干燥机 德国CHRIST公司;NanoDrop 200C型分光光度计 Thermo Scientific公司;HY-2调速多用振荡器 国华电器有限公司;3-30 K冷冻离心机 珠海黑马医学仪器有限公司;DYCZ-24D电泳装置 北京六一仪器厂;UltrafleXtremeTMMALDI-TOF-TOF质谱仪 AB SCIEX公司。
1.2 实验方法
1.2.1 蛋清样品制备 将受精蛋在温度37.8 ℃,相对湿度60%的条件下进行孵化。分别在孵化的第0、6、8、10、14、16、18 d各取出9枚受精蛋作为实验材料。受精蛋要先-80 ℃冰箱预冻2 h,再分离蛋黄和蛋清,防止鸡胚蛋的其它部分污染样品,然后使用真空冷冻干燥机冻干(-40 ℃,35 h,0.01 MPa左右)成粉末备用。
1.2.2 SDS-PAGE凝胶电泳 按照Laemmli等[12]描述的方法,对第0、6、8、10、14、16、18 d的蛋清样品进行凝胶电泳。
1.2.3 小分子多肽样品的制备 分离并提取鸡胚蛋蛋清中的小分子多肽:称取2 g冻干的蛋清样品,将其溶解于100 mL去离子水中,在8000 r/min 4 ℃下离心20 min,将所得上清液用0.45 μm微孔滤膜进行微滤,最后再用10 kDa超滤管对所得滤液进行超滤,得到分子量小于10 kDa的小分子多肽样品。冷冻干燥后将其置于-80 ℃条件下密封保存(冻干条件同1.2.1)。小分子多肽提取过程在4 ℃下进行。
1.2.4 质谱鉴定 用灭菌枪头吸取冻干后的小分子多肽样品,加入30 μL STD缓冲液,沸水浴加热5 min,冷却至室温后,加入200 μL UA缓冲液混合均匀,将其置于10 kDa超滤管进行超滤,加入200 μL UA缓冲液后,8000 r/min 4 ℃下离心20 min,取沉淀,向其中加入100 μL IAA,震荡1 min后,避光放置30 min,8000 r/min 4 ℃下离心5 min。再加入100 μL UA缓冲液,10000×g 4 ℃离心5 min,重复2次。加入40 μL的25 mmol NH4HCO3,放置过夜后8000 r/min 4 ℃离心10 min,再加入40 μL 25 mmol的NH4HCO3,进行8000 r/min 4 ℃离心5 min,然后用0.1%甲酸进行酸化至pH为5。
将得到的样品进行冻干后,取2 μL 20%的乙腈复溶,取1 μL溶解后的样品,直接于样品靶上进行点样,等待溶剂自然风干,取0.5 μL过饱和的CHCA基质溶液,于对应靶位上点样并自然风干。使用氮气将样品靶吹净,随后将其放入仪器中,并使用串联飞行时间质谱仪(5800 MALDI-TOF MS/MS)进行检测。质谱方法以及条件MALDI-TOF/TOF,激光源为YAG激光器,UA波长为355 nm,加速电压为2000 V,采集数据的模式为正离子模式与自动获取数据的模式,一级质谱(MS)扫描质量范围为800~4000 Da,收集信噪比>50的母离子进行二级质谱(MS/MS)分析,每个样品上挑选8个母离子,二级质谱累计叠加2500次,碰撞能量为2 kV。
1.3 数据处理
利用软件Mascot distiller过滤基线峰、识别信号峰。利用Mascot软件及Biotools软件搜索NCBI库,搜索IPI_Gallusgallus数据库,寻找匹配的相关蛋白质。查询条件为:a.物种选Gallus gallus;b.肽的分子质量在0.8~4 kDa之间;c.表观等电点与表观分子量的误差范围:无限制;d.肽片段分子量最大容许误差为:±50 ppm;e.最小匹配肽片段数:4;f.离子选择MH和monoisotopic;g.固定修饰和可变修饰分别为Carbamidomethy1(C)和Oxidation(M)。
2 结果与分析
2.1 蛋清SDS-PAGE图谱
孵化至第0、6、8、10、14、16、18 d的受精蛋蛋清蛋白质,经过12%的分离胶分离后的SDS-PAGE图谱如图1所示。从图1中可以得到,在前期(0~6 d),受精蛋蛋清蛋白质随着孵化时间的增加变化不太明显,可能由于在孵化前期蛋清蛋白质主要发挥生物活性作用,如参与免疫调节、抗微生物、保持血压处于稳定状态等。而从孵化至14 d后,分子量小于55 kDa蛋白条带的灰度值随孵化时间延长逐渐降低,这是由于孵化后期蛋清蛋白质逐渐被内源酶水解或进入蛋黄,为胚胎提供能量和营养物质[13]。另外,孵化第8 d和10 d卵清蛋白条带明显比第0 d灰度值高,可能由于随着孵化时间的延长,一些小分子蛋白或蛋白质片段相互聚集形成大分子物质[10-11]。孵化至第18 d后,卵清蛋白条带的灰度值明显降低,可能是由于蛋清进入蛋黄或被胚胎吸收并利用[14]。另外,通过上述受精蛋蛋清蛋白质在孵化期间的变化情况,我们选取了第0、6、14和16 d作为重要的时间节点,利用MALDI-TOF MS/MS鉴定不同孵化时期受精蛋蛋清小分子多肽。

图1 不同孵化时期受精蛋蛋清的SDS-PAGE电泳图Fig.1 SDS-PAGE analysis of egg white proteins collected from fertilized chicken eggs during incubation 注:图上横坐标对应分别为孵化至第0、6、8、10、14、16 和18 d的受精蛋蛋清样品;Marker是宽分子量标准蛋白 (分子量范围是10~170 kDa)。
2.2 MALDI-TOF MS鉴定结果
通过MALDI-TOF MS的手段鉴定不同孵化时期受精蛋蛋清小分子多肽样品(小于10 kDa)中肽的指纹图谱如图2所示,图中分别表示孵化至第0、6、14和16 d的小分子多肽指纹图谱。孵化0 d时,小分子多肽分子量主要集中于799.0~2727.4 Da,蛋清中丰度较高的几种小分子多肽的分子量分别为877、1042、1746和2505 Da;孵化6 d时,小分子多肽分子量主要集中于799.0~1441.8 Da,蛋清中丰度较高的几种小分子多肽的分子量分别为822、1042、1297和1930 Da,可能是由于在孵化过程中内源酶分解蛋白质或大分子肽段而产生;孵化14 d时,小分子多肽分子量主要集中于1441.8~2084.6 Da,蛋清中丰度较高的几种小分子多肽分子量分别为1645、1686、1901和2355 Da;孵化16 d时,分子量分布于14 d相同,蛋清中丰度较高的几种小分子多肽分子量分别为1686、1901、2213和2350 Da,可能是蛋白质或大分子肽持续降解[13],也有可能是由于小分子多肽进入蛋黄或被胚胎吸收利用[14]。

图2 受精蛋在不同孵化时期蛋清中小分子多肽分子量分析图谱Fig.2 Molecular weight analysis atlas of small peptide of egg white from fertilized eggs at different days of incubation
2.3 MALDI-TOF MS/MS鉴定结果
本实验通过MALDI-TOF MS/MS对所制取的不同孵化时期(第0、6、14、16 d)受精蛋蛋清小分子多肽样品进行测定,最后分别在孵化第0、6、14、16 d得到837、879、872和842条肽段(共计3430条),这些肽主要来自于22种蛋白质。从表1可以得到,第0、6 d所得到的共有肽段主要来自于丛生蛋白(clusterin precursor)、一氧化氮合酶相互作用蛋白(nitric oxide synthase-interacting protein)、新城疫病毒类感染蛋白(NDV infected-like protein)以及一种未知蛋白,其中第0 d所得到特有肽段来自于跨膜蛋白14A X3亚型(transmembrane protein 14A isoform X3)、白细胞介素6(interleukin 6)和热休克蛋白70(Hsp-70),第6 d所得到特有肽段来自于乳清酸性蛋白类似蛋白X3亚型(whey acidic protein isoform X2)和T细胞受体Vg3-Jg2(T-cell receptor gamma Vg3-Jg2)。
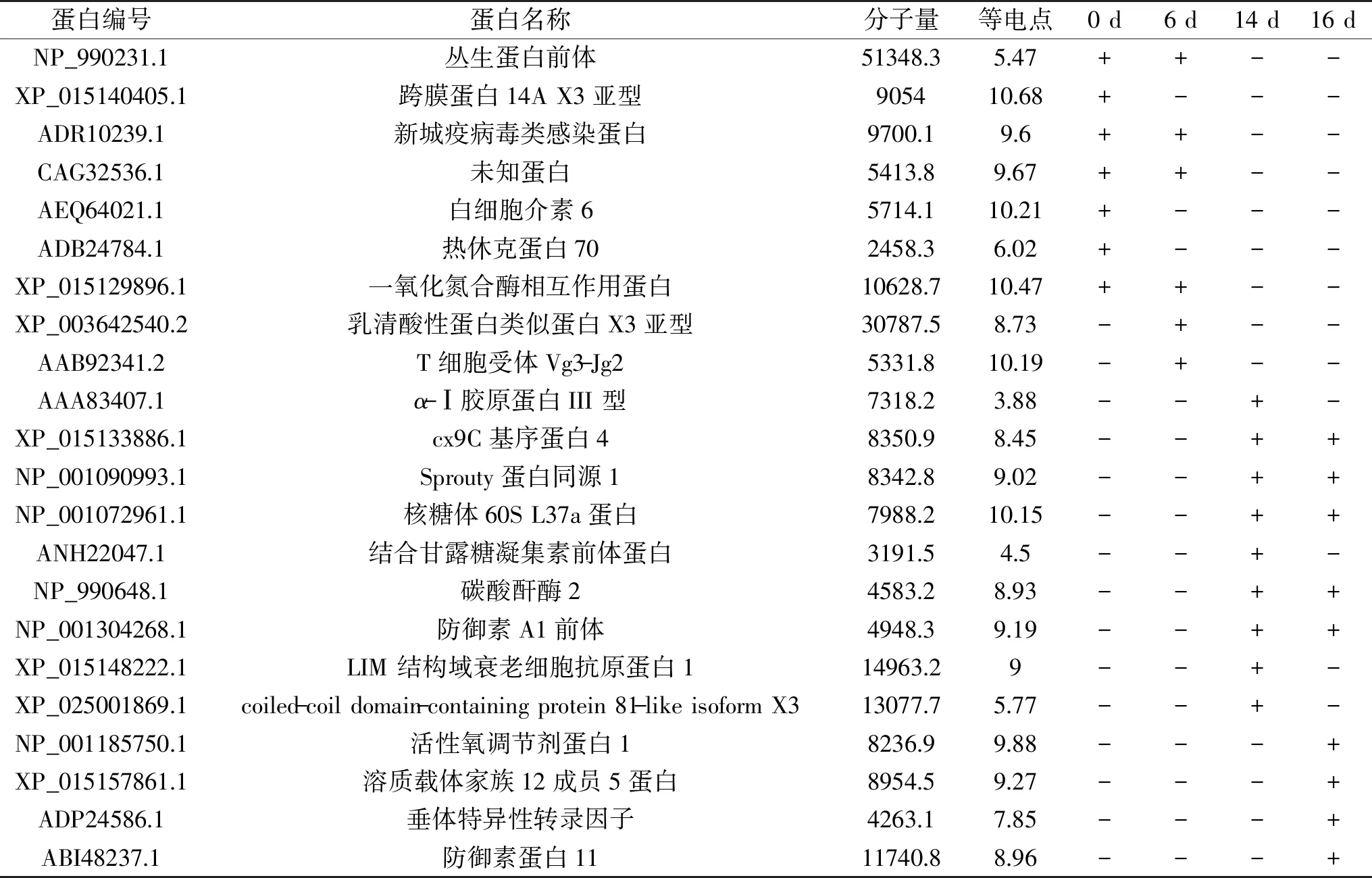
表1 孵化第0、6、14、16 d受精蛋蛋清中鉴定到的小分子多肽Table 1 Small peptides of egg white identified by MALDI-TOF MS/MS at 0,6,14 and 16 d of incubation
研究发现第0、6 d丛生蛋白前体肽段以较高丰度多次被检测到,而在孵化后期未检测到,其结果与前人的研究基本一致[11]。丛生蛋白作为一种分泌糖蛋白[15],属于伴侣蛋白家族[16],曾多次在鸡胚的某些组织中被鉴定到,包括蛋清和蛋壳[17]。另外也有学者提出鸡胚可以看作闭锁吸收的代表性材料,丛生蛋白能够防止蛋白质聚集和沉淀,对胚胎发育过程具有重要的意义[18]。因此,孵化前期丛生蛋白丰度较高对维持蛋白质的相对稳定具有一定作用,而孵化后期丛生蛋白的降解有益于打破蛋清蛋白质的稳定系统,从而使其更容易被鸡胚吸收。另一方面,第0、6 d都检测到高丰度的新城疫病毒类感染蛋白。研究表明该蛋白与机体氧化压力有关[19],且该蛋白过表达能够产生更多的抗干扰素-α抗体[20]。在孵化前期大量检测到此蛋白的存在与鸡胚发育早期尚未形成完善的免疫系统,对外源性病毒的防御主要依赖蛋清蛋白质或肽的作用有关。
第0 d所得到特有的跨膜蛋白14A X3亚型的肽段,该蛋白属于跨膜蛋白家族[21],跨膜蛋白家族成员经常在各类癌症中异常表达。跨膜蛋白14A是含有3个跨膜结构域的膜蛋白,研究表明跨膜蛋白14A是人类肝细胞癌变中的上调基因[22]。另有学者研究得出跨膜蛋白14A在卵巢中过表达,引起癌症[23],即作用于细胞膜的人前胶原C端肽酶组分,在不同的器官的过表达会引起不同种类的恶性肿瘤[24]。跨膜蛋白14A在本实验中只在孵化前期受精蛋蛋清中被检测到,其在胚胎发育过程中可能对细胞增殖以及凋亡起调控作用需进一步研究。白细胞介素6和热休克蛋白70仅在第0 d被检测到,它们均属于应激性蛋白,可能对胚胎发育过程中抵御外界不良反应起到重要作用[25]。研究表明乳清酸性蛋白类似X3亚型蛋白基因包含多个四硫化二核结构域,能够调节肺部炎症反应发[26],T细胞受体Vg3-Jg2只在脾淋巴细胞中表达,与胚胎脾淋巴发育有关[27]。总的来说,孵化前期检测到的肽主要来自于某些具有抗菌抗病毒能力以及与胚胎正常发育密切相关的蛋白,这些由鸡蛋自身内源酶降解的小分子多肽一方面在蛋清中发挥防御功能抵御等外界不良刺激,另一方面它们通过降解成小分子肽更加有利于被胚胎吸收合成自身的防御系统。
表1中第14、16 d所得到的共有肽段主要来自于包含cx9C基序蛋白4(motif-containing protein 4)、sprouty同源蛋白1(protein sprouty homolog)、核糖体60S L37a蛋白(60S ribosomal protein L37a)、碳酸酐酶2(carbonic anhydrase 2)和防御素A1前体(ovodefensin A1 precursor),其中第14 d所鉴定到特有肽段来自于蛋白α-Ⅰ胶原蛋白III 型(alpha-1 collagen type III)、结合甘露糖凝集素前体蛋白(mannose-binding lectin precursor)、LIM 结构域衰老细胞抗原蛋白1(LIM and senescent cell antigen-like-containing domain protein 1)和coiled-coil domain-containing protein 81-like isoform X3;第16 d所鉴定到特有的肽段来自于活性氧调节剂蛋白1(reactive oxygen species modulator 1)、溶质载体家族12成员5蛋白(solute carrier family 12 member 5-like)、垂体特异性转录因子(pituitary specific transcription factor)和防御素蛋白11(Gal 11)。
第14、16 d均得到大量来自于与胚胎发育呼吸作用相关蛋白的肽段,如cx9C基序蛋白、Sprouty 1蛋白和碳酸酐酶2。研究表明将鸡胚暴露在CO2环境下,在孵化第二阶段红细胞中碳酸酐酶的含量和活性明显高于普通环境,碳酸酐酶能够调节胚胎的呼吸作用[28]。另外,Sprouty 1蛋白最早是在果蝇的遗传基因中鉴定到,具有调控眼睛等器官发育的作用[29]。有研究者对非洲蟾蜍的Sprouty 1进行研究,发现此蛋白能够抑制成纤维细胞表皮生长因子所引起蛋白激酶信号通路的激活,从而影响呼吸器官的正常功能[30]。cx9C基序蛋白对于呼吸链复合物的组装或稳定性发挥关键性作用[31],此蛋白可能对鸡胚生长发育过程中对其呼吸及呼吸道酶至关重要。这一系列与呼吸作用相关的肽段可能被胚胎吸收利用用于合成自身的呼吸系统。
核糖体蛋白L37a具有单个C2-C2锌指状基序,该蛋白质在胚胎发育中的功能是促进转录和蛋白质结合[32]。防御素A1前体可能与机体的免疫调节和防御功能有关。一般认为防御素具有广谱抗菌能力,即对革兰氏阳性菌和阴性菌都有抑菌作用,但有文献报道鸡防御素能够对几种大肠杆菌具有潜在的抗菌活性,当防御素浓度为0.25 μmol时能够有效抑制大肠杆菌的生长,但对于其他菌株没有抑制能力[33]。防御素较窄的抗菌谱推测其可能在鸡胚发育过程中主要承担的是生物学功能即保护胚胎的能力,而不仅仅是抗菌能力[34],而本实验室在胚胎发育后期检测到大量来自于防御素蛋白的肽段似乎也佐证了这一观点。前人在鸡蛋壳膜的厚外膜和薄内膜中的每一层均鉴定到胶原蛋白,这是由于母鸡输卵管将胶原样物质沉积到发育中的卵表面[35]。另外也有研究证实鲶鱼卵中的胶原蛋白被组装在三维网络结构中,形成耐久性较好的外壳,此外壳对胚胎具有保护和过滤作用[36]。本实验在胚胎发育后期检测到胶原蛋白肽段,是否该蛋白是从蛋壳膜转移至蛋清后降解以供胚胎吸收利用还有待进一步验证。甘露糖结合凝集素(MBL)是抵御病毒,寄生虫和细菌病原体的第一道防线,是先天免疫过程中具有重要作用的C型血清凝集素蛋白[37]。有学者对鸡MBL进行关于其吞噬作用和补体激活作用的研究,发现高浓度MBL血清相比低浓度MBL对金黄色葡萄球菌的杀菌作用更强,且鸡MLB与哺乳动物MLB相似,都在吞噬和补体激活方面发挥重要功能[38]。coiled-coil domain-containing protein 81-like isoform X3与发育过程中免疫调节相关[39]。LIM 结构域衰老细胞抗原蛋白1可能与胚胎发育中血液运输和调节内环境有关[40]。溶质载体家族12 成员5是K+/Cl-协同转运蛋白,在脑部发育中具有重要作用[41]。简而言之,在胚胎发育后期,得到大部分肽段都是来自于与胚胎发育相关的蛋白,这些肽段可能能够协助胚胎建立自身呼吸系统和防御系统等。
3 结论
本实验研究了不同孵化时期鸡胚蛋蛋清产生的小分子多肽之间的差异,分别在孵化第0、6、14、16 d得到837、879、872和842条肽段(共3430条)。在孵化前期主要检测到的肽来源于与抗菌抗病毒能力相关的蛋白,如类新城疫病毒蛋白、白细胞介素6、热休克蛋白70等;而后期多是来自于与鸡胚胎发育过程中呼吸和防御系统建立相关的蛋白,如Sprouty 1蛋白、碳酸酐酶2和防御素等。这些被鸡蛋自身内源酶水解的肽段,有一部分会继续发挥着其特定功能,如抗菌、抗病毒的作用;而另一部分则会被胚胎吸收利用为其建立自身呼吸系统和防御系统等提供物质基础。本研究提供了不同孵化期间蛋清肽组学数据库,为鸡胚在孵化期间蛋清产生的小分子多肽如何参与胚胎器官发育以及系统形成等奠定理论基础,并进一步为鸡胚蛋蛋清天然活性肽提供更加开阔的前景。

