β-环糊精结合脱支处理对重结晶大米淀粉消化性和结构的影响
曾志鲁,范慧群,黄克愁,罗舜菁,叶江平,刘成梅,罗舜芬
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047; 2.赣南师范大学图书馆,江西赣州 341000)
1992年,英国学者Englyst依据淀粉消化速度将淀粉分为快消化淀粉(RDS)、慢消化淀粉(SDS)和抗性淀粉(RS)[1];其中,将RS定义为在体外模拟消化条件下(pH5.2、37 ℃),在120 min内不能被混合酶系(胰α-淀粉酶、葡萄糖苷酶等)消化的淀粉片断。由于不能被小肠消化吸收,RS可到达大肠作为人体肠道菌群的碳源,因此,RS对于人体肠道菌群健康具有重要的作用;此外,RS还可降低餐后胰岛素分泌,提高机体对胰岛素的敏感性[2-4]。
RS作为一种新型的功能性碳水化合物,引起了国内外学者的广泛兴趣。重结晶淀粉是目前制备RS的主流方式,被归类为RS3[5]。然而,普通淀粉重结晶形成的晶体热稳定性较差,导致RS产量低、热稳定性差。大量研究证明,直链淀粉的重结晶能力显著高于支链淀粉[6],且直链淀粉结晶的热稳定性显著高于支链淀粉。因此,提高淀粉中直链淀粉含量可提高淀粉重结晶能力从而提高RS含量。近年来,多采用脱支酶对淀粉脱支后进行重结晶处理,从而增加RS含量[7]。例如,Demirkesenbicak等[8]采用普鲁兰酶对鹰嘴豆淀粉脱支之后再进行回生处理,与未脱支淀粉相比,其RS含量提高了41.3%。
近年来,脂质等客体分子与淀粉分子络合形成的复合物是另一种热门的RS类型[5]。然而脂质的添加会产生大量额外的能量。β-环糊精(β-CD)是由7个D-吡喃葡萄糖通过α-1,4糖苷键聚合而成的环状低聚糖。研究发现,β-CD可与淀粉发生相互作用形成淀粉-β-CD非包合物[9],从而降低淀粉的消化率[10]。同时,在β-CD对大米淀粉回生的研究中,添加β-CD后大米淀粉的晶体热稳定性显著提高[11]。据报道,脱支处理可增加淀粉分子和客体分子之间的复合物形成,如淀粉-月桂酸和淀粉-多酚[12-13]。基于上述研究结果,本文推断脱支处理和β-环糊精可能对降低重结晶淀粉的消化率具有协同作用。因此,本研究以大米淀粉为原料,比较了重结晶大米淀粉(RRS)、β-环糊精重结晶大米淀粉(β-CD-RRS)、重结晶脱支大米淀粉(DB-RRS)、β-环糊精重结晶脱支大米淀粉(DB-β-CD-RRS)的消化性和结构的差异,以期为提高抗性淀粉含量提供新思路。
1 材料与方法
1.1 材料与仪器
大米淀粉 Sigma-Aldrich公司;β-环糊精 Aladdin Chemistry公司;普鲁兰酶(100 U/g) 诺维信公司;猪胰α-淀粉酶(16 U/mg)、淀粉葡萄糖苷酶(300 U/mL) 美国Sigma公司;GOPOD试剂盒 爱尔兰Megazyme公司;冰醋酸、醋酸钠 分析纯,Aladdin Chemistry公司;乙醇 分析纯,上海振兴化工有限公司。
HH-4数显恒温水浴锅 金坛市城西晓阳电子有限公司;电子分析天平 奥豪斯国际贸易有限公司;Labconco FreeZone真空冷冻干燥机 美国LABCONCO公司;PHS-3C精密pH计 上海雷磁仪器厂;T6紫外可见分光光度计 北京普析通用仪器有限公司;X-衍射仪 英国Bede公司Di系统;差示扫描量热仪 日本日立公司;Quanta-200扫描电镜 美国FEI公司。
1.2 实验方法
1.2.1 抗性淀粉样品的制备
1.2.1.1 重结晶大米淀粉的制备 称取一定质量的大米淀粉分散在水中得到浓度为10%(w/v)的淀粉悬浮液,将悬浮液在沸水中加热30 min使淀粉完全糊化,缓慢冷却至25 ℃并保持2 h,冷冻干燥得到重结晶的大米淀粉,得到的样品命名为RRS。
1.2.1.2 添加β-CD重结晶大米淀粉的制备 将大米淀粉与β-CD(添加量为大米淀粉质量的4.0%)混合,混合物分散于水中得到浓度为10%(w/v)的悬浮液,将悬浮液在沸水中加热30 min使淀粉完全糊化,缓慢冷却至25 ℃并保持2 h,冷冻干燥得到样品,命名为β-CD-RRS。
1.2.1.3 脱支重结晶大米淀粉的制备 称取一定质量的大米淀粉分散在pH5.2,0.02 mol/L乙酸钠缓冲溶液中得到浓度为10%(w/v)的淀粉悬浮液,将悬浮液在沸水中加热30 min使淀粉完全糊化,将淀粉冷却至55 ℃,向溶液中加入普鲁兰酶(40 U/g,基于淀粉的干重),反应24 h后,沸水浴30 min使普鲁兰酶失活,缓慢冷却至25 ℃并保持2 h,冷冻干燥得到样品,命名为DB-RRS。
1.2.1.4β-环糊精重结晶脱支大米淀粉的制备 称取一定质量的大米淀粉分散在pH5.2,0.02 mol/L乙酸钠缓冲溶液中得到浓度为10%(w/v)的淀粉悬浮液,将悬浮液在沸水中加热30 min使淀粉完全糊化,将淀粉冷却至55 ℃,向溶液中加入普鲁兰酶(40 U/g,基于淀粉的干重),反应24 h后,沸水浴加入β-CD(添加量为大米淀粉质量的4.0%),持续30 min(同时灭酶),然后将混合物缓慢冷却至25 ℃并保持2 h。最后,冷冻干燥得到样品,命名为DB-β-CD-RRS。
1.2.2 体外消化性测定 参考Miao等[14]的研究,采用体外模拟消化法测定淀粉的消化性质。将α-淀粉酶(22.5 mg,10 U/mg)溶解在7.5 mL乙酸钠缓冲液(0.02 mol/L,pH5.5)中,加入0.75 mL淀粉葡萄糖苷酶(300 U/mL),涡旋混匀。将每个样品(200 mg,干基)加入14 mL乙酸钠缓冲液(0.02 mol/L,pH5.5)中(未蒸煮/沸水浴蒸煮20 min),然后在37 ℃下平衡10 min,然后再加入1 mLα-淀粉酶和淀粉葡萄糖苷酶的混酶。在消化期间以特定间隔取出溶液(0.5 mL)至无水乙醇(4.0 mL)混合,以使酶失活并以4000×g离心10 min以获得上清液。用GOPOD在510 nm处测量吸光度,并计算葡萄糖含量,每个样品测定3次取平均值。
通过测量G20(水解20 min时释放的葡萄糖)、G120(水解120 min时释放的葡萄糖)、FG(游离葡萄糖)和TG(总葡萄糖)获得不同碳水化合物营养组分(快速消化淀粉,RDS;缓慢消化的淀粉,SDS;抗性淀粉,RS)的值。具体计算公式如下:
RDS(%)=(G20-FG)×0.9×100
式(1)
SDS(%)=(G120-G20)×0.9×100
式(2)
RS(%)=(TG-FG)×0.9×100-RDS(%)-SDS(%)
式(3)
式中,G20为淀粉酶水解20 min时产生的葡萄糖含量(mg);FG为淀粉酶水解处理前淀粉中游离葡萄糖含量(mg);G120为淀粉酶水解120 min时产生的葡萄糖含量(mg);TS为样品中总淀粉含量(mg)。
1.2.3β-环糊精、脱支对重结晶大米淀粉长程和短程结构的影响 通过X-射线衍射仪器获得淀粉样品(未蒸煮)的长程结构,扫描的衍射区域角度变化范围为5~40 °,电压30 kV,电流30 mA,扫描的速度2 °/min。通过衍射图谱观察结晶区与非结晶区的变化。利用Origin软件分析并计算重组米淀粉无定形区域和结晶区域的面积。根据方程计算淀粉颗粒的相对结晶度[15]:
式(4)
式中,RC,Ac和Aa分别是相对结晶度、结晶区域面积和无定形区域面积。
通过傅立叶变换红外光谱法(ATR-FTIR)分析淀粉的短程结构。制备好样品之后,放入红外光谱测定仪(Nicolet 5700)中测量,参数设定如下:扫描整合频谱32倍,扫描分辨率是4 cm-1,波段范围4000~650 cm-1。用Omnic软件对红外光谱图进行分析,记录谱图中1047和1022 cm-1位置上的峰高,淀粉结晶区和无定形区的比值以1047与1022 cm-1的峰高比值代表。
1.2.4 差示扫描量热法分析(DSC) 准确称取3 mg样品(未蒸煮)置于铝坩埚中,加入6 μL去离子水,密封后,静置24 h。以空铝坩埚为参比,将样品坩埚置于差示扫描量热仪的样品池进行分析。分析条件如下:温度范围20~140 ℃,升温速率5 ℃/min。计算起始温度(To)、峰值温度(Tp)、终止温度(Tc)和结晶熔化焓(ΔH)。
1.2.5 扫描电镜分析 通过电镜扫描观察并拍摄样品颗粒(未蒸煮)样貌。处理后的样品用扫描电子显微镜在加速电压为5.00 kV,距离为13.1 mm,在5000放大倍数下进行形貌观察。
1.3 数据处理
实验数据采用SPSS 16.0分析处理,采用Origin 8.0绘图,所有实验组均一式三份平行测定。
2 结果与分析
2.1 β-环糊精、脱支对重结晶大米淀粉消化性的影响
图1为未蒸煮时不同淀粉样品的消化性。RRS的RDS、SDS和RS含量分别为75.51%、8.04%和16.45%。β-CD-RRS的RDS、SDS和RS含量分别为73.70%、7.27%和19.03%。由此可见,添加β-CD后样品的RDS含量由75.51%降至73.70%,但差异不显著。DB-RRS的RDS、SDS和RS含量分别为41.15%、15.02%和43.83%。与RRS样品相比,DB-RRS的RS含量由16.45%增加到43.83%,且差异显著(p<0.05),这是由于脱支可增加直链淀粉含量,促进淀粉重结晶[16]。DB-β-CD-RRS的RDS、SDS和RS含量分别为35.44%、12.22%、52.34%。添加β-CD后,DB-RRS的RS含量由43.83%升高至52.34%(p<0.05),这表明β-CD亦可降低脱支后重结晶淀粉的消化性。通过比较RRS、β-CD-RRS、DB-RRS和DB-β-CD-RRS的RS含量,发现与RRS相比,β-CD-RRS的RS含量增加了2.58%,DB-RRS增加了27.38%,DB-β-CD-RRS增加了35.89%,DB-β-CD-RRS的增量(35.89%)大于前两组样品增量之和(29.96%),这说明脱支和β-CD可协同降低淀粉的消化性。

图1 不同淀粉的RDS、SDS和RS含量(未蒸煮)Fig.1 RDS,SDS,and RS contents of starches(uncooked)注:图中小写字母表示同种消化淀粉不同组间 数据差异显著(p<0.05),图2同。
图2为蒸煮后不同淀粉样品的消化性。蒸煮后,RRS和β-CD-RRS的RS含量分别为1.54%和5.73%,两者差异显著(p<0.05)。可见β-CD-RRS的RS热稳定性高于RRS,这可能是由于β-CD增加了淀粉体系的粘度从而增加抗性淀粉的热稳定性[17]。此外,DB-β-CD-RRS的RS为20.35%,耐热RS保留率为38.9%,高于DB-RRS(15.49%)的保留率35.34%(p<0.05),这可能是由于直链淀粉-β-CD复合物的形成增加了抗性淀粉的稳定性[18]。上述结果表明,β-CD增加了重结晶淀粉中抗性淀粉的热稳定性。

图2 不同淀粉的RDS、SDS和RS含量(蒸煮)Fig.2 RDS,SDS,and RS contents of starches(cooked)
2.2 β-环糊精、脱支对重结晶大米淀粉长程和短程结构的影响
图3展示了各淀粉的X-衍射图(图3a)和相对结晶度(图3c)。X-射线衍射法(XRD)测量的是长程序列,可以测量样品的晶体组成及晶型。从图3(a)可以看出,RRS和β-CD-RRS没有明显的衍射峰,表明RRS和β-CD-RRS没有形成结晶,这可能是由于重结晶时间过短且温度略高而引起的[19]。DB-RRS在2θ为14.3 °、17.0 °、19.6 °、22.0 °和24.1 °处有明显的衍射峰,表明该样品具有B型和V型结晶结构,其结晶度为23.6%。据报道,B型和V型结晶是抗性淀粉的典型晶体结构[20]。与DB-RRS相比,DB-β-CD-RRS具有更强的衍射峰,且在5.2 °处出现了一个新的衍射峰,这表明脱支促进了淀粉-β-CD复合物的形成[18]。综上所述,脱支不仅可加速淀粉的重结晶,还促进淀粉与β-CD形成复合物。因此,脱支和β-CD具有协同提高抗性淀粉含量的作用。
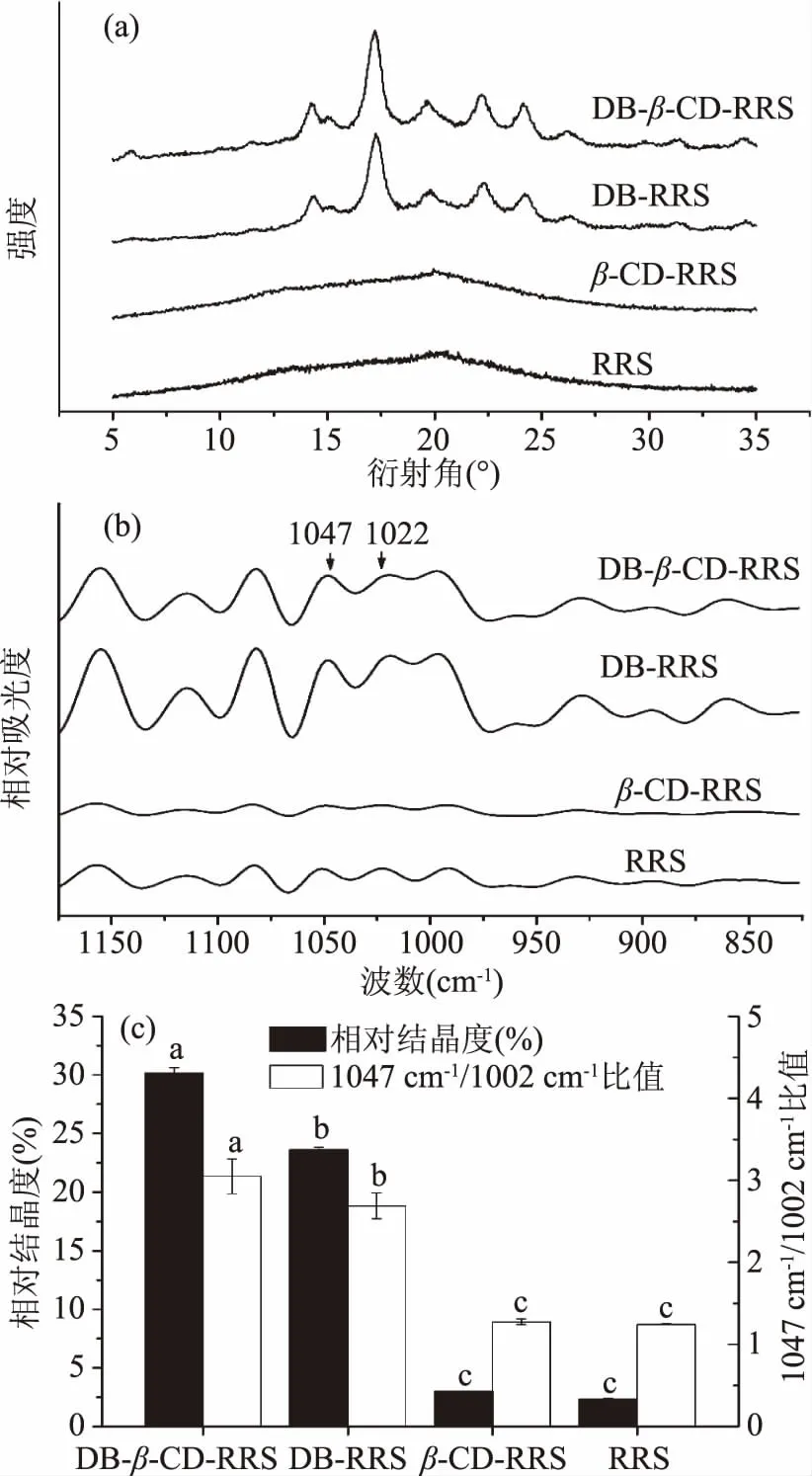
图3 不同淀粉的长程结构(a)、短程结构(b)和结构参数(c)Fig.3 Long-range order(a),short-range order(b) and structural parameters(c)of starches注:图中不同字母表示同一指标间 各组数据差异显著(p<0.05)。
图3(b)为淀粉样品的红外光谱图,主要测量分子中短程序列,它反映的是分子内的作用现象。红外光谱图中1047和1022 cm-1处吸光度的值表示淀粉中结晶区和无定形结构的变化,1047与1022 cm-1吸光度的比值表示淀粉中结晶区与无定形区的比例,它可以定量的反映颗粒表面淀粉链的有序化程度和结晶度。
从图3(c)中可以得出,DB-β-CD-RRS、DB-RRS、β-CD-RRS、RRS的1047 cm-1/1022 cm-1比值分别为3.05、2.69、1.28、1.25。DB-β-CD-RRS 的1047 cm-1/1022 cm-1比值最大为3.05,其显著高于DB-RRS(p<0.05),且均高于β-CD-RRS和RRS。β-CD-RRS和RRS没有显著性差异(p<0.05)。该结果说明DB-β-CD-RRS和DB-RRS显示出较高的结晶度,其与XRD分析结果一致。
2.3 差示扫描量热法分析
实验发现,在RRS和β-CD-RRS的DSC曲线中没有吸热峰,表明两者中没有晶体的形成,这与X-衍射分析结果一致。如表1所示,DB-RRS具有一个吸热峰,其熔融温度在84.4~106.0 ℃范围,这主要是淀粉脱支后重结晶晶体解体峰[21-22]。由此可见,DB-RRS结晶的热稳定较高,这也说明DB-RRS在蒸煮后仍具有较高含量的RS。除淀粉重结晶的吸热峰外,DB-β-CD-RRS在115.9~125.0 ℃范围具有吸热峰,推测这是由于β-CD-淀粉复合物导致的[18]。上述结果表明,DB-β-CD-RRS中抗性淀粉热稳定性高于DB-RRS,与蒸煮实验结果一致。

表1 淀粉的糊化温度和热焓值 Table 1 Gelatinization temperatures and enthalpy of starch
2.4 RRS、β-CD-RRS、DB-RRS和DB-β-CD-RRS的形貌扫描电镜分析
如图4所示,RRS呈片状结构,具有该结构的淀粉表面积较大,因此与淀粉酶的接触几率较大,易被酶解,从而含有较低的抗性淀粉。添加β-CD没有显著改变重结晶大米淀粉的微观形貌,β-CD-RRS仍呈片状结构。然而,DB-RRS呈紧实的球形颗粒结构,为淀粉脱支后重结晶形成的聚集体。与上述片状结构相比,颗粒聚集体的表面积更小,与淀粉酶接触的几率更小。因而,DB-RRS对酶的抗性远高于RRS和β-CD-RRS。DB-β-CD-RRS具有与DB-RRS相似的结构,且DB-β-CD-RRS的颗粒大于DB-RRS,结构更紧密,这可能是由于淀粉-β-CD复合物的形成,该结果证明脱支处理和β-环糊精对于提高重结晶淀粉的抗性具有协同作用。

图4 RRS、β-CD-RRS、DB-RRS和DB-β-CD-RRS的SEM照片Fig.4 Morphology of RRS,β-CD-RRS,DB-RRS and DB-β-CD-RRS注:a:RRS;b:β-CD-RRS;c:DB-RRS;d:DB-RRS。
3 结论
脱支处理可加速大米淀粉的重结晶,使糊化的大米淀粉在较短的时间内重结晶形成B+V型晶体,从而提高重结晶淀粉的抗性;脱支处理结合β-环糊精可促进淀粉-β-环糊精复合物的形成,从而进一步增强重结晶大米淀粉的晶体含量、提高重结晶淀粉的抗性。此外,DSC分析表明,脱支处理结合β-环糊精可使重结晶大米淀粉的晶体热稳定性高于单纯脱支后的重结晶大米淀粉。综上所述,脱支处理和β-环糊精可有效协同增加重结晶淀粉的抗性与抗性淀粉的热稳定性。

