富核糖核酸热带假丝酵母发酵培养基优化
黄 芳,李 欣,李 沛,李 库,王 志,代 俊,陈 雄*
(1.湖北工业大学 生物工程与食品学院 发酵工程教育部重点实验室 工业发酵湖北省协同创新中心,湖北 武汉 430068;2.安琪酵母股份有限公司 湖北省酵母功能重点实验室,湖北 宜昌 443003)
核糖核酸(ribonucleic acid,RNA)是一类十分重要的生物大分子,它不仅在基因的表达和蛋白质的生物合成中起着关键的作用,而且能促进细胞的诸多生理功能。核苷酸和核糖核苷酸是核酸的不完全水解物,研究表明,RNA及其降解物核苷酸具有维持机体免疫功能、抗氧化、提高机体蛋白质和铁的生物利用率、降低胆固醇和抗衰老等多种生理功能[1-2]。因此,RNA及其降解物在医药、保健、农业生产、食品加工、饲料工业、化妆品等行业都有着重要作用[3-6]。
核糖核酸的来源较为广泛,核糖核酸通常在细菌中的含量为0.3%~9.7%,酵母中的含量为2.7%~15.0%,霉菌中的含量为0.7%~2.8%[7]。目前核糖核酸工业生产方法以酵母发酵法为主[5,8-9],然后从酵母中提取RNA,被用于工业化微生物法生产RNA的菌种主要有酿酒酵母(Saccha romyces cerevisiae)和解脂假丝酵母(Candida lipolytica)[10]。其中,热带假丝酵母(Candida tropicalis)RNA含量较高,一般在8%以上。许多关于高核酸酵母菌的选育多集中在假丝酵母属[11-12]。YOSHOIO N等[12]通过化学诱变的方式得到了对数生长期核酸含量达11%的解脂假丝酵母。杨依顺等[13]筛选到一株高核酸酿酒酵母,通过连续发酵,其RNA含量达到6.05%。
目前,工业化酵母培养多采用以糖蜜为碳源的发酵培养基[14],糖蜜内含有大量的可发酵糖,其主要成分为蔗糖,同时还含有丰富的矿物质(钾、氯、钠、镁等)、维生素、氨基酸等,对微生物的生长有利[15-17]。因其价格低廉,营养丰富,被用于工业化培养酵母的主要碳源。盛建国等[18]利用高核酸酵母K-79发酵糖蜜制备RNA,能得到6.5%左右的产率。在发酵过程中,RNA含量的变化情况主要呈现出两个明显的阶段:前期的积累和后期的降解。基于这一现象可通过一些补料发酵调控方式如补加碳氮源或补加合成RNA的前体物质(氨基酸[19]、碱基)等来延长前期RNA积累的过程、强化RNA积累的速率以及减缓后期RNA的降解速率,来研究热带假丝酵母高产RNA的发酵工艺。俞灿等[20]利用酿酒酵母,以糖蜜为碳源,采用碳源、氮源、磷源流加补料工艺,RNA含量达到8.11%。富含核糖核酸酵母的细胞量和RNA产量不高仍是我国酵母核酸产业现有的两大关键问题。
本试验利用一株热带假丝酵母(Candida tropicalis)AY91009,以糖蜜为碳源,通过响应面分析试验优化其发酵培养基,并进行20 L发酵罐分批试验,为高核酸热带假丝酵母的工业生产发酵研究提供了理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
热带假丝酵母(Candida tropicalis)AY91009:中国典型培养物保藏中心。
1.1.2 化学试剂
酵母浸粉(生化试剂)、甘蔗糖蜜(含糖量30%左右):安琪酵母有限公司;蛋白胨(生化试剂):北京双旋微生物培养基制品厂:琼脂(生化试剂):中国Biosharp公司;其他实验所用试剂(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基(种子培养基):葡萄糖2%,酵母浸粉1%,蛋白胨2%,115℃灭菌20 min。
斜面培养基:葡萄糖2%,酵母浸粉1%,蛋白胨2%,琼脂2%,115℃灭菌20 min。
基础发酵培养基:葡萄糖4%,酵母浸粉1%,KH2PO40.3%,(NH4)2SO41%,MgSO4·7H2O 0.12%,ZnSO4·7H2O 0.015%,FeSO4·7H2O 0.015%,pH5.0±0.05,装液量50 mL/250 mL,115℃灭菌20 min。
酵母浸粉蔗糖(yeast extract sucrose,YES)培养基(发酵罐种子培养基):蔗糖5%,酵母浸粉1%,MgSO4·7H2O 0.05%,KH2PO40.05%,pH5.0±0.2。
1.2 仪器与设备
DELTA 320 pH计:梅特勒-托利多仪器(上海)有限公司;YXQ-LS-75S11立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;5417R型冷冻离心机:德国Eppendorf公司;UVmini-1240紫外-可见分光光度计:日本岛津公司;HH-2数显恒温水浴锅:常州国华电器有限公司;HNY-211B全温振荡培养箱:天津欧诺仪器仪表有限公司;BIOTECH-3000 20 L发酵罐:上海保兴生物设备工程有限公司。
1.3 方法
1.3.1 菌株的活化及种子液的制备
将斜面保藏的热带假丝酵母菌株AY91009接一环至装有100 mL YEPD培养基的摇瓶中活化,培养条件为200 r/min、30℃,培养12 h。再将活化好的液体菌液按5%接种量接种至基础发酵培养基,培养条件为30℃、200 r/min,培养12 h后取样检测。
1.3.2 发酵培养基单因素优化试验
(1)糖蜜含量的优化
每100 mL培养基设置不同的糖蜜体积(6 mL、8 mL、10 mL、12 mL、14 mL、16 mL),以糖蜜取代基础发酵培养基中的葡萄糖为碳源,其余培养条件不变,培养12 h后取样检测生物量与RNA含量。
(2)氮源的选择及添加量优化
分别以1%的酵母浸粉、牛肉膏、玉米浆、氯化铵、硫酸铵、硝酸铵为氮源,其余培养条件不变,培养12 h后取样检测生物量与RNA含量。
氮源添加量的优化:选择优化后的氮源,设置不同的氯化铵添加量(0、0.3%、0.5%、0.7%)和不同的酵母浸粉添加量(0、1%、2%、3%、4%),空白组中不含任何氮源,其余培养条件不变,培养12 h后取样检测生物量与RNA含量。
混合氮源比例的确定:在上述氮源总质量浓度不变的基础上,调节酵母浸粉和氯化铵的混合质量比,分别为2.50∶0、2.25∶0.25、2.00∶0.50、1.75∶0.75、1.50∶1.00、1.25∶1.25、1.00∶1.50、0.75∶1.75、0.50∶2.00、0.25∶2.25、0∶2.50,其余培养条件不变,培养12 h后取样检测生物量与RNA含量。
(3)磷源的选择及添加量的优化
分别将0.3%的磷酸二氢钾(KH2PO4)、三水磷酸氢二钾(K2HPO4·3H2O)、二水磷酸二氢钠(NaH2PO4·2H2O)、十二水磷酸氢二钠(Na2HPO4·12H2O)作为培养基中的磷源,其余培养条件不变,培养12 h后取样检测生物量与RNA含量。
磷源添加量的优化:设置不同的NaH2PO4·2H2O添加量(0、0.05%、0.10%、0.20%、0.30%),其余培养条件不变,培养12 h后取样检测生物量与RNA含量。
(4)无机盐的优化
对MgSO4·7H2O和ZnSO4·7H2O在0~0.25%之间设置6个浓度梯度,FeSO4·7H2O在0~0.1%之间设置6个浓度梯度,进行试验,其余培养条件不变,培养12 h后取样检测生物量与RNA含量。
1.3.3 培养基配方优化响应面分析[21-22]
(1)Plackett-Burman试验设计
根据单因素试验结果,选取各个因素的水平,进行2水平的Plackett-Burman试验用Design Expert 8.0.6软件筛选出影响RNA含量的显著因子,再通过最陡爬坡试验确定显著因子的的浓度范围,再通过响应面分析对显著因子的水平进行优化确定最佳培养基配方,Plackett-Burman试验因素与水平见表1。
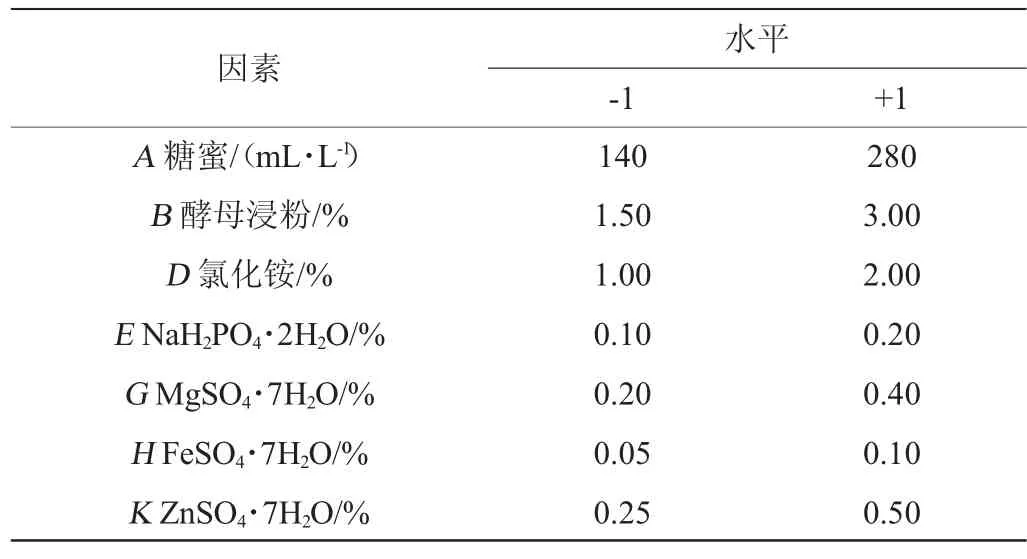
表1 Plackett-Burman试验因素与水平Table 1 Factors and levels of Plackett-Burman experiments
(2)最陡爬坡试验
根据Plackett-Burman试验结果,从众多因素中筛选出影响RNA含量加大的3个显著因素,以此来确定各因素的水平、爬坡方向和步长,能快速、经济逼近最佳值区域,从而确定响应面试验中心点。
(3)响应面试验
根据最陡爬坡试验确定了重要因素质量分数的取值区间。利用Design-Expert10.0进行中心组合试验设计(central composite design,CCD),将最陡爬坡试验中的因素分别标记为X1、X2、X3,以发酵培养12 h后菌体中RNA含量为响应值,标记为Y,中心组合试验因素变量与水平见表2。
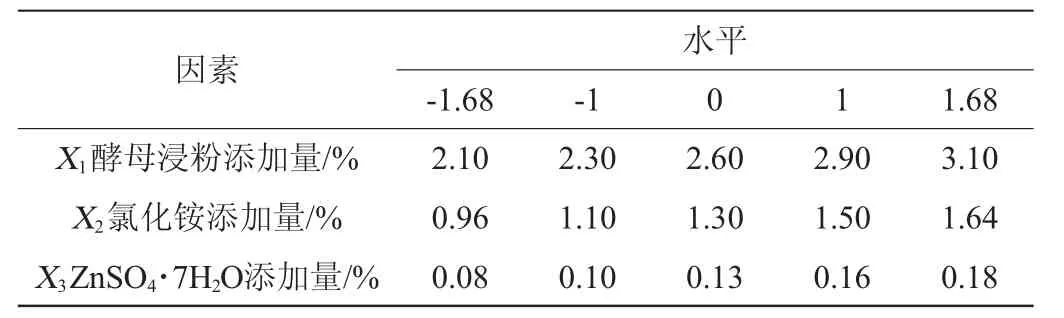
表2 响应面试验的因素与水平Table 2 Factors and levels of response surface experiments
1.3.4 发酵罐小试发酵
将斜面保藏菌种接种一到两环到YES培养基,200 r/min、30℃摇床培养基12 h后,按2.5%接种量接到1瓶YES培养基(100 mL/瓶)中200 r/min、30℃摇床培养12 h,将1瓶种子液接种到装有5 L YES培养基的20 L发酵罐中,设定发酵条件为100 r/min、30℃,通气0.4 m3/h培养11 h,再将115℃灭菌20 min后的发酵培养基接入发酵罐内,发酵初始体积为12 L,发酵温度30℃,前3小时的pH控制在5.5,转速600 r/min,通气量1.44 m3/h,3 h后pH控制在4.5,转速400 r/min,通气量0.96 m3/h,每小时取样检测。
1.3.5 分析检测
(1)RNA含量的测定方法[23]
吸取5 mL培养液于10 mL离心管内,然后8 000 r/min离心10 min,倒去上清,称量菌体湿质量;用清水洗涤菌体2次,然后加入8 mL预冷的0.25 mol/L高氯酸(HClO4)溶液并振荡摇匀,在4℃的冰箱静置15 min,4 000 r/min离心10 min,倒去上清液再加入5 mL 0.5 mol/L高氯酸溶液并振荡摇匀,再放置70℃的恒温水浴锅中处理15 min,期间每到2~3 min振荡一次;再于4 000 r/min离心10 min,吸取1 mL上清液于100 mL容量瓶并用蒸馏水定容。在波长260 nm处测量吸光度值,用蒸馏水作为空白,并记录吸光度值。RNA含量计算公式如下:
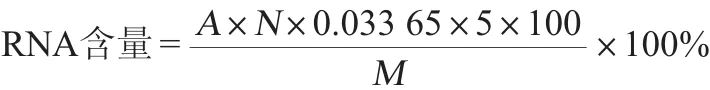
式中:A为样品溶液的吸光度值;N为样品稀释倍数;0.033 65为对应于吸光度值为1.00时,待测溶液中RNA的含量,mg/100 mL;5为在加入0.5 mol/L HClO4后溶液的体积,mL;M为称取样品的干质量,mg。
(2)生物量测定方法
吸取10 mL酵母菌液于干燥并已称量质量的离心管中,8 000 r/min离心10 min,收集酵母菌体。用去离子水洗涤菌体2次,放入80℃的烘箱中烘干至恒质量,称质量并计算生物量(细胞干质量(dry cell mass,DCM)),其计算公式如下:
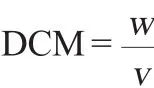
式中:DCM为生物量,g/L;w为一定体积发酵液质量,g;v为发酵液体积,mL。
1.3.6 数据处理
Plackett-Burman试验和响应面优化试验均采用Design-Expert8.0.6设计软件进行设计分析,试验均进行3次重复取平均值。
2 结果与分析
2.1 热带假丝酵母基本性能评价
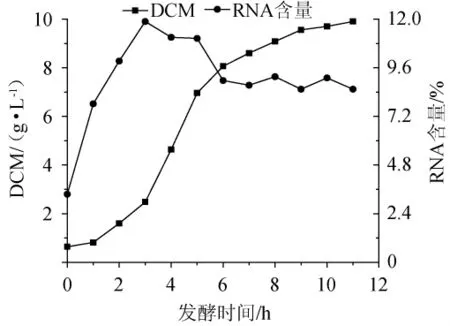
图1 热带假丝酵母AY91009的生长状况和RNA含量Fig.1 Growth situation and RNA content of Candida tropicalis AY91009
热带假丝酵母AY91009在基础培养基中摇瓶培养11 h,每小时取样检测生物量和RNA含量,结果见图1。由图1可知,热带假丝酵母在0~1 h处于生长停滞期,1~7 h处于对数生长期,7~11 h到达稳定期;RNA含量的变化分为两个阶段,0~3 h RNA含量逐渐积累,3 h时RNA含量最高,为11.88%,3~7 h随着生物量的增加RNA不断降解,后期基本维持稳定,在发酵结束(第11小时)时RNA含量为8.54%,该菌株RNA含量情况的各阶段十分清晰,且在菌体进入稳定期后RNA含量也处于比较稳定的状态。
2.2 单因素优化试验
2.2.1 糖蜜含量的优化
不同糖蜜含量对热带假丝酵母AY91009生物量和RNA含量的影响,结果见图2。由图2可知,当糖蜜含量为6~16 mL/100 mL时,生物量先上升后趋于平稳,虽然当糖蜜含量为16 mL/100 mL时,其生物量和RNA含量最佳,分别为7.48 g/L和10.30%;但当糖蜜含量为14 mL/100 mL和16 mL/100 mL时,RNA含量分别为10.15%和10.30%,差异不大,且生物量的差别也较小。因此,出于节约成本的考虑,选择糖蜜含量为14 mL/100 mL的培养基进行后续试验。
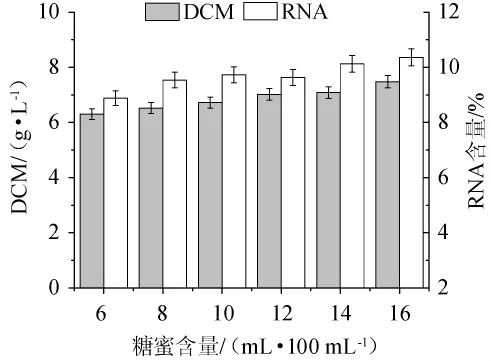
图2 不同糖蜜含量对菌株AY91009生物量和RNA含量的影响Fig.2 Effect of different molasses volume on biomass and RNA content of strain AY91009
2.2.2 氮源的优化
不同氮源及不同氮源的质量浓度对热带假丝酵母的生物量及RNA含量的影响,结果见图3。由图3A可知,有机氮源中酵母浸粉的效果最好,生物量和RNA含量最高,分别为8.52 g/L和10.85%;无机氮中添加氯化铵时,RNA含量最高,为9.27%。酵母浸粉价格较高。因此,为了降低成本决定选用酵母浸粉和氯化铵作为混合氮源。
由图3B可知,氯化铵含量在0~0.7%时,生物量基本一致,RNA含量先上升后下降,在氯化铵含量为0.5%时RNA含量为10.42%,因此,氯化铵的最佳含量为0.5%。酵母浸粉用量为0~4%时,RNA含量随着酵母浸粉用量的增加先上升后下降,在含量为2%时达到最高为11.11%;生物量在酵母浸粉用量为0~3%范围内逐步上升,在酵母浸粉用量3%~4%后逐步下降,综合考虑生物量和RNA含量,酵母浸粉的最佳用量为2%。因此,确定培养基中氮源总浓度为2.5%,在此基础上调节两种物质的混合比例。
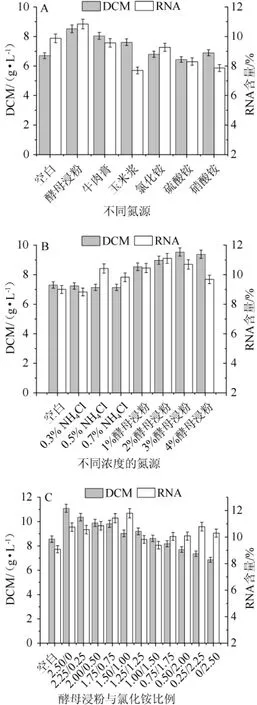
图3 不同氮源(A)、不同NH4Cl和酵母浸粉添加量(B)及酵母浸粉与NH4Cl质量比(C)对菌株AY91009生物量和RNA含量的影响Fig.3 Effect of different nitrogen sources(A),different NH 4Cl and yeast extract powder addition(B)and yeast extract powder to NH4Cl mass ratio(C)on biomass and RNA content of strain AY91009
由图3C可知,生物量随着混合氮源中酵母浸粉比例的减少而降低,RNA含量随着混合氮源中酵母浸粉比例的减少先上升后下降又有一定的上升,最终选择酵母浸粉与氯化铵质量比为1.50∶1.00,即酵母浸粉添加量为1.50%、氯化铵添加量为1.00%,此时RNA含量为11.80%,生物量为9.04 g/L。
2.2.3 磷源的优化
不同磷源及其添加量对热带假丝酵母生物量和RNA含量影响结果见图4。
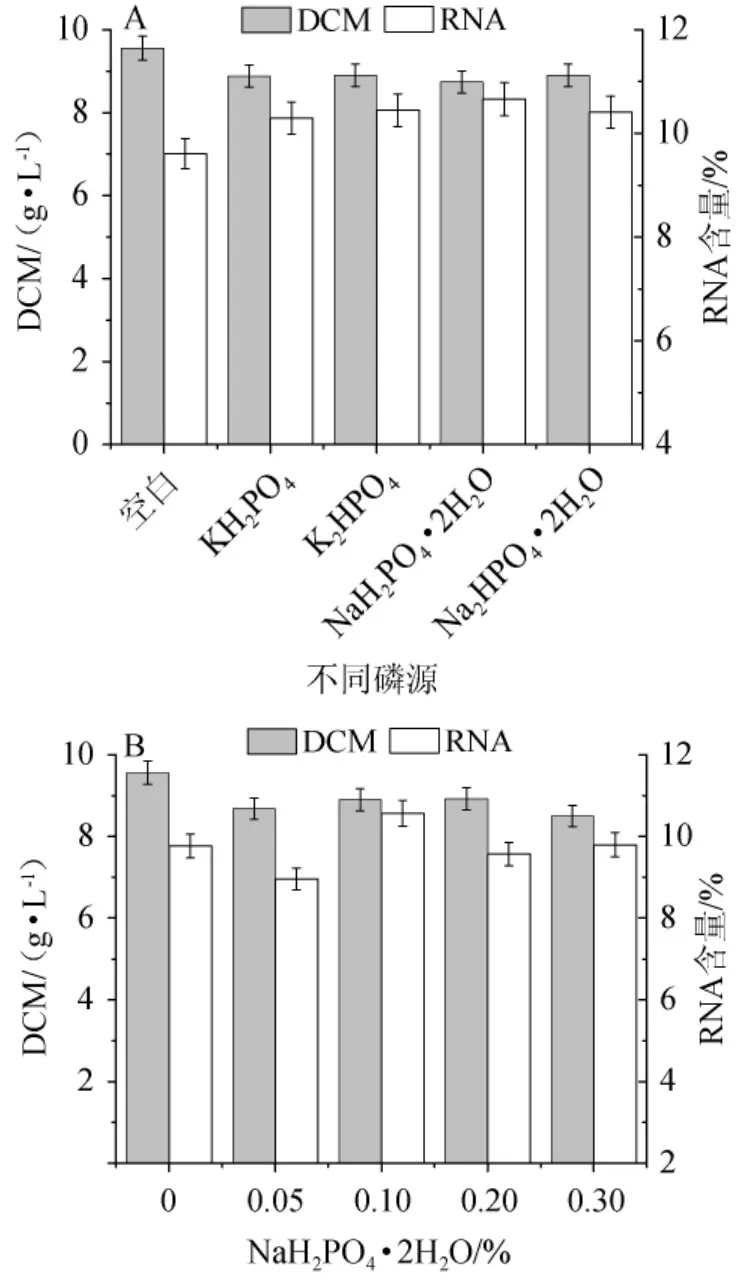
图4 不同磷源(A)及不同NaH2PO4·2H2O添加量(B)对菌株AY91009生物量和RNA含量的影响Fig.4 Effect of different phosphorus sources(A),different NaH2PO4·2H2O addition(B)on biomass and RNA content of strain AY91009
由图4A可知,添加不同磷源,生物量变化不大且都比对照小,说明添加不同磷源对菌体生长都有一定的抑制作用;但都对RNA含量有一定影响,其中NaH2PO4·2H2O组RNA含量最高,为10.66%,因此,选择NaH2PO4·2H2O作为磷源。
由图4B可知,NaH2PO4·2H2O添加量在0.05%~0.30%时,生物量变化不明显,RNA含量先上升后下降,当NaH2PO4·2H2O添加量为0.10%时,生物量和RNA含量分别为8.9 g/L、10.57%。因此,NaH2PO4·2H2O的最佳添加量0.10%。
2.2.4 无机盐的优化
不同无机盐对热带假丝酵母生物量和RNA含量影响结果见图5。由图5A可知,MgSO4·7H2O含量在0~0.25%时,RNA含量逐步上升最后维持稳定。因此,MgSO4·7H2O的最佳添加量0.20%。
由图5B可知,当FeSO4·7H2O含量在0~0.05%时,RNA含量逐步上升,当FeSO4·7H2O含量>0.05%之后开始下降;FeSO4·7H2O的含量对生物量的影响不大,在0~0.10%内趋于平稳。因此,FeSO4·7H2O的最佳添加量0.05%。
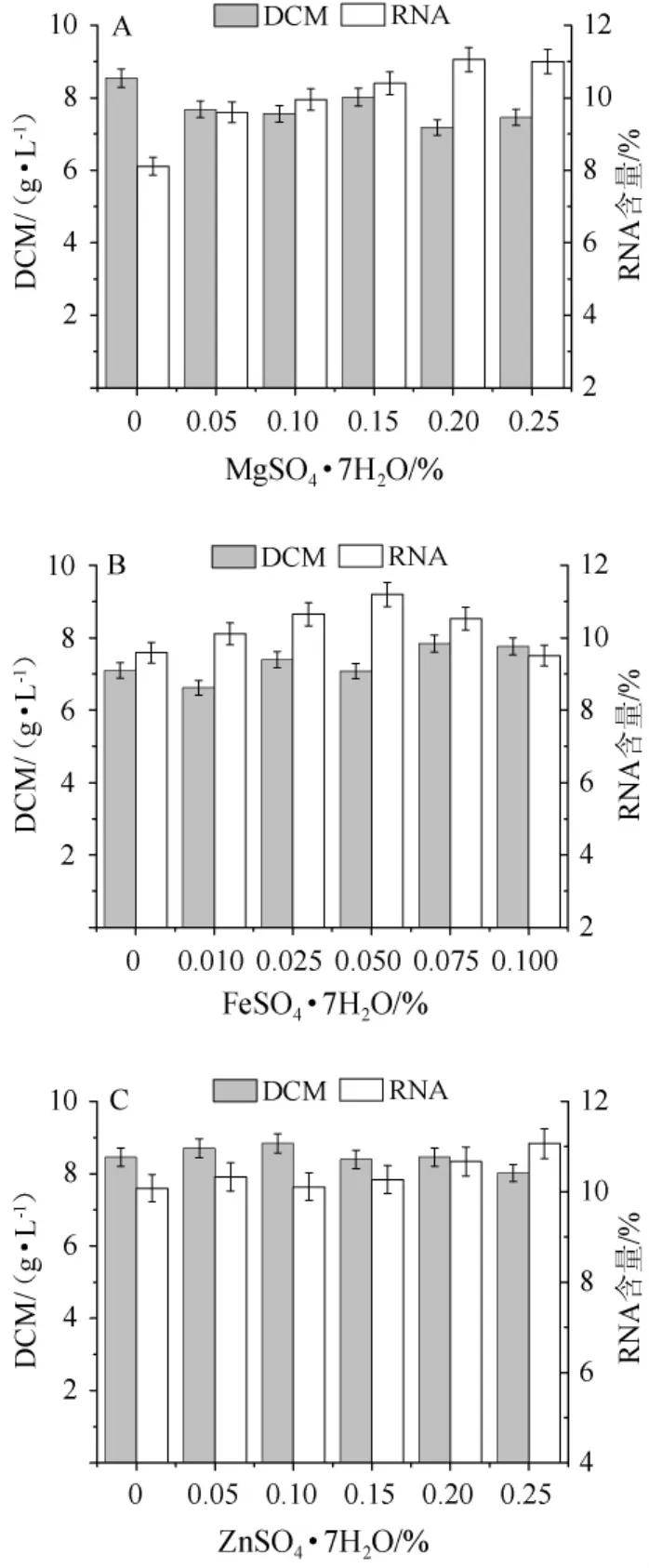
图5 MgSO4·7H2O(A)、FeSO4·7H2O(B)、ZnSO4·7H2O(C)添加量对菌株AY91009生物量和RNA含量的影响Fig.5 Effect of MgSO 4·7H2O(A),FeSO 4·7H2O(B)and ZnSO4·7H2O(C)addition on biomass and RNA content of strain AY91009
由图5C可知,当ZnSO4·7H2O含量在0~0.15%时,RNA含量几乎没变化,当ZnSO4·7H2O含量>0.15%之后逐步上升;ZnSO4·7H2O的含量在0~0.25%之间对生物量的影响是先上升后缓慢下降。因此,ZnSO4·7H2O最佳添加量0.25%。
2.3 响应面分析结果
2.3.1 Plackett-Burman试验
按照Plackett-Burman试验设计,把每个因素设计成高(+1)、低(-1)2个水平,高水平为低水平的2倍,RNA含量为响应值,具体试验设计见表3,各因素效应分析见表4。
由表4可知,糖蜜、酵母浸粉、氯化铵、NaH2PO4·2H2O、MgSO4·7H2O表现为正效应,FeSO4·7H2O、ZnSO4·7H2O表现为负效应。可信度>95%的因素为酵母浸粉、氯化铵、ZnSO4·7H2O,表现为显著(P<0.05),且这3个因素的贡献值都排在前三位。因此,确定酵母浸粉、氯化铵、ZnSO4·7H2O为主要影响因素进行下一步最陡爬坡试验。
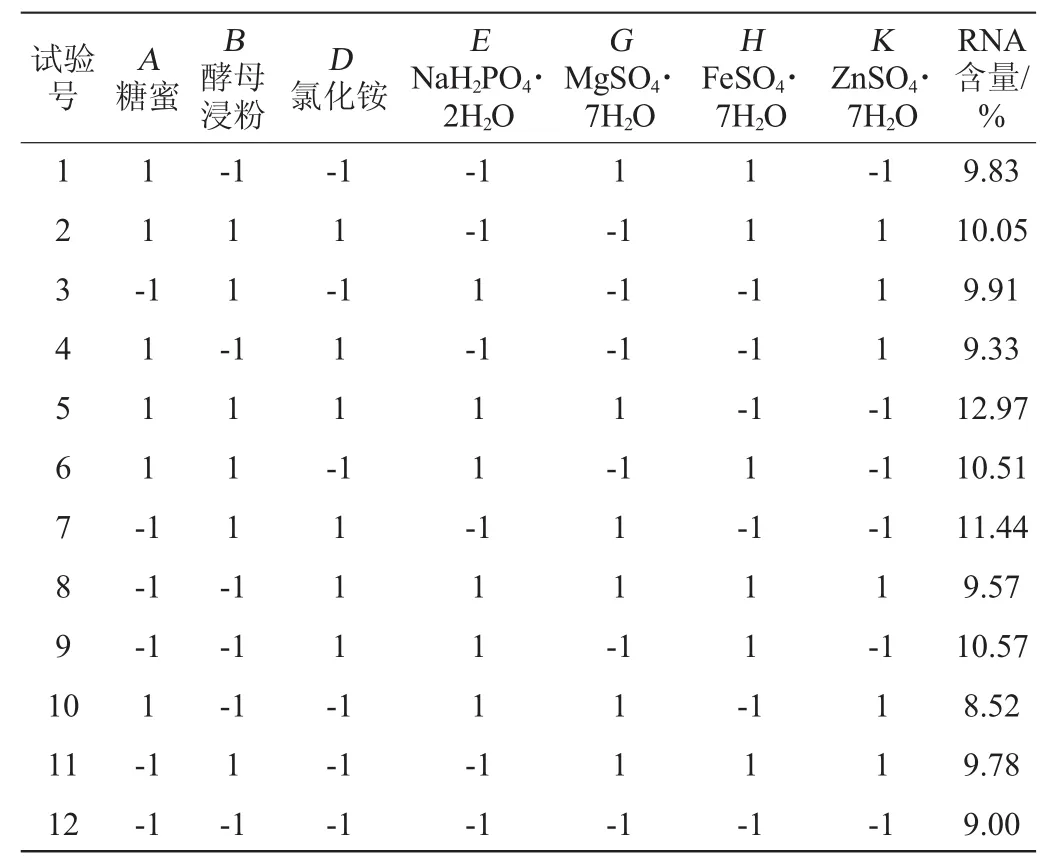
表3 Plackett-Burman试验设计与结果Table 3 Design and results of Plackett-Burman experiments
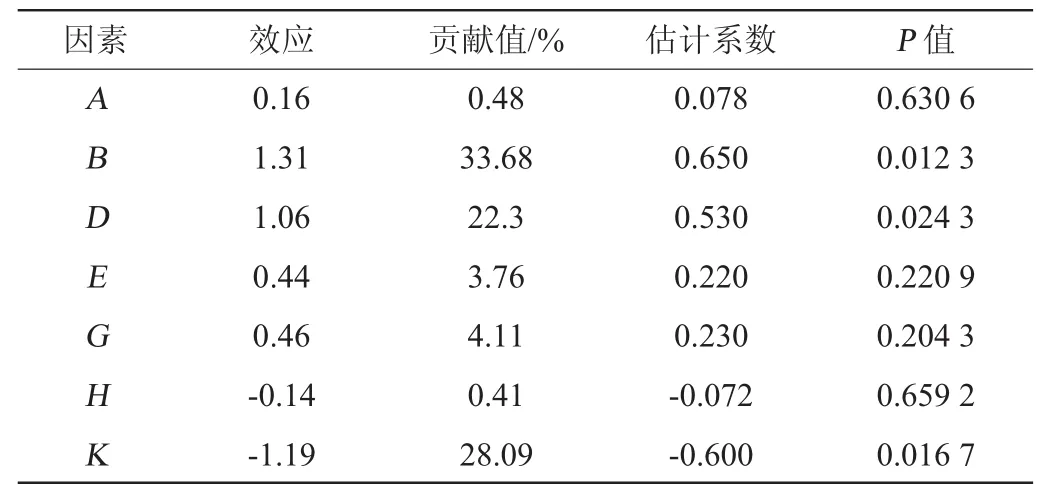
表4 Plackett-Burman试验各因素效应分析Table 4 Effect analysis of each factor of Plackett-Burman experiments
2.3.2 最陡爬坡试验结果
根据Plackett-Burman试验的分析结果,显著因素的步长及分析结果见表5。
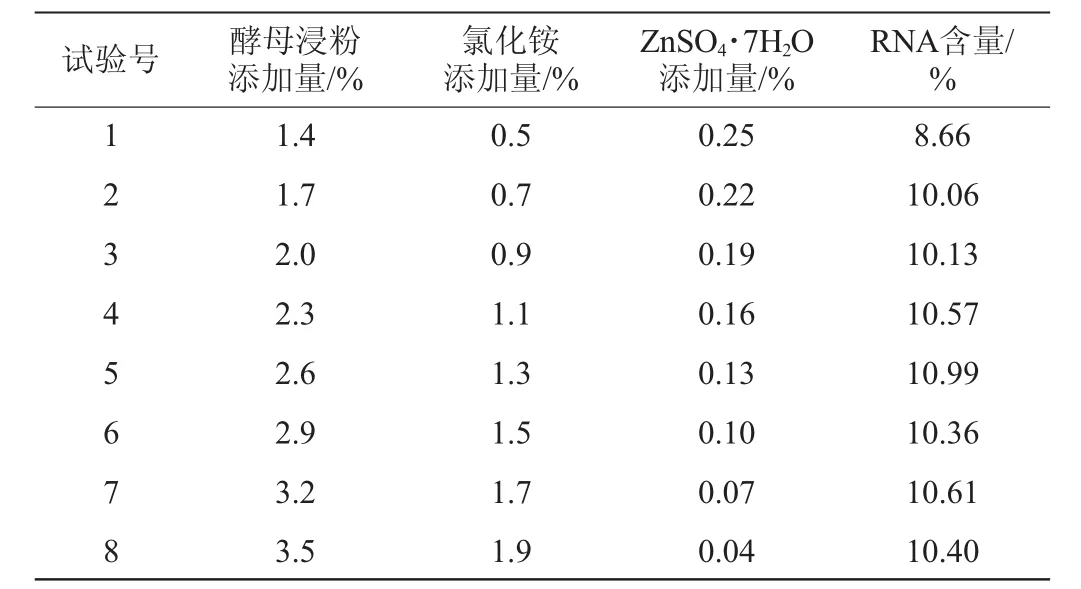
表5 最陡爬坡试验设计及结果Table 5 Design and results of steepest ascent experiments
由表5可知,最高的RNA含量的因素对应的添加量在第5组,因此,选择第5组作为响应面的中心点,即酵母浸粉2.60%,氯化铵1.30%,ZnSO4·7H2O 0.13%。
2.3.3 响应面分析试验设计及结果
根据最陡爬坡试验确定了重要因素添加量的取值区间。利用Design-Expert进行中心组合的试验设计,将最陡爬坡试验中的因素分别标记为X1、X2、X3,以发酵培养12 h后菌体中RNA含量为响应值,标记为Y,中心组合试验设计结果见表6,方差分析见表7。
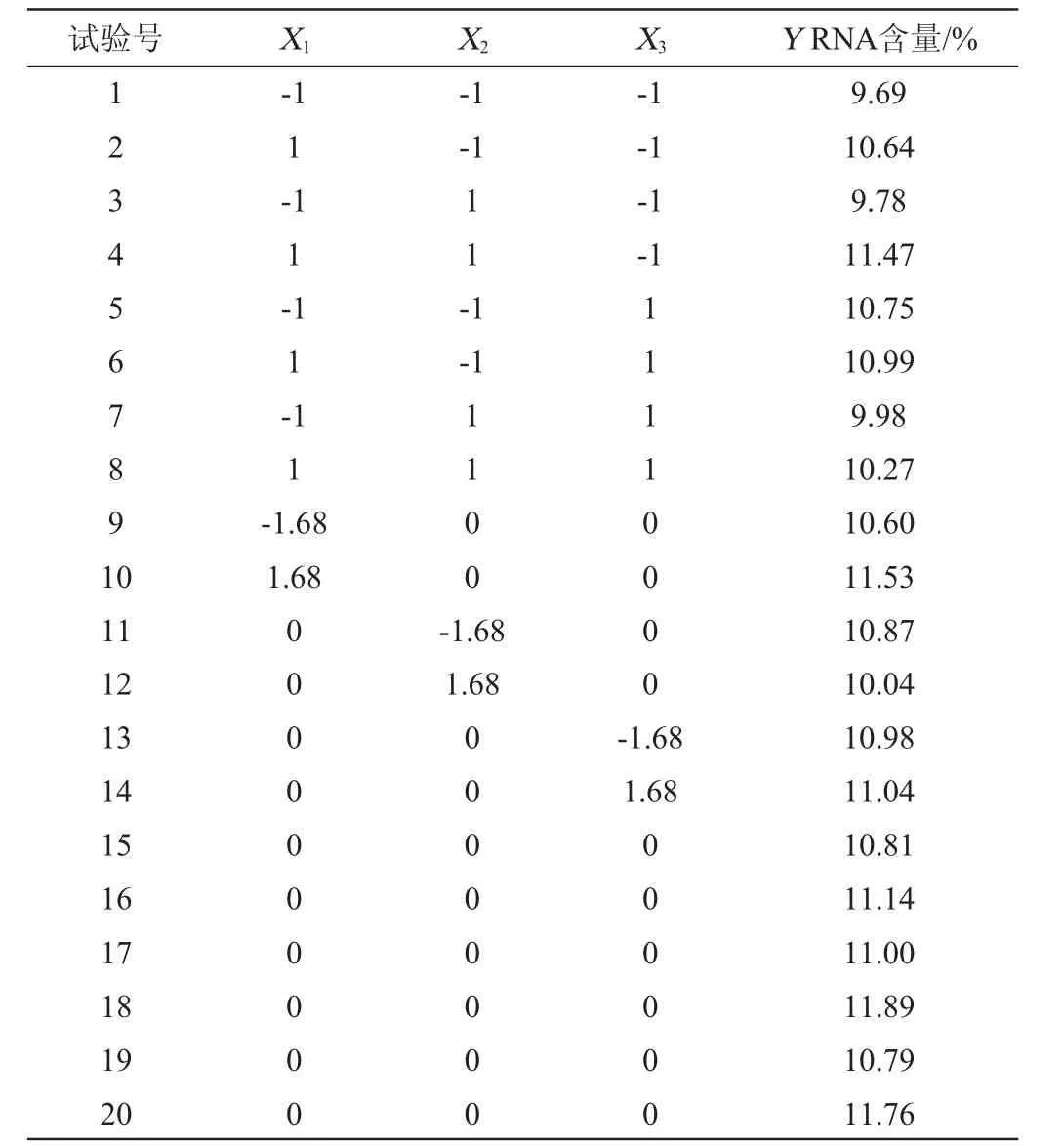
表6 响应面试验设计及结果Table 6 Design and results of response surface experiments
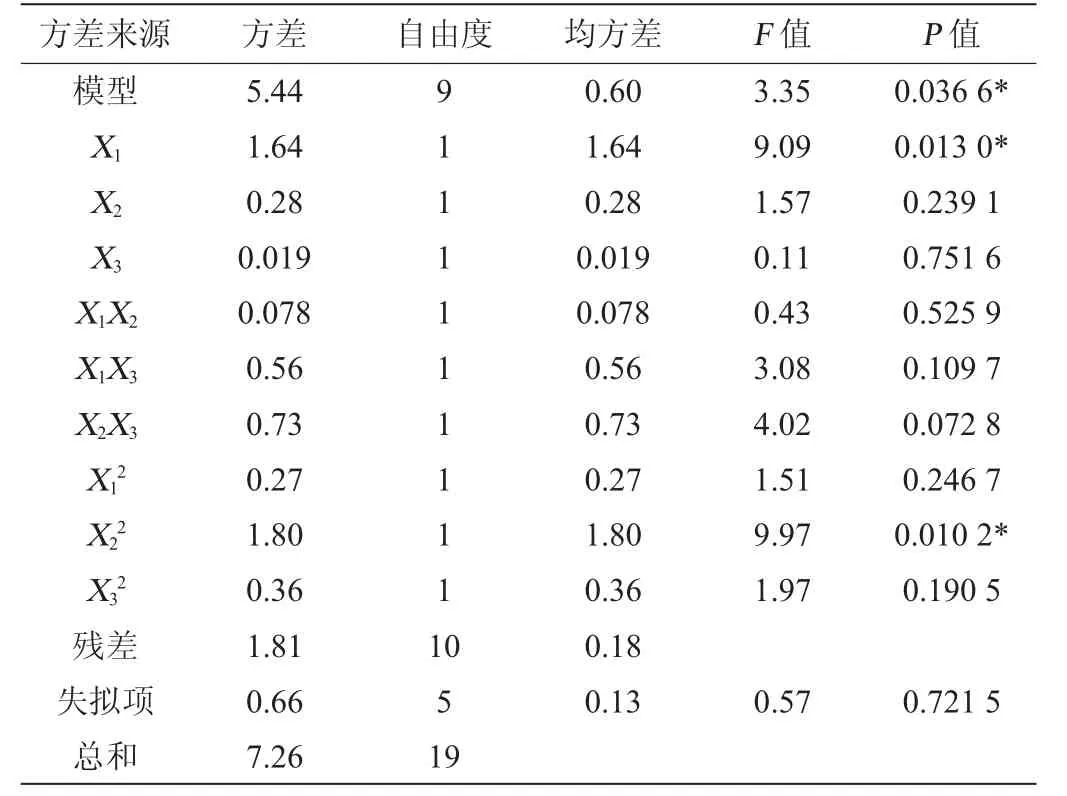
表7 回归模型方差分析Table 7 Variance analysis of regression model
根据表6的试验结果通过Design-Expert 10.0分析软件进行响应面分析,建立多元二次回归方程:Y=11.24+0.35X1-0.14X2+0.037X3+0.099X1X2-0.26X1X3-0.3X2X3-0.14X12-0.35X22-0.16X32。由表7可知,模型P=0.036 6<0.05,表明该模型显著,失拟项P=0.721 5>0.05,不显著,表明回归方程拟合程度良好,可以用此模型对响应值进行分析和预测。一次项X1、二次项X22对结果影响显著(P<0.05),决定系数R2=0.850 9,表明模型在85.09%程度上能够解释RNA含量与因素变量之间的关系,而调整决定系数R2adj=0.826 7,与R2数值相接近表明模型预测值和实际试验结果具有较好的相关性。
2.3.4 最佳添加量的确定及验证试验
根据上述回归方程绘出响应面分析图,结果见图6。由图6可知,该方程的抛物线图形开口均向下,说明存在最大值,即响应面覆盖了最大值所在的区域。由Design-Expert10.0分析得到最适培养基组成为糖蜜140 mL/L、酵母浸粉2.90%、氯化铵1.37%、NaH2PO4·2H2O 0.10%、MgSO4·7H2O 0.20%、FeSO4·7H2O 0.05%、ZnSO4·7H2O 0.10%。预测在此条件下,RNA含量能达到11.56%。

图6 酵母浸粉、NH4Cl和ZnSO4·7H2O添加量交互作用对RNA含量影响的响应面和等高线Fig.6 Response surface plots and contour line of effects of interaction between yeast powder,NH 4Cl and ZnSO4·7H2O addition on RNA content
使用上述优化后的培养基进行摇瓶验证试验,热带假丝酵母的发酵生长及RNA含量如图7所示,发酵结束即第12小时RNA含量达到11.58%,与理论值11.56%相差不大,比优化前(8.54%)提高了35.6%。
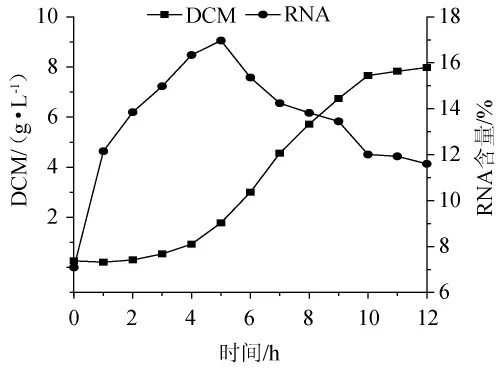
图7 优化培养基对热带假丝酵母AY91009的生长和RNA含量的影响Fig.7 Effect of optimized medium on growth and RNA content of Candida tropicalis AY91009
2.4 20 L发酵罐发酵性能评估
利用响应面优化确立的最适发酵培养基在20 L发酵罐水平进行发酵验证,结果见图8。由图8可知,发酵结束(第13小时)时,生物量达到32.38 g/L,RNA含量为6.69%,总RNA含量(每升发酵液中的RNA含量)为2.17 g/L;RNA含量先上升后下降,在第3小时达到最高点为11.33%,随着生物量的增加,RNA不断降解,在第12小时的时候RNA降到最低点,到13 h又有一定的回升,3~12 h平均每小时RNA降解速率为0.49%,表明热带假丝酵母AY91009是一株有潜力的工业化生产菌株。
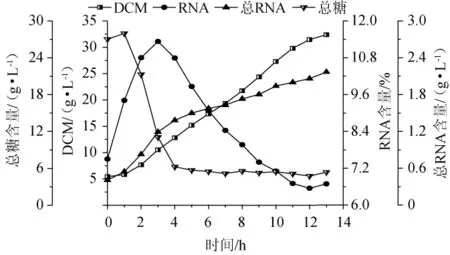
图8 在20 L发酵罐优化培养基中热带假丝酵母AY91009的生长和RNA含量变化Fig.8 Changes of growth and RNA content of Candida tropicalis AY91009 in optimized medium of 20 L fermentation
3 结论
本试验通过现有一株热带假丝酵母菌株AY91009,在初始培养基上RNA含量为8.54%。并以糖蜜为培养基碳源,采用响应面法,建立了酵母浸粉、氯化铵和ZnSO4·7H2O用量的二次回归模型,确定最适发酵培养基为:糖蜜(30%含糖量)140 mL/L、酵母浸粉2.9%、氯化铵1.37%、NaH2PO4·2H2O 0.1%、MgSO4·7H2O 0.2%、FeSO4·7H2O 0.05%、ZnSO4·7H2O 0.1%。在此培养基中RNA含量达11.58%,比优化前提高了35.6%。最后利用20 L的发酵罐进行发酵验证,发酵13 h生物量达32.38 g/L,RNA含量达6.69%,总RNA为2.17 g/L。

