不同绝经时期妇女雌激素受体亚型在阴道组织中的表达*
苏 婷 ,宋殿荣,郭 洁 ,张 崴 ,陈然然
(1.天津中医药大学,天津 301617;2.天津中医药大学第二附属医院,天津 300150)
随着人类平均寿命的延长,绝经人口比例日益增加,绝经问题日趋凸显,绝经综合征是绝经相关的最常见疾病,涉及人体多个系统、多个器官,其症状表现多样[1]。雌激素缺乏在许多症状的病因学中起主要作用,从而导致了许多慢性和老化性的疾病如骨质疏松症、心血管疾病和泌尿生殖道萎缩。在阴道组织中雌激素缺乏导致阴道黏膜萎缩,阴道上皮变薄,皱褶消失,阴道润滑作用下降[2-3]。雌激素通过雌激素受体(ER)发挥生物学作用,以前的研究已经证明在阴道壁中存在ER,但对ER在阴道组织中的表达情况国内外存在争议。
在组织中ER的表达水平不同,组织对雌激素的反应可能不同,了解受体亚型的表达水平可以更好地理解雌激素对泌尿生殖道的作用,并可针对特定的亚型治疗泌尿生殖道疾病。因此,本研究拟探讨不同绝经时期妇女ER亚型在阴道组织中的表达,为绝经泌尿生殖道疾病的治疗提供基础证据。
1 资料与方法
1.1 研究对象 选取2016年11月—2017年11月天津中医药大学第二附属医院妇科因良性疾病行阴式或腹式全子宫切除术的61例患者纳入本研究,分为育龄期(月经周期规律)24例、围绝经期(月经周期长度可变性持续增加,近10个月经周期中反复出现相邻周期提前或延后≥7 d,或月经周期间隔>60 d)18例,绝经后期(末次月经后停经≥12个月)19例,所有研究对象术前半年内未服用过类固醇激素类药物。本研究经天津中医药大学第二附属医院伦理委员会批准并取得患者及家属知情同意。
1.2 研究方法
1.2.1 标本采集 每例样本取足够的阴道壁组织,沿前穹窿环向取阴道前壁全层组织2份,大小均为0.8×0.8×0.8 cm3;一份用 4%多聚甲醛固定 24~48 h,常规石蜡包埋待检,另一份立即放入RNAlater后转运到实验室置-80℃冰箱冻存用于实时荧光定量聚合酶链式反应(qPCR)分析标本。
1.2.2 qPCR检测阴道组织中ERα、ERβmRNA表达 用Trizol法提取总RNA,紫外分光光度法测定RNA的浓度及纯度,甲醛变性琼脂糖凝胶电泳检测RNA完整性,High-capacity cDNAreverse transcription kits(invitrogen)将 RNA 逆转录为模板 cDNA,应用荧光定量PCR仪(美国BIO-RAD)进行PCR扩增(SYBR Green MIX购自DBI公司)目的基因,实验所用引物均由上海生工生物工程有限公司合成,引物序列及其产物长度见表1。

表1 qPCR引物序列及产物长度Tab.1 qPCR primer sequences and product length
1.2.3 免疫组化法(IHC)检测阴道组织中ERα、ERβ蛋白表达 将1.2.1中获得的阴道壁组织石蜡包埋后切片,厚度约3~5μm,将组织切片附于经多聚赖氨酸附膜的载玻片上,60℃烘烤过夜;二甲苯脱蜡,1%甲醇双氧水灭活内源性过氧化物酶,将切片浸泡在0.01 mmol/L柠檬酸盐缓冲液中,放入微波炉内高火热修复抗原10 min;0.1 mmol/L磷酸盐缓冲液(PBS)洗3次×5 min,切片上滴加正常山羊血清封闭液,室温静置20 min,滴加第一抗体(所有抗体均购自英国Abcam公司),4℃过夜,PBS洗 3次×5 min,滴加第二抗体,37℃,20 min,PBS洗3次×5 min,DAB显色,苏木素复染细胞核1 min,将IHC染色切片置于显微镜100、400倍下观察,阳性染色为细胞核内出现棕黄色颗粒。随机选取每张切片中的5个视野,每个视野中各计数100个细胞,计算阳性率。参考Soslow等[4]文献进行评分,评分标准:1)阳性细胞百分比对应的值:阳性细胞数0为0分,1%~10%为1分,11%~50%为2分,51%~80%为3分,81%~100%为4分。2)阳性细胞显色强度分级0为阴性,1为弱阳性,2为阳性,3为强阳性。IHS=阳性细胞显色强度×阳性细胞百分比对应值。
1.2.4 统计学方法 采用SPSS 24.0统计软件包处理,计量资料用均数±标准差(x±s)表示,多组均数的比较采用单因素方差分析(one-way ANOVA),两两比较采用SNK法。以α=0.05为检验标准,以P<0.05为差异有统计学意义。
2 结果
2.1 qPCR检测阴道组织中ERα、ERβmRNA表达 qPCR结果分析,与育龄期组相比,围绝经期和绝经后妇女阴道组织中ERαmRNA表达降低,差异有统计学意义(P<0.05);同时绝经后妇女阴道组织中ERαmRNA表达低于围绝经期组,差异有统计学意义(P<0.05);与育龄期组相比,围绝经期和绝经后妇女阴道组织中ERβmRNA表达高于育龄期组,差异有统计学意义(P<0.05);同时绝经后妇女阴道组织中ERβmRNA表达高于围绝经期组,差异有统计学意义(P<0.05),见表2。
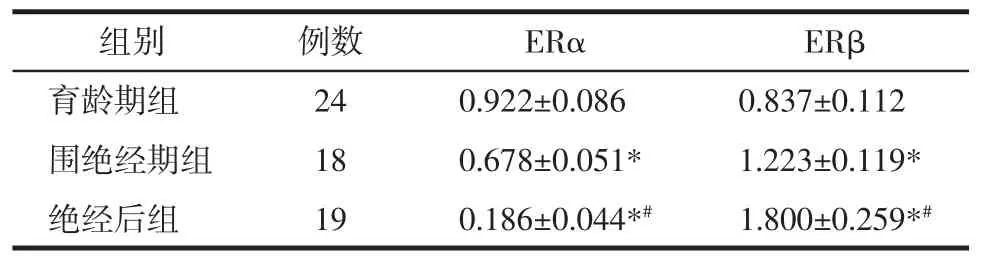
表2 ERα、ERβmRNA相对定量qPCR结果(x±s)Tab.2 Relative quantitative qPCR results of ERαand ERβ mRNA(x±s)
2.2 检测阴道组织中ERα、ERβ蛋白表达 IHC结果分析,ERα和ERβ两种受体均表达于细胞核,呈棕黄色颗粒,见图1。与育龄期组相比,围绝经期和绝经后妇女阴道组织中ERα蛋白表达降低,差异有统计学意义(P<0.05);同时绝经后妇女阴道组织中ERα蛋白表达低于围绝经期组,差异有统计学意义(P<0.05);与育龄期组相比,围绝经期和绝经后妇女阴道组织中ERβ蛋白表达高于育龄期组,差异有统计学意义(P<0.05);同时绝经后妇女阴道组织中ERβ蛋白表达高于围绝经期组,差异有统计学意义(P<0.05),见表3。
3 讨论
雌激素是女性重要的生殖激素,雌激素生物学作用的发挥需要特异性、高亲和力的ER介导[5-7],在人类细胞中已经发现了两种经典的ER亚型,即ERα和ERβ。研究表明[8-9],ERα和ERβ具有几乎相同的DNA结合域,但其配体结合结构域表现出很大的差异,并且两者在参与靶基因启动子转录的N-末端区域也有很大差异,导致两种受体与化合物的亲和力不同,表现出转录活性不同,不同组织中两种受体亚型的表达水平不同,因此不同的ER配体组织选择性作用不同。
关于不同绝经时期阴道组织中ERα、ERβ的分布及含量变化,两种受体亚型介导雌激素生物效应的作用差异研究结果不一致。如Chen等[10]发现ERα和ERβ均存在于绝经前妇女的阴道壁组织中,但绝经后妇女阴道壁中ERβ的表达缺失。Perez等[11]发现,绝经后阴道组织中ER与血清中雌激素呈负相关,但ER与绝经的时间表现出明显的相关性,随着绝经时间的延长,ER在逐渐增加。Skala等[12]研究ERα、ERβ在阴道壁组织中的表达,发现ERα在绝经后明显升高,ERβ在绝经后明显降低。Fu等[13]研究表明,绝经后妇女阴道壁组织中ERα的表达水平显著下降,激素替代疗法治疗后能明显升高ERα的表达,无论有无激素替代治疗ERβ的表达水平在绝经前后未见明显变化。

图1 ERα、ERβ免疫组化染色结果Fig.1 Result of ERαand ERβimmunohistochemical staining
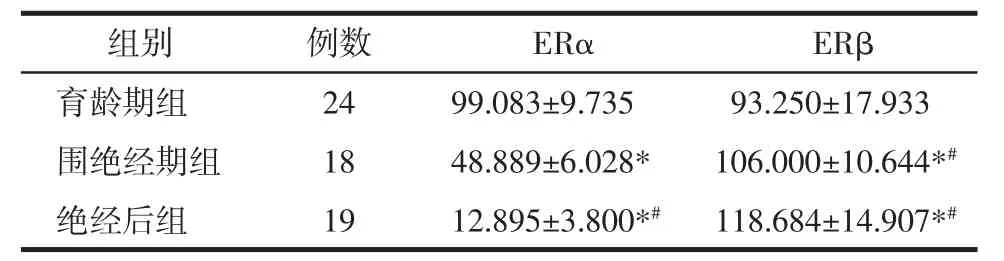
表3 ERα、ERβ蛋白IHS结果(x±s)Tab.3 r ESULTS of ERα,ERβ protein IHS(x±s)
而本研究结果表明,ERα和ERβ在育龄期、围绝经期和绝经后妇女阴道组织中均有表达,但表现出不同的表达模式,围绝经期及绝经后妇女阴道组织中ERα的表达水平较育龄期妇女显著下降,而且随着年龄的增长及绝经年限的延长,绝经后妇女阴道组织中ERα的表达水平较围绝经期妇女显著下降,但围绝经期及绝经后妇女阴道组织中ERβ的表达水平较育龄期妇女显著升高,而且绝经后妇女阴道组织中ERβ的表达水平高于围绝经期,说明绝经影响阴道组织中ER的表达。本研究结果与Fu等人研究基本一致,ERα在所有妇女的阴道壁组织中均有表达,绝经后ERα的表达降低且与绝经时间表现出明显的相关性,随着绝经时间延长,ERα的表达大幅度下降;Fu等研究表明,ERβ在绝经前后均有表达,但表达未见明显差异,本研究也证明ERβ在绝经前后妇女阴道组织中有表达,然而,表达似乎受到绝经的影响。上述研究结果不一致的原因考虑与年龄、绝经年限、研究方法有关,正如Ewies等[14]描述不同绝经时期和阴道脱垂均影响阴道组织中ER的表达。
本实验揭示了不同绝经时期患者阴道组织中ERα和ERβ的表达形式不同,说明两者在介导雌激素作用方面有不同的功能,是造成雌激素作用的组织特异性的物质基础,了解不同绝经状态患者阴道组织中ER的表达变化,可针对特定的受体亚型治疗绝经后妇女泌尿生殖道疾患,为绝经后妇女泌尿生殖道疾患的雌激素治疗提供实验依据。

