淹水对水紫树生长和生理特性的影响
江 皓,仲 磊,刘 雪,范俊俊,王 杰,周 婷,张往祥
(1.南京林业大学 林学院,江苏 南京 210037;2.江苏省林业局,江苏 南京 210036)
随着经济的快速发展,工业化的进程加快,受全球气候异常影响下沿海滩涂以及其他涝害地区的生态环境遭受严重破坏。其中,植物的生境受到了极大地改变,不耐水湿的诸如鹅掌楸Liriodendron chinense等植物在城市周期性内涝环境下的生长势减弱,观赏性下降,并为病虫害的侵入创造了有利条件,最终导致了林木的死亡。因而,在今后的园林绿化和城市湿地的恢复、重建中,耐涝树种应当备受关注。我国在湿地造林除了如湿地松Pinus elliottii、水松Glyptostrobuspensilis、落羽杉Taxodium distichum等常用的针叶类树种外,耐水湿的阔叶树种相对稀缺[1],而少数如垂柳Salix babylonica的本土耐湿树种容易造成审美疲劳,病虫害也较多。垂柳受到某些虫害危害后,会造成寿命缩短、树干老化等状况[2]。因此,引进和选育耐水涝、抗性强的优良湿生树种十分必要。
水紫树Nyssa aquatica属蓝果树科紫树属落叶大乔木,原产于美国南方海岸的平原沼泽、河滩地。该树种在原产地表现出了极强的耐水淹性,可弥补我国耐水湿的阔叶树种相对稀缺的情况,是低洼湿地和平原水网农田防护林造林的理想树种[3-4];秋季叶色斑斓,色彩绚丽,也是较为优良的彩叶树种;此外,水紫树不仅材质好,而且出材量大,有作为用材树种的潜质[5-7]。水紫树作为外来树种未被广泛认识,目前关于水紫树的研究却仅仅停留在引种试验方面[1,8],对其耐涝程度的量化以及淹水过程中生理特性变化的研究却鲜有报道。因此,笔者通过人工模拟淹水环境,对其进行苗期生理和表型性状等方面的研究,旨在揭示水紫树在淹水胁迫下的生理响应机制,以期为我国湿地造林、园林造景和水紫树育种改良等提供正确的参考。
1 材料与方法
1.1 试验地概况
试验地位于江苏省扬州市江都区仙女镇(32°42′N,119°55′E),属北亚热带季风气候,四季分明,年均温约14.9 ℃,年均降水量约1 000 mm,无霜期约320 d。
1.2 试验材料与试验设计
试验材料为水紫树两年生实生苗。2017年4月,选取300 株长势相近的苗木,进行盆栽(口径25 cm,高30 cm),每盆1 株,正常水分管理,露天培养3 个月,至植株恢复正常稳定状态。2017年7月14日,适应性栽培完成后,选择长势一致的水紫树苗60 株,平均分成两组,对照组(CK)和处理组(T)。将盆栽植株放在人工设置的露天水槽内,水槽根据设计注水。其中CK正常管理,土壤含水量为田间持水量的75%左右(每3 d 进行1 次全盆称质量,按要求补水),处理组模拟涝害,土壤含水量过饱和,水面高于土面5 cm 左右(约与盆口持平),为防止水质恶化每3 d 换水1 次。
1.3 测定方法
1.3.1 形态指标测定
分别于淹水前和淹水60 d 后,测定苗木苗高、地径。固定20 株单株用于苗高和地径的测定(苗高为盆口到苗木顶稍的距离,地径为距盆口以上3 cm 处的直径)。期间,于试验第30 d 和60 d 进行苗木成活率的测定并记录。
1.3.2 生理指标的测定
分别在淹水处理后10、20、30、40、50、60 d 的10:00 采集水紫树苗木上部第4 到第6 节位的功能叶,样品采集后立即采用干冰速冻,当天放入超低温冰柜中,用于各生理指标的测定。超氧化物歧化酶活性(SOD)、过氧化物酶活性(POD)、乙醇脱氢酶(ADH)和过氧化氢(H2O2)的测定采用酶联免疫吸附法,试剂盒来自南京森贝伽生物科技有限公司;丙二醛(MDA)和可溶性糖含量的测定参考孔祥生和易现峰的方法[9]。
1.4 数据处理与分析
数据分析与作图采用Excel 2010 和SPSS 17.0 程序。
2 结果与分析
2.1 淹水对水紫树生长及根系形态的影响
从表1可以看出,淹水促进了水紫树的高生长(P<0.01)和径生长(P<0.01)。整个淹水期间,苗木均未死亡,成活率为100%。由图1可见,60 d 的试验期间内,淹水组水紫树叶片颜色仍为绿色,长势较旺盛;对照组植株叶片颜色后期变黄,出现脱落的现象。由图2可见,对照组的根系形态无明显变化,而淹水60 d 的苗木的根系色彩仍较为新鲜,未出现腐烂的现象,侧根和须根数量明显减少,有大量不定根出现。
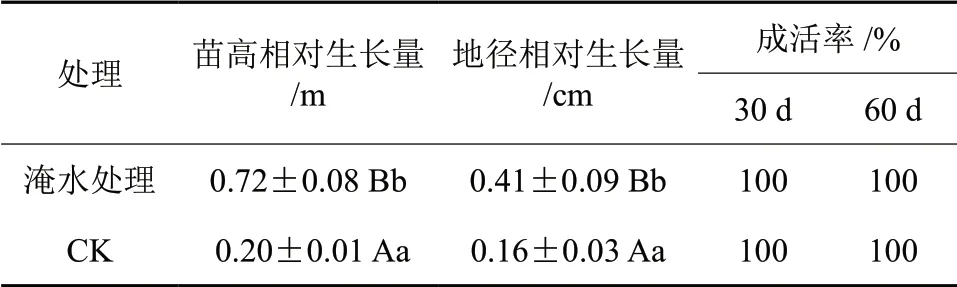
表1 淹水对水紫树生长及成活率的影响†Table1 Effect of the growth and survival rate of N.aquatica under waterflooding

图1 淹水对水紫树叶片生长的影响Fig.1 Effects of the leaf growth of N.aquatica under waterflooding

图2 淹水对水紫树根系形态的影响Fig.2 Effects of the root morphology of N.aquatica under waterflooding
2.2 淹水对水紫树叶片可溶性糖含量的影响
从图3可以看出,淹水条件下,水紫树叶片的可溶性糖含量整体呈上升趋势。0~30 d 淹水组与对照组无显著差异,而后期显著高于对照(P<0.01),40~60 d 内其含量是对照组的1.5 倍左右。
2.3 淹水对水紫树乙醇脱氢酶活性的影响
从图4可以看出,淹水条件下,水紫树乙醇脱氢酶活性显著高于对照(P<0.01)。其中,从淹水第10 天开始,叶片乙醇脱氢酶活性不断上升至第50 天的最大值1.24 U/mL,随后下降,但仍显著高于对照。
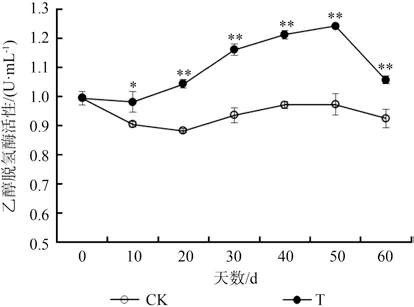
图4 淹水条件下水紫树ADH 活性的变化Fig.4 Changes of ADH activity of N.aquatica under waterflooding
2.4 淹水对水紫树氧化物含量及抗氧化酶活性的影响
2.4.1 淹水对水紫树SOD 活性和POD 活性的影响
淹水使得水紫树叶片超氧化物歧化酶活性显著升高(P<0.01)(图5)。淹水胁迫下,超氧化物歧化酶活性在0~30 d 内稳步上升,30~40 d 下降了11.3%,随后处于一个稳定的状态。从图6可以看出,而过氧化物酶活性均高于对照组,但没有显著差异(P>0.05)(除第40 天外)。对照组和淹水组的酶活性变化趋势基本一致,均缓慢上升。
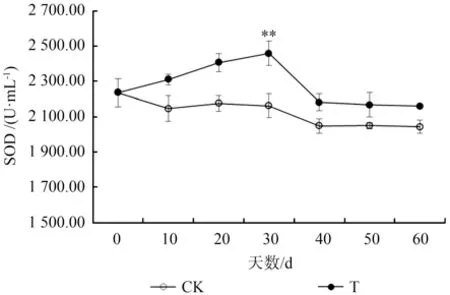
图5 淹水条件下水紫树SOD 活性的变化Fig.5 Changes of SOD activity of N.aquatica under waterflooding
2.4.2 淹水对水紫树过氧化氢含量和丙二醛含量的影响
由图7可以看出,淹水状态下,水紫树过氧化氢含量显著高于对照(P<0.01)。处理组过氧化氢含量在整个淹水过程中处于一个稳定的状态,是对照组的1.13~1.40 倍。由图8可以看出,水紫树丙二醛含量显著高于对照(P<0.01),且二者变化趋势基本一致呈“M”型。其中,淹水处理组的2 个峰值分别出现在第20 天和第50 天,整个淹水过程中,丙二醛含量上升了223.0%。

图6 淹水条件下水紫树POD 活性的变化Fig.6 Changes of POD activity of N.aquatica under waterflooding
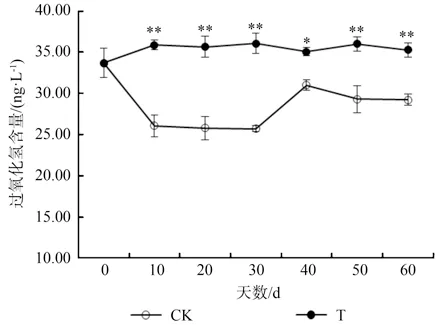
图7 淹水条件下水紫树过氧化氢含量的变化Fig.7 Changes of Hydrogen peroxide content of N.aquatica under waterflooding
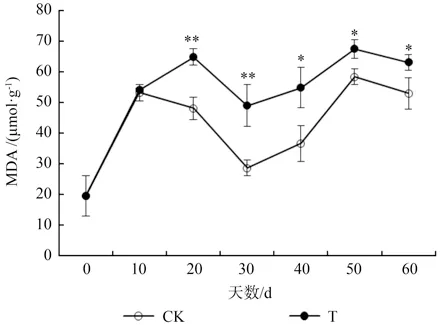
图8 淹水条件下水紫树MDA 含量的变化Fig.8 Changes of MDA content of N.aquatica under waterflooding
3 结论与讨论
1)淹水条件下,植物往往不是被动的承受水淹导致的危害,而是通过自身稳态调节机制改变生理代谢状态来主动适应淹水的环境。可溶性糖是植物重要的渗透调节物质,植物为了适应逆境条件会主动积累一些可溶性糖以维持细胞膨压[10]。本试验中,0~30 d 内水紫树叶片可溶性糖含量与对照无显著差异,而后期随着其含量显著高于对照。前期可溶性糖含量升高可能是因为受高温影响,而30 d后气温下降导致对照组可溶性糖含量下降。它与仍然保持较高水平含量的淹水组有显著差异,表明淹水使得水紫树通过可溶性糖来抵抗逆境。ADH 是普遍存在于植物细胞中的一种诱导酶,当植物处于逆境尤其是在土壤涝渍和环境缺氧等条件下,便会诱导其表达,ADH 的活性高低与植物在氧气缺乏时的生存有关[10]。低氧抑制有氧呼吸便会引起ADH 的酶活性增强,促进乙醇发酵,提高NADH 的再氧化过程,维持细胞能荷,从而增强植物对低氧胁迫的适应性。本试验中,水紫树的ADH 活性在0~50 d,对照组与淹水组的差值越来越大,50 d 后差值减小,后期两者可能会表现无显著差异。这表明水紫树在淹水条件下,前期通过提升ADH 活性来维持乙醇发酵,为植物体的代谢提供能量,后期可能通过其他途径将累积的产物转化成了促进苗木生长的物质,从而适应了淹水环境。这与汪贵斌[11]等对落羽杉、美国山核桃和乌桕这3 树种进行淹水研究结果一致。
淹水状态下的缺氧环境会影响根系呼吸,厌氧呼吸产生的有毒有害物质会破坏植物体内活性氧代谢系统的平衡,引起活性氧积累[12],促进丙二醛(MDA)和过氧化氢(H2O2)大量形成,从而对植物形成伤害[13-14]。以过氧化物酶(POD)和超氧化物歧化酶(SOD)等为代表的抗氧化酶为抵抗逆境,在清除植物体内的氧自由基的工作上发挥着重要作用[15-16]。本试验中,SOD 活性显著高于对照,呈先上升后下降的趋势,这与许多研究结果一致[17-19]。这表明水紫树通过提升SOD活性,增大自身的抗氧化及清除活性氧能力,从而抵抗逆境;而POD 在面对淹水逆境时表现的不太敏感,其酶活性高于对照,但没有显著差异;整个淹水过程中,H2O2的含量显著高于对照,并处于一个稳定的状态。这一现象较为反常,一般情况其含量应该呈先上升后下降的趋势,可能说明控制H2O2含量除了这两种抗氧化酶,还存在其他调节系统;丙二醛(MDA)是膜脂过氧化的最终产物,其积累量被认为是细胞膜伤害程度的指标[20]。本试验中,MDA 含量在第10 天之后,淹水处理显著高于对照,整体呈“M”型趋势。说明水紫树细胞膜受到了一定的伤害,但在第20 天和第50 天的时候,其含量下降。第一次下降是由于体内较强活性的抗氧化酶系统清除或减少了胁迫过程中产生的活性氧,从而减少了MDA 的累积,缓解淹水胁迫对其造成的伤害。第二次下降可能是因为茎基部形成不定根,这种结构不仅有利于氧气的向下扩散,还有利于根部厌氧代谢产生的副产物如甲烷、二氧化碳从茎中排到大气中,缓解了淹水对叶片细胞膜的伤害。
2)淹水条件下,由于氧气供应不足、无氧呼吸产生毒害等原因,植物的生长速度减缓,生物量的净增长量也随着淹水程度的加深而降低[21-23]。本试验中,淹水促进了水紫树苗高和地径生长,这一结果与很多研究结果不一致[24-26]。试验结果发现淹水使水紫树的侧根和须根数量明显减少,且有大量不定根产生。这说明淹水对水紫树根系有一定的抑制作用,但它通过形成大量的不定根来响应这一逆境。一方面,细胞间拥有较大隙腔的不定根减小了氧气传输的距离,降低了O2的径向损失,从而提高了氧气扩散能力;另一方面代替受损的主根系吸收了水和营养物质[27-28]。持续60 d 的淹水时间下,其根部未发生腐烂,且颜色仍然保持新鲜,此外,在整个淹水期间,苗木均未死亡,成活率为100%,说明水紫树具有较强的耐涝性。淹水虽然促进了水紫树地上部分的生长量,但根系明显受到抑制,因此可以推测这只是一个暂时的结果。蒸腾作用是植物对水分的吸收和运输的主要动力,也是植物吸收矿质盐类和在体内运转的动力[29]。夏季高温,植物的生长较为缓慢,而蒸腾作用较大,所需水分较多。淹水组水分充足,面对这一环境,水分可能在短期内起到了关键的缓解作用。虽然淹水条件下无氧呼吸胁迫存在,但短期内水分的缓解作用大于无氧呼吸所带来的伤害。随着淹水时间的继续延长,气温回转,对照组的生长量可能会超过淹水组。这一结果后期还有待于进一步验证。

