楸树优良种质资源的AFLP遗传多样性分析
李永涛,董玉峰,王振猛,张鹏远,王卫东,荀守华,秦光华,姜岳忠
(1.山东省林业科学研究院 山东省林木遗传改良重点实验室,山东 济南 250014;2.山东省林木种苗和花卉站,山东 济南 250014)
楸 树Catalpa bungeiC.A.Mey.为紫葳科Bignoniaceae 梓树属Catalpa落叶乔木,原产中国,现主要分布于我国暖温带和亚热带地区,为我国特有梓树属植物[1]。其材质优良,树姿优美,用途广泛,是珍贵观赏和用材树种,有“木王”之称[2]。楸树在我国已有2 000 多年栽培史,有关楸树的研究较多,目前主要集中在开发利用、良种选育及抗逆机理研究等方面[3-6]。鲁豫地区作为楸树重要的适生分布区,在其区域内均有广泛分布,但由于地理隔离、遗传漂变和人工选择等原因,在形态特征、生态适应性及生长表现等方面形成了明显差异[3]。目前仅通过枝、叶、花和种实等简单形态表型标记已不能准确将其区分开来,形态学标记虽简便易行,但由于表型性状易受环境因素影响、近缘种较难区分,因此以形态特征作为分类的依据与标准具有不确定。而近年来,通过对野生资源的选择利用,楸树已成为重要的乡土树种和珍贵优质用材树种,准确地鉴别种质资源间的遗传多样性及亲缘关系,对其种质资源的充分发掘及利用具有重要的意义。
分子标记技术因不受组织类型、发育时期、环境条件等因素的影响,直接以DNA 形式表现,现已成为目前最有效的遗传分析方法[7]。其中AFLP(Amplified fragment length polymorphism,扩增片段长度多态性)分子标记技术,结合了RFLP 技术的可靠性和PCR 技术的高效性,多态性强、分辨率高,可完全用于研究背景模糊、材料来源广泛等资源的标记分析[8-9]。目前已被广泛应用于白蜡属[10]、猕猴桃属[11]、苹果[12]和柽柳[13]等种质资源的遗传分析研究。在楸树方面,早前国内外学者采用ISSR、SRAP 和SSR 标记技术[14-16],对部分区域资源的遗传多样性做了一些研究,而暂未涉及利用AFLP 分子标记技术对楸树资源进行鉴定分析。为深入了解鲁豫地区楸树种质资源的遗传结构,本研究采用AFLP 标记技术对该区域分布的44份优良楸树种质资源的遗传多样性和亲缘关系进行分析,以期了解不同地理、生态条件下的遗传变异状况,为楸树优良种质资源的收集、鉴别和利用提供理论依据。
1 材料与方法
1.1 试验材料
供试材料保存于山东省光合园林章丘白云湖基地楸树资源圃和枣园苗圃内,该材料于2002—2004年期间从山东、河南2 省的多个县、市、地区采集,通过嫁接保存于资源圃内。其中,山东省采集种质33份(优良单株),河南省采集种质11份(包括豫楸1 号、豫楸1 号、周楸2 号3 个省级良种和8 个优良单株),共计44份,供试材料的编号、名称及来源详见表1。每一种质采集适量新鲜幼嫩叶片,放入装有硅胶的自封袋中干燥保存,用于DNA 的提取。
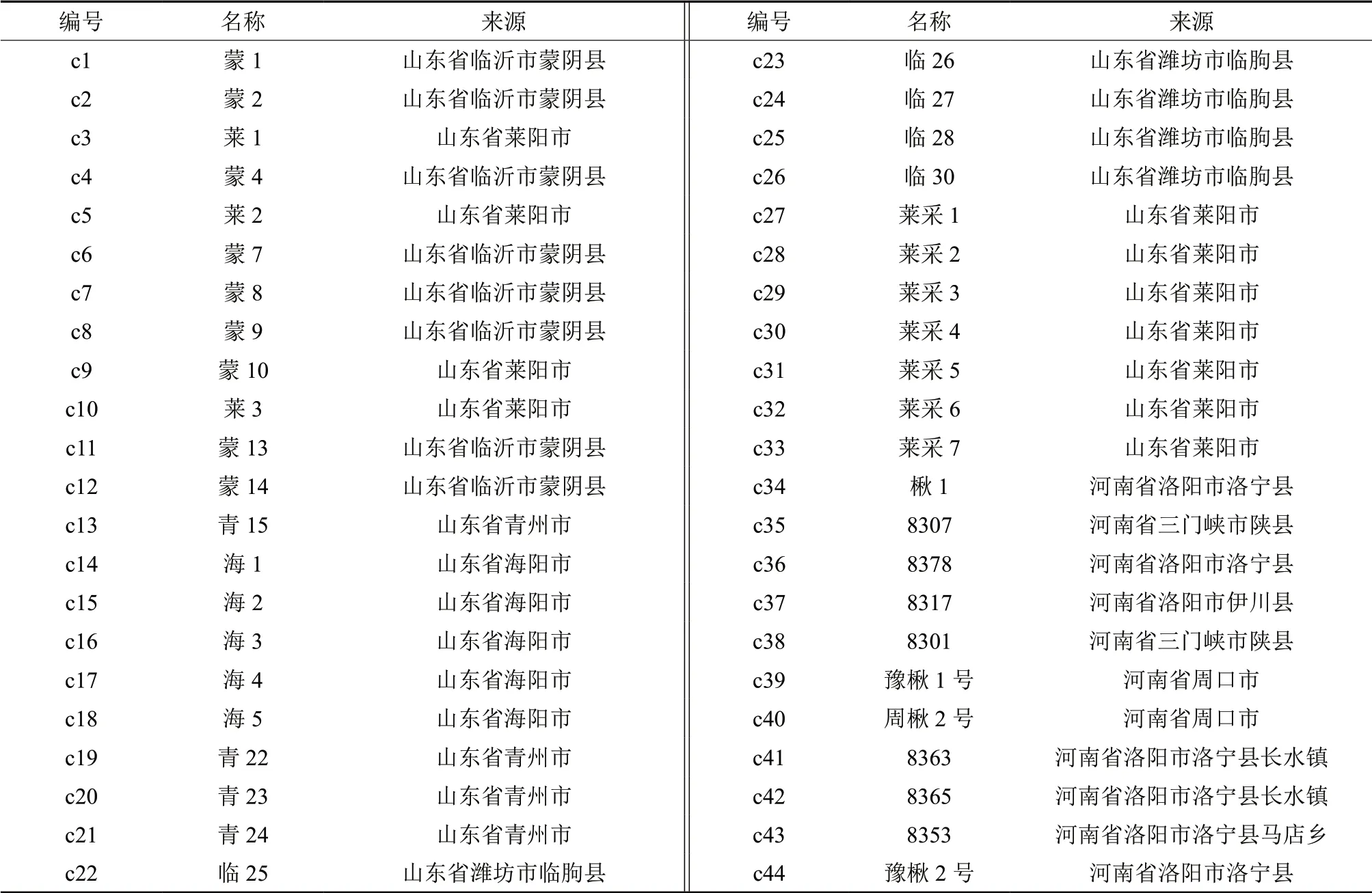
表1 供试材料及来源Table1 Experiment materials and their origin
1.2 试验方法
1.2.1 DNA 提取
采用CTAB 法提取楸树幼嫩叶片中DNA,用0.8%的琼脂糖凝胶电泳检测DNA 质量,-20℃保存备用。
1.2.2 AFLP 扩增及检测
限制性酶切及连接反应:酶切与连接同时进行,利用PstI 和MseI 内切酶构建酶切连接体系,反应体系为DNA 模板4 μL(50 ng/μL)、Adapter 1 μL、PstI /MseI 2 μL、10×Reaction buffer 2.5 μL、10 mmol ATP 2.5 μL、T4 Ligase 1 μL、ddH2O 7 μL 共计20 μL。将混合液混匀离心数秒,37 ℃保温酶切5 h,之后8℃保温酶切4 h,4 ℃连接过夜。
预扩增反应:选择PstI(5′-GACTGCGTACAT GCAG-3′)和MseI(5′-GATGAGTCCTGAGTAC-3′)为预扩增引物。连接产物20 倍稀释后进行预扩增反应,反应体系为预扩增模板DNA 2 μL、预扩引物 1 μL、dNTPs 0.5 μL、10×PCR buffer 2.5 μL、Taq 酶 0.5 μL 以及ddH2O 18.5 μL 共计25 μL。预扩增条件为:94 ℃ 2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 80 s,循环30次;72 ℃延伸5 min,终止于4 ℃。
选择性扩增反应:将预扩增产物稀释20 倍,采用PstI、MseI 引物组合进行选择性扩增,扩增体系为预扩稀释样品 2 μL、10×PCR buffer 2.5 μL、dNTP 0.5 μL、PstI 引 物1 μL、MseI 引 物1 μL、Taq 酶0.5 μL 以及ddH2O 17.5 μL 共计25 μL。扩增条件为:94 ℃ 30 s,65 ℃ 30 s,72 ℃ 80 s,1 个循环;然后以每循环复性温度逐级降低0.7 ℃的梯度继续12 个循环;接着按94 ℃ 30 s,55 ℃ 30 s,72 ℃ 80 s,扩增23 轮;最后再72 ℃延伸5 min,反应终止于4 ℃。
PCR 扩增在Gene Amp PCR System 9600 扩增仪上完成,内切酶和连接酶均购自New England Biolabs 公司,引物由北京鼎国昌盛生物技术有限责任公司合成。扩增产物变性后在4%聚丙烯酰胺变性凝胶上电泳分离,染色显影。
1.3 数据处理与分析
电泳结果采取0/1 赋值记带法,有带的记为1,无带的记为0。采用POPGENE version 1.32 软件计算多态性条带(N)、多态性条带比率(PPB)、Nei’s 基因多样度(H)、有效等位基因数(Ne)和Shannon 信息指数(I)等遗传多样性指标;利用NTSYSpc-V.2.1 计算遗传相似性系数;根据相似性系数进行UPGMA 聚类分析[17]。
2 结果与分析
2.1 DNA 提取结果及检测
通过0.8%琼脂糖凝胶电泳检测(图1),所提取试验材料的DNA 带清晰,无降解和RNA 污染。DNA 样品经核酸蛋白检测仪检测OD260/OD280在1.792~1.859 之间,说明CTAB 法所提取楸树DNA 的纯度和浓度较高,其质量符合AFLP 分子标记试验分析要求。

图1 基因组DNA 检测Fig.1 Genomic DNA detection
2.2 酶切连接反应及预扩增产物检测
采用PstI/MseI 酶切组合对获得的楸树基因组DNA 同时进行酶切与连接反应,通过不同时间梯度下的双酶切效果看出(图2),酶切1 h 即可将楸树DNA 样品切割开,其中1~2 h 效果相近,3~6 h 酶切更充分,8~10 h 条带开始减弱。0.8%琼脂糖凝胶电泳显示,酶切1~6 h DNA 条带均弥散均匀,所得产物均符合下一步预扩增要求。

图2 酶切时间梯度对比效果图像 Fig.2 Effects of double enzyme time gradient
通过建立楸树预扩增反应体系看出(图3),预扩增产物弥散片段主要分布在2 000 bp 以内,预扩增条带呈弥散型分布,各楸树种质带型明显且比较一致。预扩增结果表明接头与双酶切片段已连接成功,可为下一步选择性扩增的顺利进行提供模板。

图3 预扩增电泳图像Fig.3 Electrophoresis pattern of pre-amplified product
2.3 AFLP 扩增结果分析
从 64 对 AFLP 引物中筛选出8 对扩增条带清晰并呈多态性的引物,对44 个楸树单株的DNA进行选择性扩增(表2)。筛选出的8 对引物组合共扩增出条带1 087 条,其中多态性条带1 043条,多态性条带比率在92.37%~99.40%,其中P-GTG/M-CAG 引物组合效率最高,P-GAT/M-CTG 引物组合最低,平均为95.60%;每条引物平均扩增出的条带数为135.88 条,而平均多态性条带为130.38 条。扩增条带数最多的是P-GTG/M-CAG 引物组合,为168 条,最少的是P-GTG/M-CTC 引物组合,为在114 条;每个位点的平均有效等位基因数为1.321 0,Nei’s 平均基因多样性为0.200 3,Shannon 平均信息指数为0.320 4。
引物组合P-ACG/M-CAC 的扩增图谱显示(图4),所得扩增产物条带清晰、数量较多、易于分辨,表明所选用的引物组合多态性较好。

表2 8对引物组合(PstI/MseI)扩增的AFLP 条带结果†Table2 Amplification bands with eight pairs of AFLP primer

图4 引物组合 P-GAA/M-CAA 对c1-c30 号楸树资源的AFLP 扩增图谱Fig.4 AFLP fingerprinting of the primer combination P-GAA/M-CAA for No.c1-30 Catalpa bungei
2.4 特异性条带分析
通过AFLP 标记对44份楸树种质资源的分析,8 对引物组合共产生特异性条带261 条。不同引物组合扩增出的特异性条带数存在一定差异,其中产生特异性条带最多的引物组合为P-GTG/M-CAG,共产生47 条特异性条带,产生特异性条带数最少的引物组合为P-GAA/M-CTG,共扩增出4 特异性条带。44份楸树种质产生的特异性条带也不相同,其中产生特异性条带数最多种质的是c18 号和c34 号,均有16 条带,分别位于山东海阳和河南洛阳市洛宁县;其次是c5 号和c38 号种质,各有15 条特异性条带,分别位于山东莱阳和河南三门峡市陕县;特异性条带数在10 条以上(包括10 条)的材料有3 个,为c1 号、c3 和c40号,分别位于山东临沂市蒙阴县、莱阳市及河南周口市;特异性条带最少的种质为c6 号、c12 号、c25、c28、c30 和c44 号,均有1 条特异性条带,通过这些特异性条带可对楸树资源进行较好的区分和鉴别。
2.5 遗传相似性分析
通过分析44份楸树种质资源间的遗传相似性系数,遗传相似性系数为0.502 2~0.791 9,平均值为0.652 7。由相似系数矩阵看出,44份种质材料中c5 号与c34 号种质间的遗传相似性系数最小,为0.502 2,两者分别位于山东莱阳和河南洛阳市洛宁县地区,表明两者遗传关系最远,差异性最大。c6 号与c7 号种质间的遗传相似性系数最大,为0.791 9,而两者均分布山东省蒙阴地区,遗传关系最近,差异性最小。同时,c6 号种质与其它种质间的遗传相似性系数平均值最大,为0.688 5;c43 号种质与其它种质间的遗传相似性系数平均值最小,为0.626 9。表明c6 号与其它种质材料间具有较高的遗传相似性,亲缘关系较近;而c43 号与其它种质材料间的遗传相似性较小,亲缘关系较远。
2.6 聚类分析
基于遗传相似系数,通过UPGMA 法对44份楸树种质材料进行聚类分析得出(图5),在相似系数0.65 处,可将44份楸树资源分为5 大组。第1 组由17 个种质组成,包括15 个山东种质和2个河南种质。其中c1、c8 号种质位于蒙阴地区,c3、c5、c10、c30 号位于莱阳地区,c13、c19~c21 号位于青州地区,c15 号位于海阳地区,c22、c24~c26 号位于临朐地区,c43 和c44 号位于河南省洛宁县地区;第2 组由21 个种质组成,包括18 个山东种质和3 个河南种质。其中c2、c4、c6、c7、c11、c12 号位于蒙阴地区,c9 号位于莱阳地区,c14、c16、c17、c18 号位于海阳地区,c23 号位于临朐地区,c27、c28、c29、c31、c32、c33 号位于莱阳地区,c35 号则位于河南省陕县地区,c41、c42 号位于河南省洛宁县长水镇地区;第3 组包括3 个种质,均来自河南地区,其中c37号种质位于河南省洛阳市伊川县地区,而c39、c40 号则位于河南省周口市地区;第4 组仅包括1个种质,为c38 号,来源于河南省三门峡市陕县地区;第5 组包括2 个种质,为c34 和c36,2 个种质都位于河南省洛宁县地区。从聚类分析结果可以看出,44份楸树种质材料的分组与其地理分布位置并不完全一致,部分来源于同一地区的种质却被分在不同的分组中。
3 结论与讨论
遗传多样性是物种长期进化而产生的结果,是生物生存、发展和进化的前提[18]。AFLP 为一种高效的分子标记方法,可准确反映物种间的遗传变异情况及亲缘关系远近等信息[19]。本研究通过AFLP标记技术经DNA 提取、酶切、连接、预扩增、选择性扩增等步骤(图1~图3),利用筛选到的8 对引物组合,在44份楸树种质上均能得到清晰的AFLP 指纹图谱(图4),表明AFLP 技术可稳定、有效地对不同来源的楸树种质资源进行区分。同时,8 对引物共扩增出多态性条带1 087 条,多态性比率(PPB)为92.37%~99.40%,平均值为95.60%,位点多态性较好,有效等位基因数(Ne)、Nei’s 基因多样性(H)和Shannon 信息指数(I)分别达到了1.321 0、0.200 3 和0.320 4,扩增结果显示楸树种质资源具有较高的遗传多样性。这与石欣等[15]采用14 对ISSR 引物对156 个楸树单株扩增所得97.89% 的多态性比率较相近,而略低于方乐成等[17]采用13 对SSR 引物对192份楸树资源扩增所得99%的多态性比率。采用不同的分子标记方法获得多态性存在差异,遗传多样性越高,其遗传背景越复杂,这符合楸树作为一种分布广泛、异交率高、生命周期长的木本植物[20-21],具备物种遗传多样性较高特点的观点[22-23]。
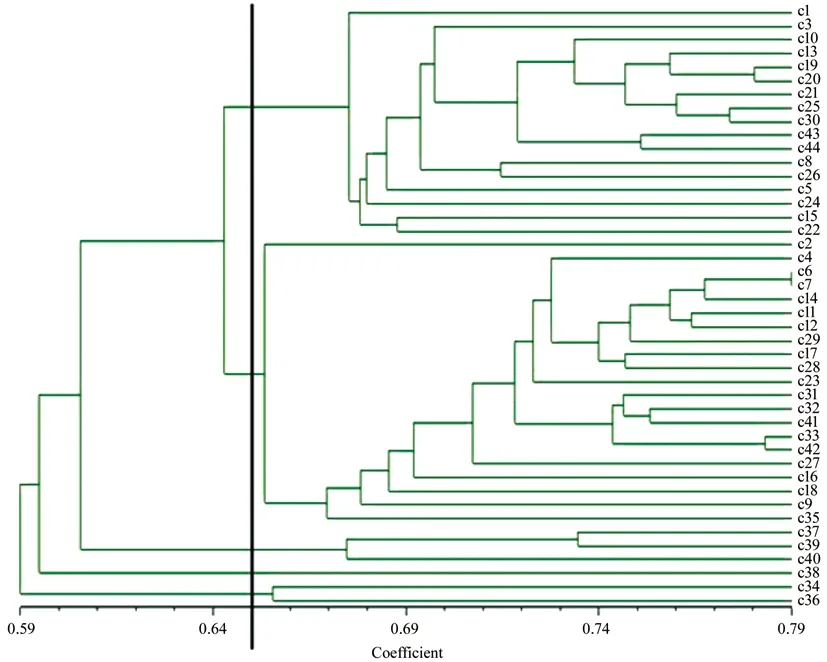
图5 44份楸树种质材料的AFLP 聚类图像Fig.5 Dendrogram of 44 accessions of Catalpa bungei germplasm with AFLP markers
楸树组植物分类系统提出于20 世纪90年代[7],一直沿用至今,目前基于简单的形态表型标记已不能准确对楸树资源进行有效的分类,且至今还没有统一分类的方法。本研究中,8 对引物组合共扩增出特异性条带261 条,这些特异性条带可快速准确的对供试材料进行鉴别,比简单通过表型性状进行分类更为可靠,对楸树亲缘关系的划分更有意义。同时,由遗传相似性系数可知,44份楸树种质遗传相似性系数平均值为0.652 7,其中山东莱阳的c5 号和河南洛阳市洛宁县地区的c34 号资源遗传相似系数最小,为0.502 2,说明这两个种质的遗传分化差异较大,亲缘关系最远;来源山东蒙阴的c6 号和c7 号种质的遗传相似系数最大,为0.791 9,说明遗传分化差异最小,亲缘关系最近。但通过聚类分析(图5)得出,在遗传相似系数0.65 处44份楸树种质材料划分为5组,而部分来源于同一地区的种质并没有完全聚为1 类。其中第1 组与第2 组均出现了山东、河南不同省份种质聚为一组的现象,在第1 组、第2组与第3 组也伴随出现了同一省份不同地区种质聚为一组的现象。同时,第1 组与第3 组的c44、c39、c40号栽培品种(良种)与野生资源也聚为1类,这些地区的栽培种和野种之间存在大量的本地基因流。综上,鲁豫地区楸树资源的遗传多样性以及亲缘关系与地理分布间无明显相关性,造成这一问题的原因较多,一方面是楸树组分类繁多,起源和亲缘关系较为复杂,存在属内各种变异所致;另一方面与山东、河南相毗邻,地域范围较近,楸树种源间存在相互引种、基因交流比较频繁有关;再一方面也可能与同一区域资源收集时栽培品种与野生种质混淆有关[24-27]。
楸树作为优良的珍贵乡土树种,已被列入重要树种保存收集名录,而位于黄准海平原丘陵楸树栽培区的鲁豫地区,是楸树种质资源的适宜分布区,其资源的种类和数量繁多。而本研究所收集的楸树种质资源仅涉及鲁豫8 个县市地区44 个优良单株,其中河南仅3 个地区11 个单株,收集范围相对集中,难以代表两省楸树资源的全部遗传背景。因此,研究结果在范围上具有一定局限性,今后需根据相关文献资料,明确资源分布现状,以扩大楸树种质资源的收集范围。同时,在借助分子标记技术的同时,还应结合形态学和细胞学等其它鉴定方法,才能更加全面、准确的反映楸树种质资源的遗传多样性。
——致秋天的花楸树

