末端回肠组蛋白脱乙酰基酶3表达与肥胖以及肠道菌群关系的初步探索*
范俊杰 曾 悦 黄春兰 陆颖影
上海交通大学附属第一人民医院消化内科(201620)
肥胖是一个全球性流行性疾病,是呼吸系统和心血管系统疾病、2型糖尿病以及肿瘤的高危因素[1-2]。近年研究表明,肠道菌群在调节内环境稳态以及诱发肥胖中起有关键作用[3-4],而无菌小鼠可抵抗高脂饮食诱发的肥胖和代谢紊乱[5]。
肠上皮细胞对于营养代谢、维持肠道屏障功能、产生免疫调节因子等至关重要[6-9]。研究显示组蛋白脱乙酰基酶3(histone deacetylase 3, HDAC3)通过行使去乙酰化功能调控肠上皮细胞内基因表达,参与调节肠上皮细胞与细菌或其代谢产物之间的相互作用,从而维持肠道内环境稳态[10-11]。此外,研究还发现细菌代谢产物如短链脂肪酸对HDAC活性具有抑制作用[12-15],敲除肠上皮细胞的HDAC3或给予丁酸盐可防止小鼠由高脂饮食诱导的肥胖[15]。本实验以C57BL/6小鼠为研究对象,初步探讨末端回肠HDAC3表达与肥胖的关系,以及肠道菌群的存在是否会影响HDAC3表达。
材料与方法
一、实验动物、主要试剂和仪器
SPF C57BL/6小鼠和无菌C57BL/6小鼠购自上海斯莱克实验动物有限责任公司。参照《实验动物、无菌动物生活环境及粪便标本的检测方法》(GB/T 14926.41-2001),无菌小鼠饲养于无菌隔离器中,饲料、饮水、空气供给均在严格无菌条件下进行,饲料经40 kGy Co-60辐照消毒。所有实验动物饲料、饮水、垫料、鼠笼、饮水瓶等均采用高温高压灭菌(121 ℃, 60 min)。环境温度20~26 ℃,湿度40%~70%,光照周期明暗比12 h∶12 h。每周对小鼠粪便行细菌学检测,细菌16S DNA V3区引物PCR扩增阴性[16]。
兔抗人HDAC3单克隆抗体(Abcam plc.);免疫组化SP检测试剂盒(福州迈新生物技术开发有限公司);TRIzolTM试剂(InvitrogenTM, Thermo Fisher Scientific);PrimeScriptTMRT Master Mix(Perfect Real Time)[宝生物工程(大连)有限公司];SYBRTMGreen Real-Time PCR Master Mixes(Applied Bio-systemsTM, Thermo Fisher Scientific);PCR引物[生工生物工程(上海)股份有限公司]。StepOnePlusTMReal-Time PCR系统(Applied BiosystemsTM, Thermo Fisher Scientific)。
二、方法
1. 实验分组:8只6周龄SPF C57BL/6小鼠(SPF组)和8只6周龄无菌C57BL/6小鼠(无菌组)分别随机分为普通饮食组和高脂饮食组,每组4只,相应喂饲普通饲料和高脂饲料,共5周。高脂饲料配方:干酪素195 g/kg,DL-蛋氨酸3 g/kg,玉米粉130 g/kg,麦芽糊精140 g/kg,蔗糖255 g/kg,无水乳脂180 g/kg,纤维素45 g/kg,矿物质混合物35 g/kg,维生素混合物10 g/kg,胆碱酒石酸盐1 g/kg,抗氧化剂0.004 g/kg。实验期间动物自由摄食、饮水,每周称重,记录体质量变化。
2. 标本获取:予相应饲料喂养5周后,实验小鼠以CO2麻醉处死,经腹部切口打开腹腔,循盲肠找到回肠末端,切取3~5 cm末端回肠组织,4%甲醛或液氮保存,用于后续实验。
3. 免疫组化染色:小鼠末端回肠组织4%甲醛固定,石蜡包埋、切片,脱蜡,3% H2O2室温孵育30 min,热修复抗原,正常山羊血清封闭;加入一抗兔抗人HDAC3单克隆抗体,湿盒4 ℃过夜,次日加入鼠抗兔二抗,湿盒37 ℃ 30 min,DAB显色,常规乙醇梯度脱水、透明、封片,光学显微镜下观察。HDAC3免疫阳性物质呈棕黄色,主要定位于细胞核,少量定位于细胞质。Image-Pro Plus 6.0软件分析免疫组化图像,计算积分光密度值(IOD值)。
4. Real-time PCR:以TRIzol试剂抽提末端回肠组织总RNA,紫外分光光度法测定RNA浓度和纯度,定量至500 ng/μL。使用反转录试剂合成cDNA,反应条件:37 ℃ 15 min,85 ℃ 5 s。以cDNA为模板,使用StepOnePlusTMReal-Time PCR系统行PCR扩增。引物序列:GAPDH(内参)F 5’-CAA AAG GGT CAT CAT CTC C-3’, R 5’-CCC CAG CAT CAA AGG TG-3’; HDAC3 F 5’-TGC ACC CAG TGT CCA GAT TC-3’, R 5’-TTT CAG AGA GCC ACG CCT TC-3’。PCR反应体系(20 μL):1 μL cDNA,上、下游引物各1 μL,ddH2O 7 μL,SYBR®Green 10 μL。PCR反应条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 60 s,40个循环。2-△△Ct法计算目的基因mRNA相对表达量。
三、统计学分析
结 果
一、小鼠体质量变化
实验过程中各组小鼠热量消耗和体质量变化见图1。与SPF普通饮食组相比,SPF高脂饮食组小鼠体质量从第1周起即明显增长,各时点两组间差异均有统计学意义(P<0.05);无菌高脂饮食组、无菌普通饮食组和SPF普通饮食组小鼠实验过程中体质量无明显变化(P>0.05)。
二、小鼠末端回肠HDAC3表达
1. HDAC3蛋白表达:免疫组化染色显示,HDAC3蛋白表达主要定位于小鼠末端回肠肠上皮细胞的细胞核,少量定位于细胞质。SPF高脂饮食组HDAC3蛋白表达明显高于SPF普通饮食组,差异有统计学意义(P<0.05);无菌高脂饮食组与无菌普通饮食组间HDAC3蛋白表达无明显差异(P>0.05)(图2)。
2. HDAC3 mRNA表达:real-time PCR检测显示,SPF高脂饮食组末端回肠组织HDAC3 mRNA表达明显高于SPF普通饮食组,差异有统计学意义(P<0.05);无菌高脂饮食组与无菌普通饮食组间HDAC3 mRNA表达无明显差异(P>0.05)(图3)。
讨 论
近年来关于肥胖的研究日益增多,现已证实肥胖与多个器官系统的疾病密切相关。表达于肝脏、肌肉和脂肪组织中的HDAC3与脂肪代谢密切相关[17-21];而肠上皮细胞中的HDAC3可通过整合肠道菌群诱导的信号通路调节宿主与菌群之间的相互作用,维持肠道内环境稳态[10-11]。 将肠上皮细胞特异性HDAC3缺失小鼠诱导为无菌状态,其在常规饲养时所呈现的Paneth细胞消失、肠上皮功能受损、基因表达失调均获明显改善[10]。研究[15]报道小鼠末端回肠上皮HDAC3能促进由高脂饮食诱导的肥胖,条件性敲除肠上皮细胞中的HDAC3后,肥胖小鼠体质量显著减轻,代谢谱亦有所改善;该研究还发现细菌代谢产物丁酸盐对HDAC3活性具有抑制作用。因此,本研究利用无菌小鼠初步探讨肠道HDAC3与肥胖的关系,以及肠道菌群对HDAC3表达的影响。
分别予SFP小鼠和无菌小鼠普通饮食和高脂饮食,结果显示高脂饮食喂养5周的SPF小鼠体质量明显增加,末端回肠HDAC3 mRNA和蛋白表达亦显著上调,证实了HDAC3在末端回肠的表达与高脂饮食诱导的肥胖之间的相关性。Lundh等[22]发现抑制HDAC3可改善2型糖尿病大鼠模型的高血糖,增加胰岛素分泌。Sun等[23]的研究则显示HDAC3通过调节脂质代谢相关基因,对维持心肌线粒体功能具有重要作用,在心肌和骨骼肌HDAC3基因敲除小鼠中,高脂饮食可诱导严重肥厚型心肌病并致死。在肝脏中,HDAC3可调节脂质代谢的昼夜节律[17]。肝脏中高表达的HDAC3可通过抑制过氧化物酶体增殖物激活受体-γ(PPAR-γ)和肝脏X受体-α(LXR-α)信号途径参与促进高脂饮食引起的代谢综合征[24];或通过下调肉毒碱棕榈酰转移酶1α(Cpt1α)导致肝脏脂肪变性和和肝损伤[25]。而丁酸盐可通过抑制HDAC3刺激肝脏成纤维细胞生长因子21(FGF21)表达,促进脂肪酸氧化和酮体生成[26]。HDAC3表达对能量代谢和体质量发挥何种作用取决于其靶基因,其在肝脏和脂肪组织中的一些靶基因已得到鉴定,在肠上皮细胞中的靶基因包括参与肠道菌群相关代谢调节的Chka、Mttp、Apoa1、Pck1等[15]。需对HDAC3在特定细胞和特定环境中的作用作进一步研究。

**与同组0周比较,P<0.01
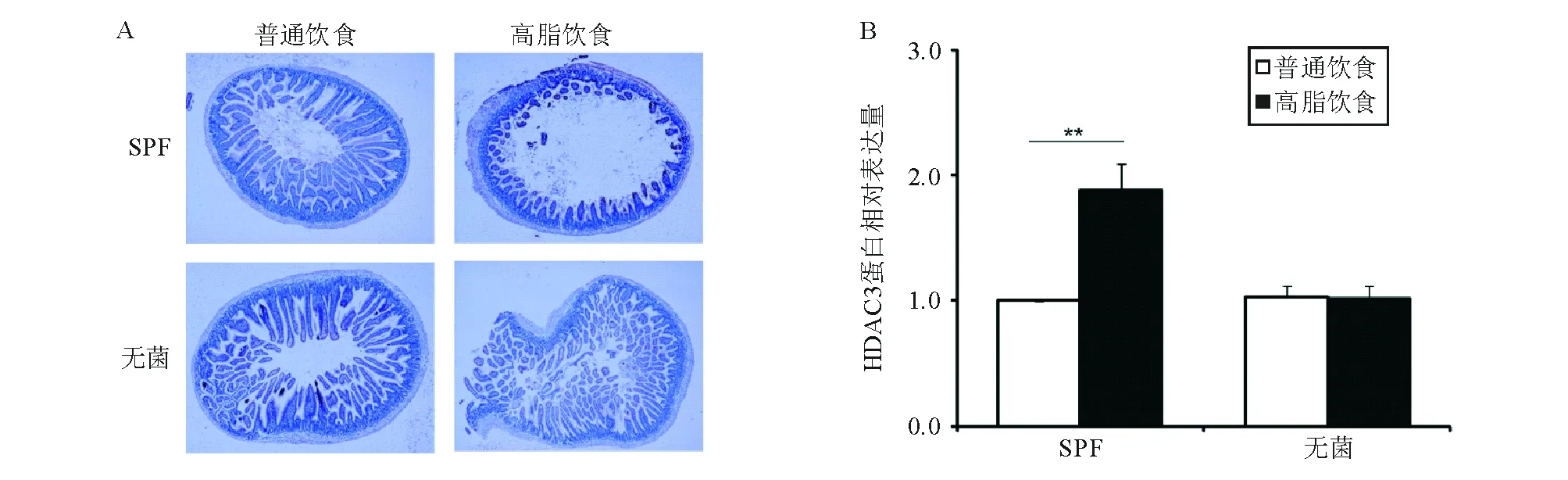
A:低倍镜下末端回肠组织HDAC3蛋白表达(免疫组化SP法,×100);B:HDAC3蛋白相对表达量(**两组间比较,P<0.01)
图2 各组小鼠喂养5周后末端回肠组织HDAC3蛋白表达比较
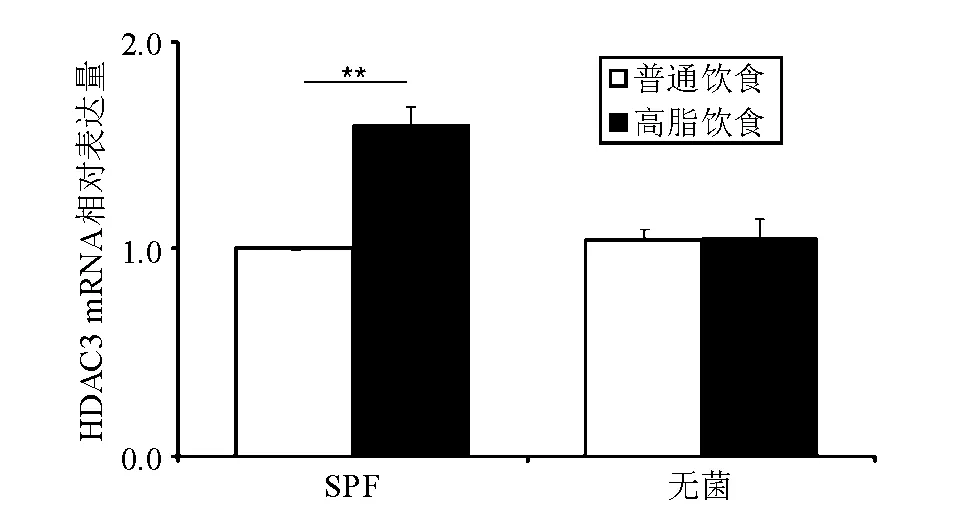
**两组间比较,P<0.01
肠上皮细胞中的HDAC3表达与一些肠道微生物相关,既往研究证实了HDAC3与肠道菌群之间的联系。Yuille等[27]发现除丁酸外,人类肠道菌群还可通过产生戊酸抑制HDAC表达。动物和人体研究均表明在出生早期使用抗菌药物可能改变肠道菌群组分,进而影响机体代谢功能,诱导肥胖发生[28-30],推测抗菌药物引起的肠道菌群改变对HDAC3表达的影响参与了肥胖的发生。本研究发现无菌高脂饮食小鼠末端回肠HDAC3 mRNA和蛋白表达与无菌普通饮食小鼠相比无明显改变,亦不发生肥胖,同样提示了肠道菌群在HDAC3参与肥胖发生中对其表达的调节作用,与上述推测相符。
综上所述,本研究初步探讨了末端回肠HDAC3表达与肥胖以及肠道菌群的关系,发现肠道菌群对末端回肠HDAC3表达可能具有潜在调节作用,进而参与肥胖发生,为肥胖的预防和治疗策略提供了新的思路。后续研究拟通过高通量测序等方法筛选出影响肠道HDAC3表达的目标菌群,并阐明其与肥胖之间的关系,从而进一步明确HDAC3、肠道菌群、肥胖这三者间的联系。

