鸡滑液支原体病的防控应引起高度重视
徐怀英 刘星丽 秦卓明


2.山东师范大学,山东 济南 250014;3.山东省健牧生物药业有限公司,山东 济南 250100)中图分类号:S858.311.33 文献标识码:A 文章编号:1673-1085(2019)04-0009-06
近年来,国内外有鸡关滑液支原体(Mycoplasma Synovias,MS)感染鸡群发病的报道屡见不鲜,危害的品种包括商品肉鸡、肉种鸡,甚至商品蛋鸡屡有发病报道。究竟是什么原因导致MS肆虐鸡群?MS感染率为什么会居高不下?药物防控和疫苗防控出现了哪些问题?本文从MS的流行现状、发病原因、综合防控等方面进行阐述,以使大家得到更多了解。
1 对于MS的基本认识
1.1 病原学 鸡滑液支原体(MS)隶属于软皮体纲、支原体目、支原体属(属Ⅰ),含有双链DNA基因组,相对分子量为4.4~12×108Da,接近于非寄生体所需的最小DNA编码能力极限。其基因组大小为799476bp,G+C含量为28%,有694个ORF(开放阅读框架),占基因组的91%[1]。
MS无细胞壁,仅由胞浆膜包裹,生长需要胆固醇,寄生在人和动物体内。对营养要求苛刻。通常需要加入10%~20%人或动物的血清,用于提供胆固醇和其他长链脂肪酸[2]。这也是支原体难于进行分离和鉴定的重要原因。
MS支原体直径约250~500nm,介于病毒和细菌之间,仅比痘病毒大1~2倍,是立克氏体的1/2,是大肠杆菌的1/5,常可以通过450nm的细菌滤器。MS是在具有自体繁殖能力和合成自身大分子的微生物中,体积最小、构造最简单、能夠自我复制(能在无细胞培养基上生长)的最小的原核生物[3]。支原体和其他微生物的区别见表1。
1.2 对外界环境的抵抗性 MS是支原体的一种。支原体种属众多,广泛分布于自然界。由于支原体有限的生物合成能力使它们必须依赖寄主而生活。呼吸道、泌尿道、结膜表面、消化道等是支原体的寄生部位,大多数支原体是条件性致病菌。
支原体对外界环境的抵抗力不强,离开禽体即失去活力。一般在pH7.0~8.0时生长较好,低于7.0则被抑制或死亡。对紫外线敏感,不耐干燥,主要存在于人和动物的腔道黏膜。对重金属盐、苯酚、常用消毒剂,如乙醇、酚、甲醛、来苏儿等较细菌敏感。对一些表面活性剂和脂溶剂极为敏感,这表明常规的消毒措施对MS均有效。
1.3 危害性 MS主要入侵鸡关节的滑液囊和腱鞘,能够引起亚临床呼吸系统疾病、滑膜炎和家禽气囊炎,能够造成肉鸡生长迟缓、蛋鸡产蛋率降低、蛋壳顶端异常以及自身免疫疾病,具有隐秘性、反复性和亚临床危害性。MS对不同品种、不同日龄的鸡均可危害。雏鸡感染多与垂直传播有关[4]。雏鸡易感性比成年鸡高,抵抗力随年龄的增长而增强。大多数鸡在2~3月龄高发[5]。
研究发现:从气囊病变分离的MS菌株较易引起气囊炎,而从滑膜分离的MS菌株较易引起滑膜炎。接种ND-IB疫苗或呼吸道感染可加重气囊炎病情。IBV与MS共同感染时,气囊炎的严重程度与IBV的毒力有关[6]。环境温度低促进了气囊病变。IBD可引起鸡的免疫抑制,与MS双重感染会导致更严重的气囊病变。
1.4 致病机理 MS主要寄生在呼吸道、关节和结膜等表面,可引起多个部位的急性或慢性感染。
支原体的致病机制与细菌不同,详见图1。在大多数情况下,MS不侵入组织和血液,只能粘附在呼吸道、关节或泌尿生殖道的上皮细胞[7]。支原体粘附于宿主细胞上是成功定殖、感染和致病的先决条件,也被认为是重要的毒力因子。从宿主细胞吸收营养,从细胞膜获得脂质和胆固醇,进而引起宿主细胞的损伤。这种粘附性具有特异性,只能吸附在宿主细胞表面的受体上。支原体可粘附的细胞很广,除上皮细胞外,还可粘附于红细胞、巨噬细胞和精子表面等[8]。支原体在粘附后,可进一步通过不同的机制引起细胞损伤。
MS的致病作用可能与其产生的神经氨酸苷酶、过氧化氢、溶血素、溶菌酶或外毒素有关,MS以其小泡状体经过宿主细胞的叶酸受体后吸附于上皮细胞并侵入固有层,上述物质使上皮细胞纤毛脱落,停止活动,上皮细胞逐渐退化死亡,出现炎症反应。在关节,特别是趾关节和跗关节,可见有异嗜性白细胞和纤维素浸入关节腔或沿腱鞘浸润。滑液囊因绒毛形成、淋巴细胞和巨噬细胞在滑膜下层弥散性或结节性浸润而增生。此间,软骨表面变色、变薄或变成凹陷,从而形成程度不一的关节炎症状。
2 MS的流行现状
2.1 流行病学 在自然条件下,只有鸡和火鸡易感染MS。不同日龄的鸡和火鸡均可感染,日龄越低易感性越强。急性感染通常见于4~16周龄的鸡和10~24周龄的火鸡。慢性感染可见于任何日龄。
马爽等(2016)调查显示,在2010年3月~2015年10月,我国11个省市均有发病,且在6个省市具有明显的上升趋势。鸡群发病日龄多见于1~4月龄,平均发病日龄为62日龄,发病率5.75%~25.77%,发病鸡死亡率为4.09%~15.68%。血清学阳性率为30.23%~54.67%。一年四季均有发生,冬春季节最易发,且呈逐年上涨趋势,这表明滑液支原体在我国鸡群中有蔓延趋势[9]。
Xue等(2017)利用ELISA检测了2010~2015年中国21个省的44395份鸡血清,MS的阳性率为24.7%~57.2%,平均阳性率高达41.19%[10]。
嘉云禽病检测显示,2017年,MS在我国蛋鸡的发病率为5.19%,仅次于大肠杆菌(11.7%),高于鸡毒支原体4.92%,同时高于禽沙门氏菌4.99%。2018年前9个月中,MS在3月、4月、5月、7月、8月的发病率分别为35.48%、20%、18%、18%、15%和9.52%,与大肠杆菌的发病率相当。
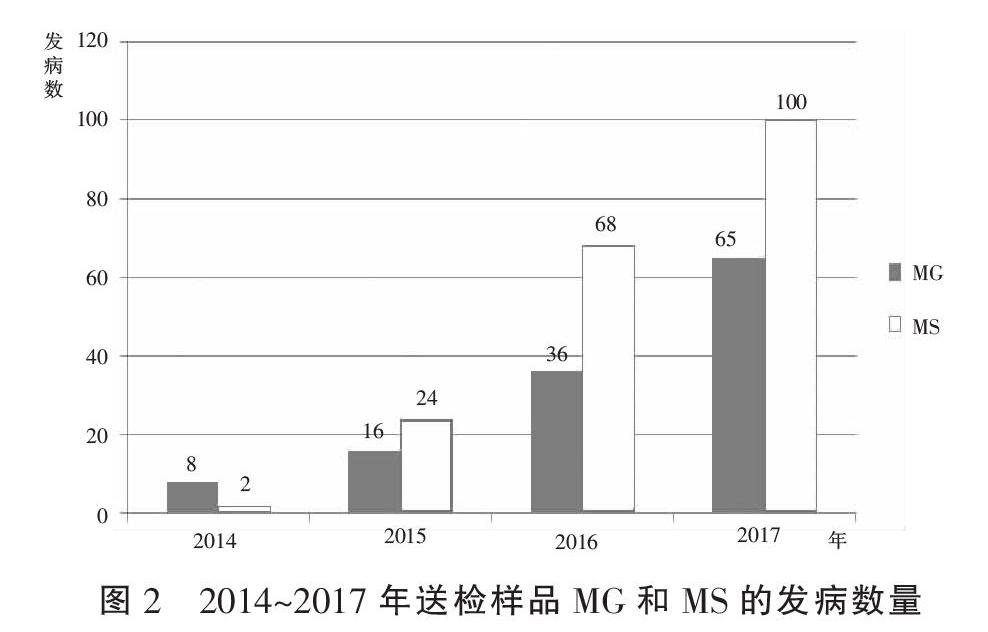
事实上,第十八届世界禽病大会(2013)曾经做出论断,MS在未来对鸡群的危害可能要超过MG(鸡败血支原体)[11]。我们实验室在临床样品中发现,MS的分离率明显高于MG。图2显示的是2014~2017年间山东农业科学院家禽研究所送检样品MG和MS各自的发病数量。很显然,MG(鸡败血支原体)呈现明显的上升趋势。
2.2 临床危害 MS感染初期病鸡表现为采食量轻度减少,精神不振,随着感染时间的增加,经呼吸道感染的鸡出现慢性亚临床呼吸道症状,由全身感染引起滑膜炎的鸡表现为跗关节、趾关节、翅关节,爪垫出现肿胀,部分病鸡龙骨外侧皮肤手感增厚、肿胀。除此之外,还表现为食欲不振,羽毛粗乱,生长迟缓,鸡冠苍白萎缩,排绿色稀便,胸部皮下滑膜囊肿,行走困难,跛行,行动不便影响采食饮水。发病后期,病鸡极度消瘦,呈现营养不良症状,最终可能导致衰竭死亡[12]。
2.3 剖检病变 发病鸡初期无病变。发病中期,病鸡胸骨的滑液囊、跗关节周围腱鞘的滑液囊中可见有淡黄色的清亮的胶冻样粘液,随患病时间增加,逐渐变成浑浊粘稠的乳酪样黄白色渗出物。慢性病例的关节表面有橘黄色干酪样物,随病情进展在关节或其附近的腱鞘和肌肉间,爪垫内有浅黄色渗出物、黄色糊状或干酪状物。个别伴有呼吸道发病的病鸡有时可见气囊炎。
3 高发原因分析
3.1 种源问题 MS传播的主要途径就是垂直传播(经种蛋传播)。美国、欧盟等养禽发达国家和地区对该病主要采用种源净化,并取得了较好的净化效果。而我国尚未开展该病的种鸡净化。
Xue等(2017)调查表明,在我国463个鸡群中,375个鸡场呈现MS阳性(占80.99%),足见MS感染之严重[10]。Sun(2017)对中国2010~2012年16个省的地方品种鸡进行抗体检查,结果显示血清阳性率平均为63.2%,而鸡胚病原分离率高达16.29%,远远高于养禽发达国家的“零”容忍[13]。
2014年以来,以美国为首的养殖发达国家先后发生高致病性禽流感,我国重要的种鸡来源被取消,取而代之的是自繁自养。在这种情况下,家禽的部分垂直传播性疾病纷纷抬头,不断放大,导致上述疾病“雪上加霜”。种鸡污染可能是最近几年我国MS污染直线上升的主要原因。
3.2 疫苗免疫覆盖率低 我国的大多数鸡群未进行MS的疫苗免疫。主要原因是国内外对MS的研究滞后,开发出的疫苗品种相对较少。而疫苗除澳大利亚研发的弱毒活疫苗外,很少再有其他品种,灭活疫苗处于实验室阶段[14]。从理论上讲,只有疫苗的免疫覆盖率超过80%,疫病发生的概率才会大大降低。
3.3 药物效果较差 支原体存在于细胞内,加上它本身缺乏细胞壁,与宿主细胞膜具有特殊的亲和关系,再加上气囊和关节部位血管较少,药物很难到达,因此,对支原体有特效的药物相对较少。
支原体对影响细胞壁合成的抗生素,如β-内酰胺类、万古霉素等完全不敏感,对多黏菌素、利福平和磺胺类药物普遍耐药。对支原体最有抑制活性及常用于支原体感染的抗生素是四环素类(如四环素、多西环素等)、大环内酯类(如泰乐菌素、红霉素、阿奇霉素和泰万菌素等)、氯霉素类(氟苯尼考等)、双萜烯类(泰妙菌素等)及一些氟喹诺酮类药物(如氧氟沙星、加替沙星等)。与MG相比,MS分离株似乎对红霉素有耐药性。在体外,用低水平抗生素培养MS,能够很快产生对红霉素和泰乐菌素的高水平的耐药性,但对恩诺沙星耐药性产生较慢。没有发现滑液支原体产生泰妙菌素和土霉素耐药性。但是,药物无法根除家禽体内的MS感染[15]。
3.4 生物安全意识淡薄 我们是一个养殖大国,但不是养殖强国。具體表现在:规模大、水平低、管理差,疫病发生高。联合国粮食及农业组织(FAO)根据生物安全等级,将养殖场分为4类,其中第Ⅰ类和第Ⅱ类均是指具有较高生物安全水平的工业化家禽生产系统。第Ⅲ类(中级)是仅有中等生物安全水平的商业化畜禽生产系统。第Ⅳ类(最低级)是仅有最低生物安全水平的庭院式家禽饲养。值得关注的是,发达国家如美国、荷兰等的养殖业均以高级别生物安全水平(Ⅰ和Ⅱ)的大型集约化饲养系统为主,甚至像巴西和泰国等发展中国家的养禽业,其主体也是Ⅰ和Ⅱ类。根据这一分类原则,我国大多数的养殖企业处在生物安全水平较低的Ⅲ类,仅有少数企业能达到Ⅰ和Ⅱ类的生物安全标准,疫病防控的压力较大。
4 对MS的综合诊断
4.1 病原的分离与鉴定 MS的分离培养和鉴定是最可靠和最经典的“金标准”。从急性病禽分离MS并不难,但在慢性感染阶段,病变组织中含有MS活菌较少,特别是与其他支原体或病毒混合感染时,MS的分离鉴定工作费时费力,难度大。
4.1.1 直接镜检 在无菌条件下取病鸡囊肿渗出液或者囊内液体,姬姆萨染色于油镜下观察,能够看到大量呈球点状的紫色菌体,少数呈链球状排列,并存在大量白细胞以及粉红色的网状物质。
4.1.2 病原分离和鉴定 无菌状态下用拭子取疑似感染的肿胀跗关节液及内容物于改良的Fery基础培养基加入10%灭活血清以及0.01%NAD,37℃培养,连续传代三次获得待检测的纯培养物。初代分离时,因样品中可能存在组织抗原、毒素和抗体,可采用小量培养的方法进行转移培养,也可用肉汤接种物提高分离率。当肉汤培养物培养至酚红指示剂的颜色从红色变为橘红或黄色时(通常需要3~7d),应将培养物进行传代。MS对低pH较敏感,当培养基酚红指示剂的颜色变黄后(pH<6.8)再培养几小时,就可能死亡。接种平板3~5d后,显微镜放大约30倍可观察到平板上的支原体菌落[16]。
4.2 血清学诊断 最常用的血清学检测方法包括血清平板凝集试验(SPA)、血凝抑制试验(HI)和酶联免疫吸附试验(ELISA)等。SPA快捷、方便,适合在生产中应用,但该方法存在交叉污染和交叉反应,并存在非特异性反应,出现假阳性,特别是曾接种油乳剂疫苗的鸡群和其他细菌混合感染的鸡群[17]。HI方法特异、准确,主要检测血清中的IgG抗体,一般在感染后7d出现,不适合早期诊断。ELISA是一种在生产中较为常用的抗体检测方法。这三种方法具有不同的特异性和敏感性。Luciano等(2011)发现这三种方法检测结果一致性不显著,最好与病原分离鉴定或分子诊断等有机结合起来[18]。
进行血清学诊断时,务必采用发病前和发病后双份血清对比检测。只有抗体滴度上升或感染比例增加时,方能确定感染。
4.3 分子核酸鉴定 随着分子生物学技术的发展,滑液支原体的诊断方法已建立了核酸探针[19]、限制性酶切分析、细胞蛋白分析及PCR等试验技术,可用于滑液支原体感染的早期诊断,其敏感性和特异性较血清学方法高,并且可用于鸡毒支原体和滑液支原体的鉴别诊断[20]。
5 综合防控
MS感染的防治应该以预防为主,应采取以加强生物安全措施、种鸡净化、疫苗预防和药物治疗在内的综合管理措施[21]。
5.1 生物安全是降低MS感染的重要措施 MS的发病与环境因素密切相关。首先,应加强饲养管理,降低饲养密度,注意通风,保持舍内空气新鲜,防止过热过冷、湿度过高,定期清粪,防止氨气、硫化氢等有毒有害气体的刺激等;其次,应坚持“全进全出”制,最大限度地避免多日龄鸡群混养;再次,定期带鸡消毒和环境消毒,加强卫生、消毒防范;最后,要合理分配日粮,定期添加维生素来加强机体自身的免疫力。
5.2 做好种源净化 种源净化是控制支原体发病的核心和关键。美国自1930年就开始其种源净化行动,1970年之后,美国家禽支原体的发病率已降至0,成效显著。统计数据表明:支原体净化后的鸡群,每只母鸡在其一个产蛋期内比普通母鸡可以多产蛋8~20个,经济效益显著提高。
种源净化是一项造福我国家禽产业的长远工程。对于需要净化的鸡群,不允许有疫苗免疫,否者,会干扰净化结果的检测。在开产前,对全群不少于10%鸡群进行SPA血清学检测,应全部阴性;在此后不超过90d的间隔中,对产蛋鸡至少150只鸡进行检测,抗体应为阴性;对其后代雏鸡进行检测,应全部阴性。淘汰所有阳性鸡和可疑鸡。以此为基础建立后备鸡群,经过反复多次检测均为阴性的鸡群可以确定为无MS感染鸡群。对净化后的鸡群应严格生物安全管理。
此外,在生产过程中,必须选择使用SPF弱毒活疫苗,避免疫苗污染而感染鸡群,这是一个非常重要的技术措施。
5.3 疫苗接种 在种源不能净化、支原体污染严重的地区,疫苗接種是减少和预防支原体感染的有效方法,这是由我国的基本国情决定的。支原体的疫苗主要有两种:弱毒疫苗和灭活疫苗,前者主要用于商品鸡和蛋鸡,后者主要用于种鸡的免疫。
弱毒菌苗:澳大利亚研发出一株温度敏感性滑液支原体活菌疫苗株(MS-H株),其安全性和有效性在实验室试验和田间试验中均得到证实,其免疫剂量为4.8×105CFU,具有保护作用;除温度敏感型之外,其他因子似乎也与MS-H疫苗株的致弱有关。这种疫苗已在澳大利亚广泛应用。我国部分种鸡场已推广使用该疫苗[22]。
灭活疫苗:世界上已有商品化生产的MS油佐剂灭活菌苗问世。我国尚缺乏合法的疫苗产品。丁美娟等(2015)利用鸡滑液支原体HN01株研制灭活苗用于预防MS[23]。
免疫程序:种鸡群应弱毒疫苗和灭活疫苗联合使用,先用弱毒疫苗,再用灭活疫苗。开产前免疫灭活疫苗。
抗体监控:活疫苗免疫1月后,抗体阳性率应在80%以上;灭疫疫苗免疫1月后,抗体阳性率应在70%以上。如果阳性率在40%以下,需要重新免疫。
5.4 药物防控 药物治疗不能根除体内的滑液支原体,其药物敏感性和鸡毒支原体相同,对很多药敏感。如在体外对泰万菌素、泰乐菌素、氯霉素、林肯霉素、土霉素、壮观霉素、螺旋霉素、四环素、硫粘菌素等敏感。其中,在临床上,泰万菌素、泰妙菌素对治疗MS具有较好的临床效果。适当的药物对预防本病有作用,但对已出现症状的病鸡治疗效果有限[24]。下面的用药仅供参考。
泰妙菌素:饮水中加入泰妙菌素(0.006%~0.025%),连用5d,对预防鸡的气囊炎和滑膜炎有效。严重者,可连续2个疗程。
泰乐菌素或利高霉素:饮水中加入250~500mg/L,连用5d,具有治疗效果。
泰万菌素:饮水中加入250mg/L,连用5d,具有治疗效果。
参考文献:
[1] 魏顺.衣阿华支原体与滑液支原体的全基因组测序及分析[D].武汉:华中农业大学,2012.
[2] 吴移谋,叶元康.支原体学[M].北京:人民卫生出版社,2008.
[3] 曹中赞,栾新红,刘胜旺,等.禽滑液囊支原体研究进展[J].动物医学进展,2012(11):113-117.
[4] 韩雪娇.某蛋种鸡场鸡滑液囊支原体传播规律及感染来源的研究[D].杨凌:西北农林科技大学,2015.
[5] 易科振.鸡滑液囊支原体病的诊疗[J].畜牧兽医科技信息,2016(05):113-114.
[6] Hopkins SR,Yoder HW, Jr.Influence of infectious bronchitis strains and vaccines on the incidence of Mycoplasma synoviae airsacculitis[J].Avian diseases,1982,26(4):741-752.
[7] 包世俊,丁小琴,邢小勇,等.滑液支原体WVU1853株免疫相关膜蛋白的初步分析[J].畜牧兽医学报,2017(02):316-323.
[8] 包世俊.滑液支原体膜表面丙酮酸脱羧酶的生物学特性研究[D].北京:中国农业科学院, 2014.
[9] 马爽,郭莉莉,宋新宇,等.鸡滑液囊支原体感染的流行病学调查与分析[J].中国家禽,2016(23):68-71.
[10] Xue J,Xu MY,Ma ZJ,et al. Serological investigation of Mycoplasma synoviae infection in China from 2010 to 2015[J].Poultry science,2017,96(9):3109-3112.
[11] 于圣青.滑液支原体的危害或将增大[J].中国家禽,2013(17):37.
[12] 孙洪志.蛋鸡滑液囊支原体病的临床特点、鉴别和防控措施[J].现代畜牧科技,2017(01): 92.
[13] Sun S,Lin X,Liu J,et al.Phylogenetic and pathogenic analysis of Mycoplasma Synoviae isolated from native chicken breeds in China[J].Poultry science,2017:
[14] 王昆,宫晓炜,陈启伟,等.禽滑液囊支原体诊断与防控技术研究进展[J].黑龙江畜牧兽医,2018(09):31-34+245.
[15] 宫晓炜,马文瑛,陈启伟,等.畜禽支原体耐药性及耐药机制研究进展[J].中国畜牧兽医,2017,44(08):2489-2495.
[16] 刘婷.鸡滑液囊支原体JS1株的分离鉴定及禽支原体、大肠杆菌、沙门菌多重PCR检测方法的建立[D].泰安:山东农业大学,2016.
[17] 宁宜宝,冀锡霖.鸡滑液支原体平板凝集抗原中试生产及应用的总结[J].中国兽药杂志,1997(03):38-39.
[18] Luciano RL,Cardoso AL,Stoppa GF,et al. Comparative Study of Serological Tests for Mycoplasma synoviae Diagnosis in Commercial Poultry Breeders. Veterinary medicine international[J].2011,2011:304349.
[19] 陈茹.鸡毒支原体和滑液支原体的种特异性寡核苷酸探针[J].中国动物检疫,1994(04):45.
[20] 黎敏,管凤霞,刘玲,等.应用多重套式PCR检测鸡毒支原体和鸡滑液囊支原体[J].广东畜牧兽医科技,2010(04):34-36.
[21] 赵光彩,董仲生.鸡滑液囊支原体病的防治效果观察[J].中国兽医杂志,2017,53(12):53-54.
[22] Morrow CJ,Markham JF,Whithear KG. Production of temperature-sensitive clones of Mycoplasma synoviae for evaluation as live vaccines[J].Avian diseases.1998,42(4):667-670.
[23] 丁美娟.鸡滑液囊支原体的分离鉴定及部分生物学特性研究[D].南京:南京农业大学,2013.
[24] 顧的乐.鸡滑液囊支原体的分离鉴定及耐药性分析[J].中国新技术新产品,2014(13):165-166
收稿日期:2019-03-15
*基金项目:山东省自然科学基金(ZR2017MC038);国家重点研发计划(2016YFD0500800);山东省重点研发计划(2018GNC110020)。
作者简介:徐怀英(1976-),女,汉族,山东冠县人,博士,主要从事家禽传染病防控研究,E-mail:hyingxu@163.com。
通讯作者:秦卓明,E-mail:qinzm1997@163.com。

