一株光合细菌的分离筛选及其对无机氮的去除能力
李凌志 刘璇 刘洋 徐爱玲 宋志文

摘 要:通过对海洋环境污泥进行富集培养及分离筛选得到一株光合细菌,通过16S rDNA全序列分析,结合菌株形态和结构,鉴定其为Ectothiorhodospira magna。研究表明菌株在盐度30‰、28 ℃、DO 8 mg/L的条件下,对初始浓度分别为280、84、98 mg/L的氨氮、亚硝酸盐氮和硝酸盐氮经过10 d处理的去除率分别为81.83%、46.21%、86.79%。在氨氮、亚硝酸盐氮和硝酸盐氮共存的环境下,菌株首先利用氨氮,之后将亚硝酸盐氮转化成硝酸盐氮。
关键词:光合细菌;分离筛选;菌种鉴定;无机氮;去除效果
光合细菌(Photosynthethetic Bacteria,PSB)是地球上最早出现的,具有原始光能合成体系不产氧细菌的统称[1],主要包括红螺菌科(Rhodopseudomonas)、着色菌科(Chromatiaceae)、外硫红菌科(Ectothiorhodosperilaceae)、绿硫细菌科(Chlorobiaceae)、绿色丝状菌科(Chloroflexaceae)、螺旋杆菌科(Helibacteriaceae)以及含细菌叶绿素a的好氧菌(Bacteriochlorophylla-containing aerobic bacteria)等七大类[2]。由于光合细菌能够去除养殖水体中氨氮、亚硝酸盐和硝酸盐等有毒物质,并且不消耗水体中氧,而且其本身也含有丰富的蛋白质、维生素和光合色素等营养物质,亦可以作为幼虾的单细胞蛋白来源,以此显著增强养殖动物的免疫水平,以提高其成活率,很快成为水产养殖中应用最多的微生物之一[3]。
本研究从青岛海泊河入海口底泥中分离筛选出一株光合细菌,通过分析其16S rDNA全序列并结合菌株细胞形态和结构、菌液的吸收特征波峰、碳源利用情况对菌株进行鉴定,研究菌株对无机氮的转化能力。
1 材料与方法
1.1 實验材料
污泥来源:污泥取自青岛海泊河入海口岸边,距地表面20 cm,距离海泊河污水厂排污口500 m左右。
培养基:采用光合细菌富集培养基及RCVBN培养基[4]。
1.2 实验方法
1.2.1 光合细菌的富集培养 取2 g污泥装入100 mL试管中,加入富集培养基95 mL,再加入2 mL液体石蜡以隔绝空气。将其置于光照恒温培养箱中,在30 ℃、光照2 000 lx的条件下富集培养,当液体培养基变成红色后,取10 mL的菌液,装入灭菌50 mL玻璃具比色管中,再次富集,直到菌液颜色变为深红色为止。
1.2.2 菌株的分离纯化及扩大培养 从富集培养物当中取1 mL,按照10-4到10-6成梯度稀释,分别均匀涂布在RCVBN固体培养基(RCVBN培养液中加入2%琼脂)上,将涂布好的斜面培养基放于生化光照培养箱,在温度30 ℃、光照强度3 000 lx条件下 ,培养7 d,待斜面培养基表面长出红色菌落后,挑取该菌落至新的RCVBN固体培养基的斜面上划线,再将其重新放回生化光照培养箱,同样的培养条件再培养7 d,重复3次,直到培养出纯菌为止,将纯种的菌株穿刺接种,放入冰箱保存。
将50 mL螺口试管作为菌种的活化容器,加入45 mL RCVBN培养基,把菌株接种到培养基当中,接种后将螺口试管的螺帽拧紧,温度30 ℃、光照强度3 000 lx条件下厌氧培养,待试管中的液体变为深红色(OD660≥1.5)。
1.2.3 菌株形态及生理生化性质研究
菌株细胞形态及结构观察:将光合细菌菌液离心,去上清液,用2.5%戊二醛固定后进行超薄切片,采用透视电镜观察菌株的细胞形态和结构[4]。
16S rDNA提取:按照OMEGA Bacterial DNA Kit试剂盒说明书进行,将提取得到的DNA质粒,送至上海派森诺生物科技股份有限公司进行测序。得到基因序列后,用ChromasPro编辑序列并与NCBI数据库比较,利用BLAST搜索引擎在GenBank中找出相似程度比较高的典型菌株,利用MEGA-X软件中多序列对比,画出用最大似然(Maximum Like-Lihood)法和贝勒斯推论(Bayesian inference)法下的系统发育树,并用Bootstrap进行统计检验。
碳源利用试验:分别用16 mmol/L的DL苹果酸、乙酸钠、丙酸钠、丙酮酸钠(以钠盐计算)替代RCVBN培养基中的碳源。28 ℃、光照强度3 000 lx的条件下厌氧培养5 d后,以空白样为对照组,测定OD660,比较菌株对碳源利用情况。
特征吸收波峰试验:从光合细菌种子液取2 mL菌液,在室温的条件下8 000 r/min离心10 min,倒掉上清液,用无菌水洗涤,然后再离心,重复3次后,加入无菌水稀释,用紫外可见光分光光度计在230~910 nm进行扫描,记录出现的波峰[5]。
1.2.4 碳源对菌株去除无机氮效果的影响
将海水晶溶解在蒸馏水中配制成盐度为30‰的人工海水,将pH预调至8.5±0.5,将其装入5 L烧杯中灭菌,用加热棒控制水体的温度为28±1 ℃。
碳源浓度对光合细菌菌株氨氮去除效果的影响:设置初始氨氮浓度约280 mg/L(20 mmol/L),投加乙酸钠(AR)浓度分别为40、32、24、16、8、4 mmol/L。
碳源浓度对光合细菌菌株亚硝酸盐氮氮去除效果的影响:设置初始亚硝酸盐氮的浓度约为84 mg/L(6 mmol/L),投加乙酸钠(AR)浓度分别为72、48、24、16、8和4 mmol/L。
碳源浓度对光合细菌菌株硝酸盐氮氮去除效果的影响:设置初始硝酸盐氮浓度约为112 mg/L(8 mmol/L),投加乙酸钠(AR)浓度分别为8、4、2、1、0.5 mmol/L。
三种无机氮共存条件光合细菌菌株的去除效果:设置初始氨氮、亚硝酸盐氮、硝酸盐氮浓度分别为6、6、10 mmol/L,投加碳源浓度为8 mmol/L。
1.2.5 三种无机氮检测方法 氨氮采用纳氏试剂分光光度法[6];亚硝酸盐氮采用改良的重氮-偶联法[7];硝酸盐氮采用紫外分光光度法[6]。
2 结果与讨论
2.1 菌株的分离纯化及鉴定
2.1.1 菌株的菌落与细胞形态 通过在RCVBN固体培养基上涂布和划线,在光照强度3 000 lx、温度30 ℃厌氧的条件下,纯化、分离得到一株光合细菌,编号为SQD.C08。RCVBN培养基呈红色针尖状大小,边缘湿润、有光澤,革兰氏阴性菌。在3 000 lx、25~30 ℃的环境下厌氧培养,液体培养基最终变为深红色,待菌体老化后,菌液中产生红色絮状沉淀。
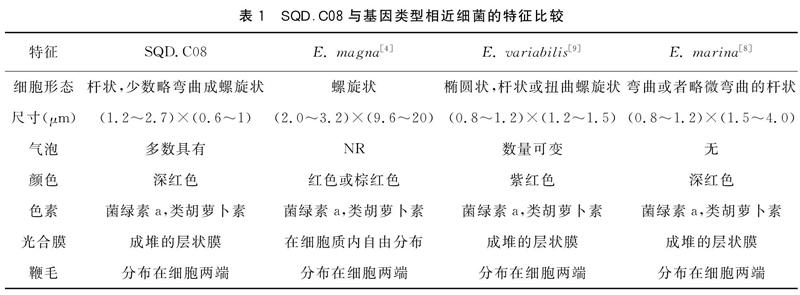
2.1.2 菌株的形态特征 菌株的透射电镜照片如图1所示,菌株大小为(1.2~2.7)×(0.6~1)μm。表1为与菌株SQD.C08基因类型相近的同属细菌的形态特征,由表可知绝大多数Ectothiorhodospira属细菌,层状光合膜有序地堆叠在一起[8],而不像Ectothiorhodospira magna是呈长链薄膜分布在整个细胞中[4],光合膜体积约占细胞内体积的60%~70%。在生长后期,大多数细胞都会产生气泡,但由于气泡在细胞中所占比例不大,所以该菌种的绝大多数细菌会沉在试管的底部,而不像E.variabilis[9]的绝大多数细胞一样浮在试管的上方。在细胞质小颗粒的圆形内含物可能是聚磷酸盐,浅色的内含物可能是聚β羟基丁酸酯。
菌株的菌液在505 nm、590 nm、805 nm以及855 nm处具有吸收波峰。依据表2数据可知,该光合细菌含有类胡萝卜素和菌绿素a。根据图2的波峰高度可以判断,菌株积累类胡萝卜素的能力较弱,积累菌绿素a的能力较强。
2.2 光合细菌菌种16S rDNA鉴定结果
菌株的16S rDNA的序列长度为1 402 bp,具体序列为:
将菌株的16S rDNA的结果与其相似度最高的典型菌株用最大似然法和贝叶斯推论法构建系统进化树,结果见图3。从图中可以看出,与菌株亲缘关系最近的物种是E.magna,而者之间的相似度为99%,而相关节点的自展支持值和贝勒斯都达到最大值,因此菌株初步鉴定为E. magna。
2.3 光合细菌菌株对不同碳源的利用情况
光合细菌菌株SQD.C08对不同碳源的利用情况见图4,可以看出光合细菌菌株SQD.C08对柠檬酸钠、丙酸钠、丙酮酸钠、乙酸钠均能进行较好的利用,其中生长最好的是丙酮酸钠,其次是乙酸钠,对苹果酸钠利用较差。
2.4 光合细菌菌株对无机氮的去除效果
在不同乙酸钠浓度条件下,光合细菌菌株对氨氮的去除效果见图5,从图中可以看出,实验过程中实验组和空白组氨氮均呈下降趋势,但去除效果存在差异。当初始碳源投加量大于16 mmol/L即C/N比大于0.8时,菌株SQD. C08对氨氮的去除能力比较明显;当碳源浓度为40 mmol/L即C/N比为2时,氨氮的去除率最高,达到81.8%。当初始碳源投加浓度大于32 mmol/L即C/N大于1.6时,尽管投加碳源浓度升高,氨氮去除率基本无变化,可以推测32 mmol/L的碳源浓度可能是最经济的碳源浓度;投加碳源浓度低于16 mmol/L时,氨氮去除效果基本与空白组一致。在不外加碳源的条件下,菌株SQD.C08对氨氮的去除率为35.6%。
图6为不同乙酸钠浓度条件下,光合细菌菌株对亚硝酸盐氮的去除效果。在实验过程中,实验组和空白组中的亚硝酸盐氮均有下降,与碳源浓度存在明显关系。当水体中碳源浓度不低于48 mmol/L时,菌株对亚硝酸盐氮的去除效果较为明显,水体中碳源浓度为72 mmol/L时,亚硝酸盐氮的去除率最高,为46.2%。当碳源浓度低于48 mmol/L时,虽然菌株对亚硝酸盐氮的去除能力与水体中外加碳源浓度成正比,但各实验组的去除率差异很小。在空白组中,菌株对亚硝酸盐氮的去除率仅为7.2%。
不同碳源浓度条件下,光合细菌菌株对硝酸盐氮的去除效果见图7。可知菌株在人工海水中对硝酸盐氮的去除效果与碳源浓度存在着明显关系。空白组水体的硝酸盐氮浓度基本不变,但实验组当中的硝酸盐氮均有明显的下降。在2 mmol/L的碳源浓度的实验组中,菌株对硝酸盐氮的去除效果最好,去除率为89.7%,且再增加碳源浓度菌株对硝酸盐氮去除影响不大。相比于氨氮和亚硝酸盐氮的去除过程,只需投加少量碳源,菌株对硝酸盐氮就有明显的去除效果。但不投加碳源时,菌株对水体中的硝酸盐氮基本没有去除能力。
在氨氮、亚硝酸盐和硝酸盐共存条件下,光合细菌菌株对无机氮的去除情况见图8。可以看出,在水体中三者共存的条件下,菌株优先去除氨氮,对氨氮的去除率最终达到86.87%。在前5 d水体中亚硝酸盐氮的浓度明显升高,说明菌株首先将氨氮转化成了亚硝酸盐氮,同时水体中硝酸盐氮的浓度下降,说明菌株能直接去除硝酸盐氮。水体5 d后水体中氨氮含量略有升高,是由于菌株生长代谢所产生的,加之水体中碳源所剩无几,导致菌株去除氨氮的能力下降,使水体中的氨氮浓度上升,水体中的亚硝酸盐氮明显下降而硝酸盐氮含量的升高,说明菌株将水体中的亚硝酸盐氮转化成了硝酸盐氮。
在只含氨氮的条件下,菌株对氨氮的去除能力和水体中有三种无机氮条件下对氨氮的去除能力进行比较得知。菌株在都含有三种无机氮的水体环境中去除氨氮的能力没有降低,甚至还略有提高。
3 结论
从海水底泥中分离出来一株光合细菌,编号为SQD.C08。经过菌株形态、生理生化、菌液吸收波峰及16S rDNA鉴定菌株SQD.C08为Ectothiorhodospira magna。
菌株在人工海水中对氨氮、亚硝酸盐氮、硝酸盐氮的去除率分别达到81.83%、46.21%、86.79%;菌株需要投加较多的碳源才能对亚硝酸盐氮有明显的去除效果,而只需投加较少的碳源就能对硝酸盐氮有明显的去除效果。
在氨氮、亚硝酸盐氮和硝酸盐氮共存的水体中,菌株会优先去除水体中的氨氮。菌株去除的氨氮,只有一部分转化成为亚硝酸盐氮,很大一部分被自身同化。菌株在去除亚硝酸盐氮的时候会将其转化成为硝酸盐氮。
参考文献:
[1] 卢海凤,张光明,赵微.光合细菌污水资源化技术[M].北京:中国建筑工业出版社,2015,1.
[2] Holt J H,Bergey D H,Krieget N R,et al. Bergey's manual of determinative bacteriology[M].Williams Wilkins Company,1994:520-521.
[3] Kobayashi M,chan Y T.Treatment of Industrial Waste Solutions and Production of Useful By-Products Using a Photosynthetic Bacterial Method[J].Water Research,1973,7(8):1219-1224.
[4] Bryantseva I A,Tourova T P,Kovaleva O L,et al. Ectothiorhodospira magna sp. nov.,a New Large Alkaliphilic Purple Sulfur Bacterium[J].Microbiology,2010,79(6):780-790.
[5] 盧海凤,张光明,何春华.一株光合细菌的鉴定及其处理大豆加工废水试验[J].哈尔滨工业大学学报,2011.
[6] 水和废水检测分析方法(第四版)[M].北京:中国环境科学出版社,2002:266-268,279-281.
[7] 闫坤朋,牛成洁,宋志文,等.重氮偶联法测定水中亚硝酸盐氮的改进[J].中国环境监测,2018.
[8] Oren A, The Family Ectothiorhodospiraceae//Rosenberg E, DeLong E F,Lory S, et al. The Prokaryotes Gammaproteobacteria 4th ed[M]. Springer Heidelberg New York Dordrecht London.199-222.
[9] Gorlenko V M,Bryantseva I A,Rabold S,et al.Ectothiorhodospira variabilis sp. nov.,an alkaliphilic and halophilic purple sulfur bacterium from soda lakes[J].Int J Syst Evol Microbiol,2009,59:658-664.

