外泌体研究进展及未来的应用与挑战*
于广鑫 曾婉嘉 鲁凤民
(北京大学基础医学院病原生物学系 北京 100191)
1 外泌体简介与发现、发展历程
外泌体是细胞外囊泡(extracelulav vesicle,EV)中最小的一种,直径约为30~150 nm,由晚期内体/多囊泡体(multivesicular body,MVB)与质膜融合后释放到细胞外环境中。早在1983年,Clifford Harding[1]和Bin-Tao Pan[2]利用抗转铁蛋白受体抗体可视化的方法,分别在大鼠和绵羊网织红细胞中,观察到这种经由多囊泡内体(也称多囊泡体)与质膜融合而释放的小囊泡,随后Rose M.Johnstone[3]将之称为“外泌体”。外泌体一开始被认为是细胞排泄细胞碎片和过时废物的一种形式,直到1996年,Graqa Raposo[4]发现衍生自人和鼠B 淋巴细胞的外泌体可以诱导抗原特异性MHC Ⅱ类限制性T 细胞应答,证实外泌体参与细胞的免疫过程。外泌体领域的一次重要突破在于发现外泌体可以携带 mRNAs、微小RNA(mircroRNAs,miRNAs)[5]和线粒体RNA[6]等核酸内容物并在细胞间相互传递。这一发现引发了外泌体领域的研究热潮。2013年,美国科学家James E.Rothman 和Randy W.Schekman,德国科学家Thomas C.Südhof 因为发现细胞内部囊泡(包括外泌体)运输调控机制而荣获诺贝尔奖。
2 外泌体的产生及分泌
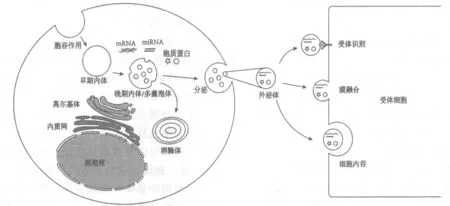
图1 外泌体产生与分泌(参考自文献[9,10,12])
外泌体的产生需要经历以下过程:细胞外物质被细胞膜包裹并向内凹陷形成早期内体,早期内体在迁移和成熟过程中,内体膜向内凹陷并将胞质中的细胞物质包裹,形成携带核酸、蛋白质和其他代谢物质等内容物的管腔内囊泡(ILV),进而转化成内含多囊泡的晚期内体,也称多囊泡体。内体分选转运复合体(ESCRT)及其相关蛋白或辅助因子,例如肿瘤易感基因101 蛋白(TSG101)、液泡蛋白分选因子(Vsp4)和Alix 蛋白等在此过程发挥了重要作用[7-8]。此外,涉及脂质、中性鞘磷脂酶、跨膜4 超家族成员9(TM4SF9)、热休克蛋白(HSP)等非ESCRT 依赖的外泌体产生途径也被相继提出[9-10]。之后,MVB 与细胞膜融合,这些管腔内囊泡释放到细胞外环境中形成外泌体。Rab GTP酶家族成员,尤其是Rab27a 和Rab27b,调控了该过程的进行[11]。随后外泌体利用膜融合、内吞,以及识别和结合细胞表面特异性受体,将内容物递送至靶细胞。
3 外泌体的生理病理功能
外泌体可由免疫细胞、神经细胞和干细胞等多种类型细胞分泌,同时具有不同的生理功能,例如抗原呈递[13]、RNA 传递[14]及组织修复[15]等。作为细胞间重要的通讯工具,外泌体携带了丰富的生物活性物质,例如DNA,mRNAs,miRNAs 和蛋白质等。这些物质在脂质双分子层的保护下,可以相对稳定地存在于细胞外环境中,因此,其不仅能作用于邻近的细胞,还可通过体液运输进入远端的靶细胞,履行其作为生理和病理信号载体的功能[16]。有研究显示,外泌体可以介导神经元与神经胶质细胞之间的相互作用,从而调节轴突生长和突触形成[17]。除了参与正常的生理活动,外泌体还与疾病进展有关。肿瘤细胞分泌的外泌体不仅可以影响局部的肿瘤微环境,促进血管形成和肿瘤细胞增殖,还能经长距离运输到达远端,增强血管形成并诱导内皮细胞和基质细胞分化,形成适合肿瘤转移定植的微环境[18]。此外,外泌体可以将肿瘤抗原呈递给树突状细胞,诱导免疫应答[12]。但其也能诱导活化的细胞毒性T 细胞凋亡、减少自然杀伤细胞增殖能力或促进调节性T 淋巴细胞的分化,从而发挥免疫抑制作用[19]。
4 外泌体的未来应用
外泌体可以携带核酸、蛋白质等物质进出细胞。几乎所有体液中都有外泌体的存在,包括唾液、母乳、血液、滑液、羊水、尿液、精子和卵泡液等[20]。不同疾病患者从细胞释放到循环系统及泌尿系统中的外泌体,其所含脂质、蛋白质和RNA 水平有明显差别,这使得血液或尿液等来源的外泌体可以作为多种疾病的潜在诊断标志物[21-22]。多项研究表明,从血清中分离的外泌体拥有作为胰腺癌[23]、多形性胶质母细胞瘤[24]、胃癌[25]、神经系统疾病[26-27]等疾病诊断标志物的潜力,而尿液中的外泌体已作为生物标志物的材料来源,用于肾脏、泌尿系统及全身性疾病的诊断[21,28]。相对于组织样本的难获取和难重复性,利用外泌体来源的生物标志物进行疾病的检测,是一种准确、无创且成本效益更优的诊断方法。
除用于疾病诊断外,良好的生物相容性、循环稳定性、生物屏障渗透性、低毒性和低免疫原性,使得外泌体具有作为药物载体的潜力。利用外泌体进行基因编辑工具的递送,也是科学家关注的热点。例如在体外将过氧化氢酶加载到外泌体中,通过鼻腔给药到达急性脑炎小鼠模型脑部,使神经元存活数量提高3 倍[29]。Kim 等[30]通过电穿孔方法将CRISPR/Cas9 表达质粒注入外泌体中,可有效递送CRISPR/Cas9 系统,进而实现对靶细胞的基因编辑,这一发现揭示了外泌体在递送CRIPSR/Cas9系统中的潜在价值。与Kim 等的研究类似,Lin 等[31]将外泌体和脂质体孵育,开发了一种外泌体-脂质体杂合的类脂质体,并成功通过这种杂合类脂质体递送CRISPR-Cas9 表达质粒。此外,也有研究者通过在Cas9 蛋白上融合2 ~4 个NEDD4家族蛋白的WW 结构域,使Cas9 蛋白能被选择性地募集到抑制蛋白结构域蛋白1(arrestin domain containing protein 1,ARRDC1)介导的微泡[ARRDC1-mediated microvesicles(ARMMs)]上[32],或者在供体细胞中过表达水泡性口炎病毒的糖蛋白
(glycoprotein of the vesicular stomatitis virus,VSVG),使细胞能够产生携带gRNA 和Cas9 蛋白的囊泡[33]。这些外泌体递送基因编辑系统的研究,均极大地推动了CRISPR-Cas9 应用于临床的进程。相对于人工合成的纳米载体而言,外泌体在结构和组成上与细胞膜更相似,具有足够时长的循环半衰期,并且可以穿透组织深处并逃避免疫系统的清除,是一种很有应用前景的递送工具。此外,通过人工修饰外泌体以增加其靶向性,是当下外泌体递送策略的研究重点之一。这种靶向性可以通过在亲本细胞中导入表达靶向配体和跨膜蛋白域的融合质粒完成,也可以对外泌体表面进行靶向抗体的涂覆[34-35]。
5 外泌体研究面临的挑战
尽管外泌体在疾病诊断及药物递送方面表现出了令人兴奋的应用前景,但仍有一些问题需要注意。首先,如何提升内容物检测的灵敏度和特异性,是外泌体作为生物标志物必须跨越的障碍。其次,血浆和尿液里的外泌体来源于多种组织细胞,如何通过外泌体的特异性表型特征,对其来源细胞进行鉴定,以更好地解读外泌体携带的信息仍需进一步探索。此外,样本中包含有很多与外泌体相似的组分,例如细胞碎片、其他细胞外囊泡等,随着外泌体研究的发展,现有分离技术已经不能满足研究的需要,开发更为高效的外泌体分离技术,才能在外泌体领域进行更深入的探索。最后,作为药物靶向载体,优化出更为高效的药物加载方式,以及精确、无副作用的靶向装置,是保证治疗成功的关键所在。

