OPO乳脂粉对肠道微生物体外发酵的影响
侯爱香,成 焕,李宗军,*,李 月
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.湖南农业大学 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
1,3-二油酸-2-棕榈酸甘油三酯(1,3-dioleoyl-2-palmitoyl triglyceride,OPO)是棕榈酸位于sn-2位、油酸位于sn-1,3位的三酰基甘油酯。OPO是人乳脂和猪油的重要成分,也是添加在婴幼儿配方奶粉中的营养补充剂。添加在婴幼儿奶粉中的OPO是以植物油为原料,在脂肪酶催化作用下进行酯交换,使sn-2位上的棕榈酸含量达到40%以上,从脂肪酸组成和分布上接近母乳脂肪[1-3]的结构脂。动物实验和临床调查研究发现,OPO结构脂的添加,可以减少婴儿粪钙流失,降低能量损失,激活免疫细胞,提高婴幼儿的抵抗力[4-5]。因此,OPO作为一种有效的营养功能成分已被广泛添加到婴幼儿配方乳粉中[6]。通常,OPO以干法或湿法两种形式添加到婴幼儿配方奶粉中:一是用棕榈油和酶作用制成富含OPO的植物乳脂油,湿法加入奶粉中;二是在富含OPO的植物乳脂油中加入乳糖等成分,经乳化干燥,制成粉剂营养补充剂[7],即富含OPO的植物乳脂粉,简称OPO乳脂粉,干法加入配方奶粉中。目前中国婴幼儿配方奶粉中,很多采用干法加入的方式[8]。近年来,随着学习压力的增大,生活节奏的变快,电子产品的增多和户外运动量的减少,我国青少年身体素质呈持续下降趋势[9]。大学生是国家的人才后备主力,但很大一部分由于远离家庭监管,饮食和作息不规律,学业竞争激烈,就业和深造压力大,身体素质也大不如前,现已经引起社会的广泛关注[10]。OPO乳脂粉作为婴幼儿配方奶粉的营养补充剂,是否可用于青少年的膳食补充,也成为青少年营养食品开发需要关注的新问题。
研究发现肠道微生物与人类健康密切相关,它在人体疾病发生、免疫调控、膳食因子互作等方面都起着至关重要的作用[11-14]。近年来有大量研究从肠道微生物和代谢组角度关注食品添加剂、食品乳化剂、益生元、功能性成分、微量元素、多酚类化合物等膳食因子对机体的影响[15-17]。肠道微生物与膳食因子互作已成为人类阐释膳食因子调控健康研究的热点和着眼点。OPO乳脂粉与人体肠道微生物的互作效应也成了阐释OPO乳脂粉营养机制的有效途径。同时,研究发现,肠道微生物体外厌氧发酵和肠道内发酵在细菌数量、组成、多样性和代谢产物等方面都相似,体外厌氧发酵模型已被越来越多研究者采纳[18-19]。周笑犁等[20]通过体外发酵模式,研究发现大豆寡糖提高了发酵液微生物的多样性。谢旻皓等[21]通过体外发酵模式,发现苦丁茶冬青苦丁茶及3,5-diCQA具有一定的调节肠道微生态的作用。Guergoletto等[22]利用体外发酵模型探讨了Euterpe edulis的体外发酵特性。因此,OPO乳脂粉与肠道微生物的互作研究也可以尝试采用体外发酵模式来实现。
目前,OPO乳脂粉的应用范围相对较小,主要集中在婴幼儿奶粉中,为进一步发挥OPO乳脂粉的营养作用,拓宽应用范围,强健青少年体魄,本研究以富含OPO的植物乳脂粉为原料,以健康普通大学生的新鲜粪便为菌源,采用体外厌氧发酵模式,研究不同含量OPO的添加在不同发酵阶段对pH值、微生物结构数量及代谢产物短链脂肪酸的影响,为OPO乳脂粉产品在青少年食品中的推广应用提供基础数据,为大学生营养食品的开发提供前期研究。
1 材料与方法
1.1 材料与试剂
OPO乳脂粉:含有50%植物精炼油(精炼油为含40%OPO的棕榈油)、41.63%乳糖、4.21%蛋白质、3.72%水,稳定剂、乳化剂、维生素、和矿物质等成分合计为0.44%,由中国无锡某食品添加剂公司提供。
粪便样品:20~22 岁3 名健康女大学生志愿者的新鲜粪便,所选志愿者饮食正常,两个月内未服用或注射过抗生素、未患腹泻及肠炎等疾病,且采样时未在生理期。
含氮基础发酵液:1 L纯净水,酵母粉2 g,蛋白胨2 g,NaHCO32 g,L-半胱氨酸0.5 g,胆汁酸盐0.5 g,吐温-80 2 mL,NaCl 0.l g,氯化血红素0.05 g,K2HPO40.04 g,MgSO4·7H2O 0.01 g,CaCl2·7H2O 0.01 g,VK 10 μL,0.025 g/100 mL刃天青4 mL。
选择性培养基:Wilkins and Chalgren琼脂用于计数总厌氧菌[23];BBL培养基用于计数双歧杆菌[24];Rogosa培养基用于计数乳酸杆菌[25];Sulfite-polymyxin-milk琼脂用于计数梭状芽孢杆菌[26];拟杆菌矿物盐琼脂用于计数拟杆菌[27];紫红胆盐葡萄糖琼脂用于计数肠杆菌科菌[28];营养琼脂用于计数总需氧菌[29]。培养基均购于北京陆桥技术股份有限公司。
酵母粉、蛋白胨、L-半胱氨酸、胆汁酸盐、吐温-80 国药集团化学试剂有限公司;NaHCO3、NaCl、K2HPO4、MgSO4·7H2O、CaCl2·7H2O 成都市科龙化工试剂厂;氯化血红素、刃天青、VK 天津市密欧化学试剂有限公司;除特殊规定外,本研究所用试剂均为分析纯,水为蒸馏水。
1.2 仪器与设备
HH-8电热恒温水浴锅 上海浦东物理光学仪器厂;TP-213分析天平 北京赛多利斯仪器系统有限公司;SP500高压蒸气灭菌锅 日本Yamato公司;SW-CJ-2D超净工作台 苏州净化设备有限公司;YQX-I厌氧培养箱 上海跃进医疗器械厂;SPX-250B-Z恒温生化培养箱 上海博迅实业有限公司医疗设备厂;TG16-WS高速台式离心机 长沙湘仪离心机仪器有限公司;C-43圆底立式培养袋、C-1厌氧产气袋 日本三菱瓦斯化学株式会社;7890A气相色谱仪美国安捷伦科技有限公司;Testo205 pH计 德国Testo AG集团;旋涡振荡器 迈菱贸易(上海)有限公司。
1.3 方法
1.3.1 粪便处理
粪便取样器、压舌板、一次性手套、镊子、牛皮纸、自封袋、EP管离心管、试剂瓶等采样工具提前灭菌,部分塑料取样用具再用DEPC水浸泡24 h以上;采集每位志愿者的新鲜粪便10 g,在厌氧操作箱中将3 名志愿者的粪样混匀,取混合粪样10 g加入到100 mL无菌的稀释液中按1∶10稀释,加几粒无菌玻璃珠涡旋,使粪便充分分散。稀释的粪液用4 层无菌纱布过滤取滤液为菌源液,所有新鲜粪便样品的采集和处理需在1 h内完成。
1.3.2 OPO厌氧发酵
参考Li Yanqi[30]和Zhang Xin[31]等体外发酵研究方法进行改进,用于OPO对人体肠道微生物的影响研究。37 ℃条件下,模拟人体肠道环境,配制发酵液,加入菌源静态厌氧发酵24 h,检测各发酵阶段(0、4、8、12、24 h)短链脂肪酸、pH值、微生物指标等。
将菌源液按接种量10%分别加入空白组和实验组发酵液中。以含氮基础发酵液为空白组。由于目前没有成人食用OPO的相关标准,借鉴参照GB 14880—2012《食品安全国家标准 食品营养强化剂使用标准》[32],婴幼儿配方奶粉OPO添加量为24~96 g/kg的要求,选择上限96 g/kg、下限24 g/kg和中间值50 g/kg OPO含量为实验组梯度,分别在含氮基础发酵液中加入不同量OPO乳脂粉达到3 个OPO含量梯度,再结合冲泡奶粉时一般奶粉与水稀释比为4.5 g/30 mL,发酵液中折算成OPO质量浓度分别为0.36、0.75、1.44 g/100 mL。将空白组和各实验组分别分装在Hungate厌氧滚管,置于37 ℃厌氧培养箱培养发酵,所有实验进行3 次生物学重复。
1.3.3 pH值的测定
本研究采用pH计对发酵液进行pH值的测定。厌氧箱内把探头插入装有发酵液的厌氧滚管中,显示所测温度和pH值,读数每秒更新2 次,AUTO HOLD闪烁直到点亮,读数固定后记录,即为所测样液pH值,重复3 次。
1.3.4 短链脂肪酸的检测
1.3.4.1 气相色谱条件
HP-5毛细管柱(30 m×0.32 mm,0.25 μm);进样口温度200 ℃;氢火焰离子检测器,温度220 ℃;载气N2,流速1 mL/min,分流比40∶1;燃气H2,流速30 mL/min;助燃气空气,流速300 mL/min;隔垫扫吹为3 mL/min;进样体积1 μL;柱箱升温程序:初始温度30 ℃,保持3.5 min,以5 ℃/min升温至40 ℃,再以15 ℃/min升温至150 ℃。
1.3.4.2 标准曲线的制作
将6 种短链脂肪酸标准样品分别配制成不同浓度的标准溶液(10~60 mmol/L),气相色谱分析得到标准曲线。以3 倍的信噪比计算6 种短链脂肪酸的检出限。
1.3.4.3 样品前处理
从-80 ℃冰箱取出发酵液解冻,后转移至洁净离心管中,10 000 r/min离心20 min,除去其他微粒及菌体,取清液,以25%偏磷酸-清液9∶1比例加入25%偏磷酸,反应30 min,经0.22 μm膜过滤后测定。短链脂肪酸的检测在中国科学院亚热带农业生态研究所完成。
1.3.5 微生物检测计数
参考赵兰涛[33]和Palframan等[34]所用的计数方法,用10 倍梯度稀释法(稀释液为0.85%生理盐水),选取合适梯度稀释液100 μL均匀涂布于7 种选择性培养基上,从取样至涂布结束在2 h内完成。涂布后乳酸杆菌、肠杆菌和总需氧菌在37 ℃需氧培养24~48 h后分别计数,而总厌氧菌、拟杆菌、双歧杆菌和梭状芽孢杆菌在37 ℃厌氧培养48~96 h分别计数。
1.3.6 益生元指数计算
益生元指数是评价肠道菌群是否正常、平衡的一个重要指标,其中Palframan等[34]采用的计算方法为众多研究者所采纳。该指数用来衡量体外模型中低聚果糖益生元作用,由此避免因取样接种不均衡、初始菌数量和总菌数量不一致所导致的实验结果偏差。Palframan通过比较益生元指数的大小,定量描述各类低聚糖的益生元作用。本研究借鉴使用益生元指数,用以评价不同浓度OPO乳脂粉的益生作用。计算公式如下:
益生元指数=Bif/Total-Bac/Total+Lac/Total-Clos/Total
式中:Total表示取样时发酵液中总肠道菌数量和接种时发酵液中其数量的比值;Bif表示取样时发酵液中双歧杆菌数量和接种时发酵液中其数量的比值;Lac表示取样时发酵液中乳酸杆菌数量和接种时发酵液中其数量的比值;Bac表示取样时发酵液中拟杆菌数量和接种时发酵液中其数量的比值;Clos表示取样时发酵液中梭状芽孢杆菌数量和接种时发酵液中其数量的比值。
1.3.7 B/E(Bifidobacterium/Enterobacter)值的计算
在上个世界70年代,Van Der Waaij等[35]就将B/E值作为肠道菌群定植抗力的指标,反映肠道菌群结构,其为肠道内双歧杆菌和肠杆菌数量的比值。B/E>1表示肠道菌群中双歧杆菌的水平高于肠杆菌科的水平,可改善肠道菌群结构,有利肠道有益菌定植;B/E<1表示肠道菌群中双歧杆菌的水平低于肠杆菌科的水平,没有特殊的改善肠道菌群作用。
1.4 数据统计与分析
本研究实验均进行3 次生物学重复,结果数据采用Excel 2010进行统计,数据以 ±s表示;并运用SPSS 21.0软件的单因素分析方法(ANOVA)进行显著性分析;通过OriginPro 8.1软件完成数据折线图的绘制。
2 结果与分析
2.1 发酵过程中pH值的变化
pH值反映微生物生境酸碱度,肠道微生物通过代谢营养物质,产生有机酸、短链脂肪酸等代谢产物,会改变肠道生境的酸碱度,添加OPO乳脂粉发酵液pH值测定结果如表1所示。

表1 发酵液样品pH值Table 1 pH values of fermented liquid samples
由表1可知,实验组pH值都随着发酵时间的延长而降低,且添加量越高,其pH值下降幅度越大;空白组pH值也呈下降趋势,但通过24 h 的体外发酵总体下降仅0.2左右,下降幅度不大。所有实验组和空白组的起始pH值几乎一致,说明没有通过肠道微生物的发酵,只添加OPO乳脂粉不会引起生境pH值的改变。实验组pH值在发酵的前8 h阶段大幅度下降,而8 h以后,所有实验组的酸碱度下降幅度不大,趋于平稳。推测在分批培养的密闭厌氧发酵过程中,前8 h阶段,肠道微生物快速生长,积累大量有机酸、短链脂肪酸类代谢产物,导致发酵体系的pH值快速下降;而发酵后期营养物质开始缺乏,部分有机酸、短链脂肪酸作为能量或碳源不断被消耗,使发酵后期pH值下降幅度不大,此外发酵后期营养物质缺乏,微生物生长代谢缓慢也使发酵体系后期的pH值保持相对较低水平,变化波动不明显。因此,OPO乳脂粉能迅速降低肠道菌群生境中的pH值,促进肠道菌群生长,使其产生酸性物质,从而使体外发酵环境保持酸性。
2.2 发酵过程中短链脂肪酸的变化
以外标法定量,分析样品中乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸的含量。6 种酸都可以被色谱柱有效分离,标准品气相色谱图如图1所示,其保留时间分别为10.852、11.437、11.618、12.039、12.314 min和12.794 min,各短链脂肪酸区分清楚,该方法可以用于样品检测。

图1 标准样品气相色谱图Fig. 1 GC chromatograms of short-chain fatty acid standards
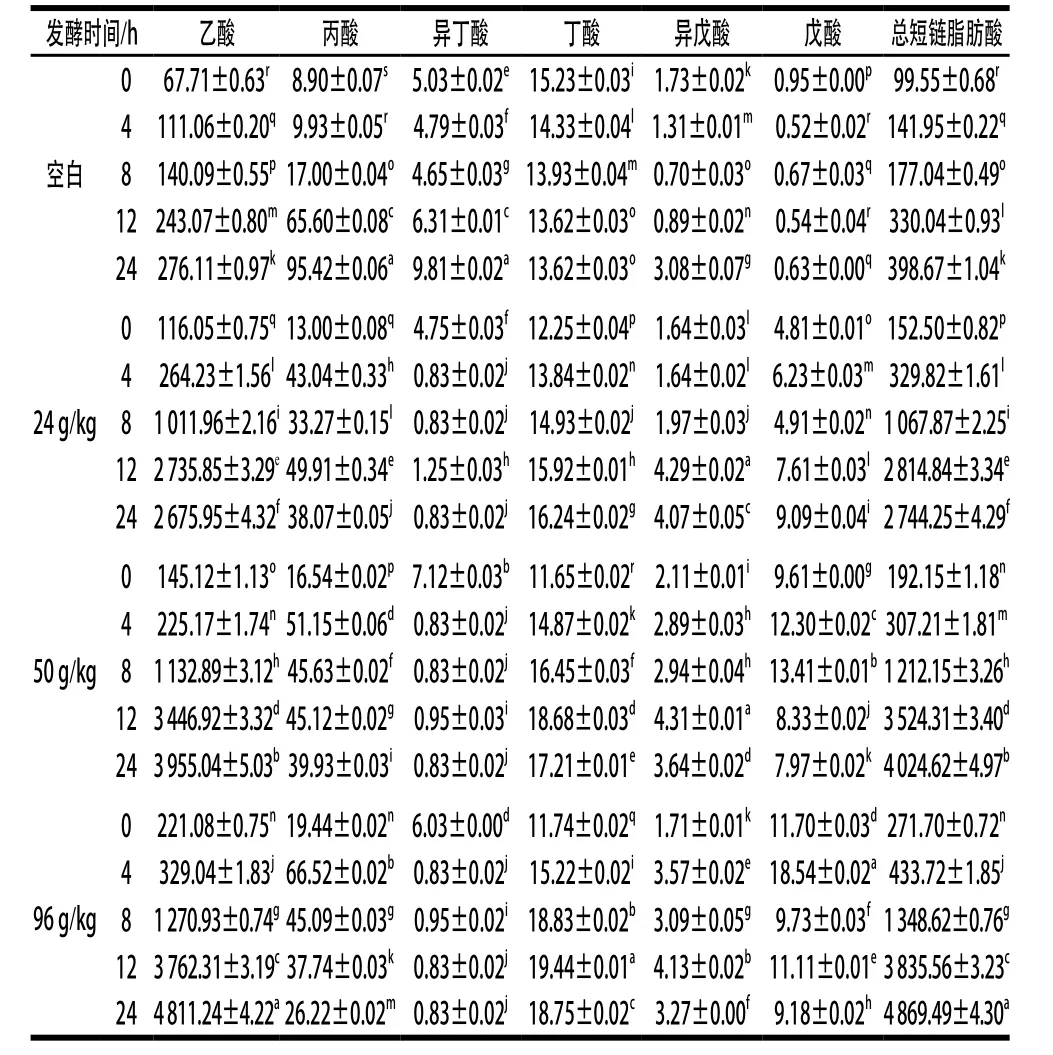
表2 各发酵体系不同发酵时间短链脂肪酸质量浓度Table 2 Concentrations of SCFAs produced at different time points of fermentation in the presence of different concentrations of OPO μg/mL
由表2可以看出,24 h体外发酵过程中总短链脂肪酸的含量都随时间的延长而持续增加。空白组的总短链脂肪酸增速平稳,增加幅度不大,初始含量从仅(99.55±0.68)μg/mL增长到(398.67±1.04)μg/mL。3 个实验组在发酵过程中总短链脂肪酸含量均呈大幅度增加,且OPO含量越大,增幅越大,在发酵体系中的含量越多。整个发酵过程的24 h内,96 g/kg组,总短链脂肪酸由初始(271.70±0.72)μg/mL增加到(4 869.49±4.30)μg/mL;50 g/kg组,总短链脂肪酸由初始(192.15±1.18)μg/mL增长到(4 024.62±4.97)μg/mL;24 g/kg组,总短链脂肪酸由初始(152.50±0.82)μg/mL增长到(2 744.25±4.29)μg/mL。由以上数据比较可以看出,OPO乳脂粉的添加,可以大幅度增加肠道微生物生境中总短链脂肪酸的含量,且短链脂肪酸含量与OPO含量呈正相关。
由表2可知,体外发酵过程中6 种短链脂肪酸,乙酸含量远远高于其他短链脂肪酸,其次是丙酸含量,之后是丁酸含量,还含有少量的戊酸,而异丁酸和异戊酸质量浓度最低均在10 μg/mL以下。由于乙酸是本研究中肠道微生物代谢产生的最主要的短链脂肪酸,其在体外发酵过程中的变化规律与总短链脂肪酸一致,OPO乳脂粉的添加可以大幅度增加肠道微生物生境中的乙酸含量,增加幅度与添加量呈正比。丙酸含量明显低于乙酸,但高于其他4 种短链脂肪酸。空白组随着发酵时间的延长,丙酸含量不断增加,发酵结束时的丙酸含量达到最高(95.42±0.06)μg/mL。实验组发酵结束时的丙酸质量浓度都只略大于初始质量浓度,但OPO的添加对丙酸含量的影响没有统一的变化规律,96 g/kg组和50 g/kg组在均在4 h阶段达到最大,随后下降,且96 g/kg组的下降幅度大于50 g/kg组;24 g/kg组呈曲折上升趋势,分别在0~4、8~12 h两个阶段呈上升趋势,在4~8、12~24 h两个阶段呈下降趋势。丁酸质量浓度在空白组发酵过程中变化很小,下降幅度不到2 μg/mL;实验组均呈整体上升趋势,即96 g/kg组和50 g/kg组先呈大幅度上升后略微下降,均在发酵12 h阶段达到最大值;24 g/kg组则在发酵全过程呈稳定上升趋势,上升幅度略小于另外两组,实验组中丁酸含量和上升幅度均与OPO含量呈正比。戊酸质量浓度空白组整个发酵过程都在1 μg/mL以下,含量极为微小;实验组没有明显的一致规律,24 g/kg组呈曲折上升趋势,上升幅度不大,由初始的(4.81±0.01)μg/mL上升到(9.09±0.04)μg/mL;96 g/kg组和50 g/kg组在发酵结束时的戊酸质量浓度都略低于初始质量浓度,均在0~8 h阶段呈上升趋势,12~24 h阶段明显下降。异丁酸含量占比很小,空白组呈上升趋势,实验组均在0~4 h阶段迅速降到1 μg/mL左右,之后变化不大。异戊酸含量占总短链脂肪酸含量的比例很小,空白组和实验组均较初始质量浓度有所增加。
综上所述,OPO乳脂粉体外发酵产生的短链脂肪酸以乙酸、丙酸和丁酸为主,且OPO乳脂粉的添加能显著提高发酵体系中总短链脂肪酸、乙酸和丁酸的含量。
2.3 体外发酵过程中微生物变化
2.3.1 体外发酵过程中微生物数量变化
根据益生元指数和B/E值的计算公式,采用传统选择性培养基,对涉及的肠道微生物进行培养计数,即体外发酵过程中的总厌氧菌、总需氧菌、双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌和梭状芽孢杆菌,它们的数量变化规律如图2所示。
由图2可知,空白组中,在体外发酵过程中双歧杆菌、乳酸杆菌、肠杆菌和梭状芽孢杆菌数量相当,都在107数量级上,而拟杆菌相对少了其他菌1 个数量级。添加OPO乳脂粉的实验组,双歧杆菌和乳酸菌成为发酵过程中最主要的优势菌,它们的数量在总菌数中占比相对较大。

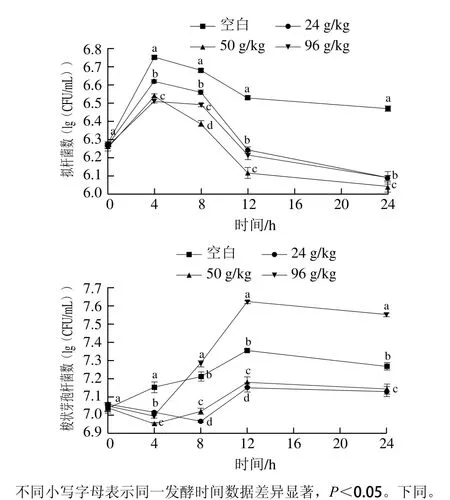
图2 体外发酵过程中肠道微生物数量变化Fig. 2 Variation in intestinal microflora quantities during in vitro fermentation
传统计数方法得出,实验组的总厌氧菌数和总需氧菌数都高于空白组,说明OPO乳脂粉的添加总体上促进了肠道微生物的生长繁殖。空白组和实验组的总厌氧菌在体外发酵过程中均呈上升趋势,其中OPO含量50 g/kg组上升幅度最大,菌数最多。空白组和实验组的总需氧菌均呈先上升后下降趋势,都在8 h阶段达到最大值,但空白组发酵结束时的菌数小于初始菌数,实验组的均高于初始菌数,最终以24 g/kg组的(8.19±0.07)(lg(CFU/mL))最大。空白组和实验组的双歧杆菌均呈先上升后下降趋势,都在8 h阶段达到最大值,且实验组均高于空白组,8 h阶段,96 g/kg组双歧杆菌数最多,达(8.88±0.01)(lg(CFU/mL));24 h结束时,50 g/kg组双歧杆菌数最多,达(7.94±0.00)(lg(CFU/mL))。乳酸杆菌,空白组呈持续下降趋势,而所有实验组均呈持续上升趋势,且50 g/kg组上升幅度最大,菌数最多,达到(8.09±0.03)(lg(CFU/mL))。肠杆菌,在空白组中呈明显持续上升趋势,而在所有实验组中呈现持续大幅度下降趋势,且实验组肠杆菌数远小于空白组。拟杆菌,所有实验组数量均少于空白组,实验组和空白组均呈先上升后下降趋势,均在发酵4 h阶段达到最大值,发酵结束时的菌数均少于初始菌数。梭状芽孢杆菌,空白组呈缓慢持续上升趋势,实验组均是先下降后上升,其中96 g/kg组上升幅度较大,其次为空白组,24 g/kg组和50 g/kg组低于空白组,说明这两个OPO添加量可以减缓梭状芽孢杆菌的增长速度,但96 g/kg组只在发酵前4 h表现出抑制作用。
综上所述,OPO乳脂粉的添加可以明显增加体外厌氧发酵体系中总厌氧菌、总需氧菌、双歧杆菌和乳酸杆菌的数量,大幅度减少肠杆菌的数量,还能在一定程度上减少拟杆菌和梭状芽孢杆菌的数量,调节了肠道菌群的结构。
2.3.2 益生元指数变化
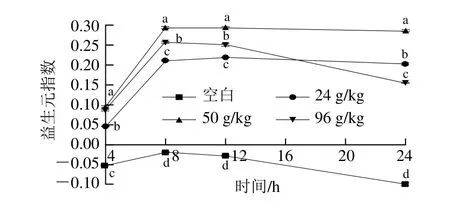
图3 体外发酵过程的益生元指数变化Fig. 3 Variation in PI during in vitro fermentation
以总厌氧菌和总需氧菌之和计算总菌数。将图2数据带入益生元指数计算公式,将计算结果作成直观的折线图,如图3所示。如图3所示,空白组和实验组的益生元指数都呈先上升后下降趋势,均在8 h阶段达到最大值。但空白组益生元指数在体外发酵过程的各个时间段均为负值,所有实验组的益生元指数在各个时间段均为正值,说明3 个不同含量OPO乳脂粉的添加,都在体外发酵系统中表现出益生作用,且益生元指数最高的一组为50 g/kg组,以此评判该组益生效果最好。这结果与微生物计数中双歧杆菌数和乳酸杆菌数的结果类似,它们与OPO乳脂粉的添加量不成严格的正比关系。
2.3.3 B/E值变化

表3 体外发酵过程的B/E值的变化Table 3 Variation in B/E ratio during in vitro fermentation
由表3可知,空白组的B/E值只有在发酵8 h阶段略大于1,双歧杆菌水平略高于肠杆菌水平,其他发酵时间均小于1,说明没有添加OPO乳脂粉的基础发酵液体系中双歧杆菌没能形成优势菌。由表3发现,所有实验组的B/E值在同一发酵时间均大于空白组,说明3 个添加量OPO乳脂粉均能够改善肠道菌群结构。同时,空白组在发酵8 h时B/E值最大,而实验组均在发酵12 h时达到最大,推测OPO乳脂粉的添加能够促进双歧杆菌对数生长期和稳定期的延长。在所有实验组中,只有0 h的B/E值小于1,其他发酵时间段均大于1,说明粪便样品作为菌源,双歧杆菌没有在菌源中占据优势地位,这与多数研究成人粪便的结果一致[22]。但随着OPO乳脂粉的添加,发酵时间的延续,双歧杆菌逐渐在实验组的发酵体系中积累增多,且在4~12 h阶段,B/E值与OPO含量呈正比,90 g/kg组的B/E值最大,显示出明显的改善肠道菌群的作用。随后,在发酵结束的24 h阶段,发现50 g/kg组的B/E值最大。
3 讨论与结论
通过体外厌氧发酵,本研究中肠道微生物所产的短链脂肪酸最主要是乙酸、丙酸和丁酸,蛋白分解所产的异丁酸、戊酸和异戊酸含量很少,这与众多国内外学者研究结果一致[36-37]。其中乙酸含量最多,它是多数细菌的主要代谢产物,本研究中所检测的拟杆菌、双歧杆菌、乳酸杆菌和梭状芽孢杆菌等碳水化合物代谢菌都产生乙酸,且本研究实验组中双歧杆菌是优势微生物,因此发酵液中乙酸含量相对最大,其主要在肌肉、心脏、肝脏和脑内代谢,其是胆固醇合成的最主要底物,大部分被吸收,进入血液或进入肝脏代谢,能作为周边组织的能源[38]。丙酸主要为拟杆菌等菌群的代谢产物,进入血液,吸收后在肝脏中分解代谢,参与丙酮酸逆转化葡萄糖的过程,同时可能抑制脂肪的合成过程。丁酸主要为厚壁菌门的代谢产物,被誉为最重要短链脂肪酸之一,血液中能够吸收,但主要被上皮细胞利用,是上皮细胞的主要能量来源,目前丁酸被充分证实的还有抗炎症、抗癌变效果,基于丁酸在维持肠道健康过程中所起的作用,甚至有研究者认为新型益生元的设计要寻找可以提高丁酸产量的营养物质。而本研究所添加的营养物质OPO乳脂粉,不仅能显著提高短链脂肪酸总量,还能提高大幅度提高乙酸和丁酸含量,OPO或OPO乳脂粉的营养功效可能与其代谢产物丁酸、乙酸的增加密切相关,同时这些代谢产物也可能对肠道微生物起到调节作用。
关于OPO、OPO乳脂粉与肠道微生物互作的研究相对较少,发现肠道微生物体外发酵OPO乳脂粉的结果与梁效[39]采用体外模式研究肉桂精油对大鼠肠道微生物影响的结果有一定相似性。两种不同的含有三甘酯的物质体外发酵,都对肠杆菌、拟杆菌的抑制作用明显,对梭状芽孢杆菌有一定的抑制作用,能使乳杆菌成为主要的优势菌群;但肉桂精油对双歧杆菌有一定的抑制作用,OPO乳脂粉则能促进双歧杆菌的生长,这可能与OPO乳脂粉中含有大量的乳糖有关。要进一步探明OPO的营养机制,后续还需要用OPO结构脂质的标准品与其他普通三甘酯进行对照研究。
短链脂肪酸含量与肠道微生物的数量结构密切相关,肠道微生物是维系人体内微生态系统的重要组成部分。研究发现,OPO乳脂粉的添加,大幅度促进双歧杆菌及乳杆菌等有益菌增长,迅速降低发酵液中的pH值,有效抑制肠杆菌、拟杆菌的增长,明显增加了益生元指数和B/E值,在肠道微生物的调控中,所添加的OPO乳脂粉发挥了积极作用。但通过益生元指数和双歧杆菌、乳酸杆菌的增长情况,发现国标范围内,中剂量的50 g/kg组益生效率更高。但由于传统培养方法本身的局限,粪便中还存在大量未被培养的肠道微生物,且传统培养计数操作繁琐,工作量大,培养效率和精准性都有待提高,同时,OPO乳脂粉对肠道微生物多样性的影响作用无法体现,后续还可进一步通过MiSeq平台进行高通量测序来探究OPO、OPO乳脂粉对肠道微生物的影响。
——埃西浦太太——奥尔德斯·赫胥黎的《脂粉》主人公性格分析

