桃肉质及粘离核性状形成及其相关基因的表达分析
韩 晴,曹 珂,朱更瑞,方伟超,陈昌文,王新卫,刘扩展,游双红,王力荣
(1.中国农业科学院 郑州果树研究所,河南 郑州 450009;2.重庆市农业科学院,重庆 401329)
桃(PrunuspersicaL. Batsch)是深受大众喜爱的大宗果品之一,尤以溶质型鲜食品种为主。桃果肉的质地可分为溶质、不溶质、硬质3种类型[1-2]。此外,根据桃果肉(中果皮)与核(内果皮)的粘连程度又可以将桃分为离核和粘核2种类型[3]。研究发现,桃果实成熟过程中,果肉质地变化(主要是硬度下降)的主要原因是相关水解酶降解细胞壁多糖和蛋白质导致细胞壁结构的改变[4]。在该过程中,涉及一系列的酶和调控因子,其中多聚半乳糖醛酸酶(Polygalacturonase,PG)起到关键作用[5]。在溶质型桃果实中,PG活性及其基因PpPG的表达量均随着果实的软化而增加[6-7],但在不溶质桃中则维持在较低水平[8]。桃果实的溶质及粘离核性状受到2个串联重复的PpPG基因控制,该基因座位于4号染色体[9-10]。
乙烯是植物五大激素之一,它在植物的种子萌发、叶片衰老、脱落到果实成熟等生长发育过程中都起着重要的调节作用[11]。桃果实的成熟软化尤其是PG基因的表达即受到乙烯诱导,因此,溶质型桃果实成熟过程中存在一个呼吸跃变[12-13],测量其乙烯释放量是鉴定溶质型和硬质型肉质的一种方法[14]。乙烯的生物合成则受2个关键酶ACS(ACC合成酶)和ACO(ACC氧化酶)的调控[15]。在硬质型桃中,PpACS1基因的表达始终处于较低的水平,而溶质型果实中PpACS1基因的表达随着果实的成熟表达量迅速上升[16]。研究者发现,乙烯的合成与生长素密切相关[17]。硬质型桃不软化的原因是其在成熟期IAA的合成受阻导致PpACS1转录受到抑制,乙烯不能正常释放所致[18-19]。PpYUC11是调控桃果实成熟期 IAA合成的关键候选基因,导致了硬质型和其他肉质类型桃果实成熟期乙烯释放的差异[14]。
08-9-106和08-9-107是中国农业科学院郑州果树研究所桃资源课题组通过杂交发现的2个优系,表现为果肉质地较硬、挂树期长。本研究以溶质型桃大久保为对照,分析08-9-106和08-9-107桃果实成熟过程中果实硬度、中果皮和近核处果肉内源乙烯及相关基因的表达变化,为探讨桃果实成熟软化进程的分子调控机制奠定理论基础。
1 材料和方法
1.1 试材
以国家果树种质资源郑州桃圃的大久保、08-9-106、08-9-107为试验材料。3份种质的桃果实发育时期基本一致,约为108 d,在郑州地区7月中旬成熟。从果实第2次膨大期(约果实成熟前20 d)之后开始取样,采样时间分别为花后92 d(7月1日)、98 d(7月7日)、103 d(7月12日)和108 d(7月17日)。每次采摘10个大小和成熟度一致果实为试材,一部分样品用于测定果实硬度,另一部分样品进行果肉取样,分别取中果皮和近核处果肉(靠近内果皮0.5 cm),迅速用液氮冷冻,-80 ℃保存提取RNA备用。
在花后不同时期,采集果实单层放置于敞口保鲜盒内,密封,室温25 ℃,相对湿度70%。每次取12个大小和成熟度一致、果形端正的果实削去外果皮,取中果皮和近核处果肉为试材用于乙烯的测定。
1.2 硬度测定
果实硬度测定采用浙江托普仪器有限公司生产的水果硬度计(GY-4-J),每次选取3个果实,削去果实缝合线两侧中部果皮测定果实的去皮硬度,每个样品重复3次。取平均值作为每个样品的去皮硬度,单位kg/cm2。
1.3 中果皮和近核处果肉乙烯释放速率的测定
取4~6个桃果实的中果皮果肉置于密闭容器中,室温密封2 h后抽取上层气体测定乙烯含量,每个处理重复2次,每个重复测3次。以单位鲜质量的果肉在单位时间内释放的乙烯量表示中果皮果肉的乙烯释放速率,单位为nL/(g·h)。乙烯释放量的测定采用岛津(日本)GC-2010型气相色谱仪。气相色谱工作条件为:色谱柱:Rtx-1701(30 m×0.25 mm),柱温为50 ℃,载气为氮气(N2),检测器(FID)温度200 ℃;进样口温度200 ℃;氢气流速40 mL/min,空气流量400 mL/min,压力100 kPa,尾吹气流30 mL/min;柱流量3.0 mL/min,进样体积500 μL,分流比20。
近核处果肉乙烯释放速率的测定:取近核处的宽0.5 cm、厚0.5 cm、长3.0 cm大小的果肉,放入10 mL带橡胶盖的玻璃瓶中,密封室温放置0.5 h,抽取0.5 mL气体,用于乙烯含量检测,每处理重复2次,其他步骤同中果皮的测定方法。
1.4 相关基因实时荧光定量表达分析
桃中果皮和近核处果肉的RNA提取采用多糖多酚植物RNA提取试剂盒(华越洋,北京)的方法进行,提取的RNA经琼脂糖凝胶电泳检测其完整性,采用NANODROP 1000 核酸蛋白仪(美国)检测其浓度。RNA的反转录采用东洋纺反转录试剂盒(TOYOBO,东京),操作均按各试剂盒的使用说明书进行,cDNA于-20 ℃保存备用。
根据桃已登录序列采用NCBI中的Blast-primer程序分别设计Actin、PpACS1、PpACO1、PpYUC11、PpPG5个基因的特异引物序列(表1),引物由金唯智(苏州)生物科技有限公司合成。
荧光定量PCR反应在LightCycler 480Ⅱ型实时荧光定量PCR仪中进行,采用SYBR GreenⅠMaster 试剂盒(Roche,瑞士)进行扩增,反应总体积10 μL,包含100 ng cDNA 1 μL,2×Lightcycler 480 SYBR Green I Master 5 μL,1.0 μmol/L上下游引物各0.25 μL和无RNAase水3.5 μL。反应程序为:预变性95 ℃,5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共45个循环。每个样品重复3次。试验结果用2-ΔΔCT公式分析计算[20],以内参基因Actin的表达量为标准计算目的基因的表达量。

表1 RT-PCR所用引物Tab.1 Sequences of the primers used for RT-PCR
1.5 数据分析与作图
采用Excel进行数据分析并作图。
2 结果与分析
2.1 果实肉质及粘离核性状表型评价
2.1.1 果实成熟后期中果皮果肉硬度的变化 由图1-A可知,大久保桃果肉的硬度在成熟过程中迅速下降,硬度由花后92 d的11.53 kg/cm2下降至花后108 d的0.75 kg/cm2,下降幅度达到94%,果实软化迅速;08-9-106果实硬度的下降趋势与大久保类似,由花后92 d的11.44 kg/cm2下降至花后108 d的1.31 kg/cm2,下降幅度为89%;08-9-107在果实成熟过程中硬度下降幅度小,由花后92 d的11.97 kg/cm2下降至花后108 d的9.73 kg/cm2。
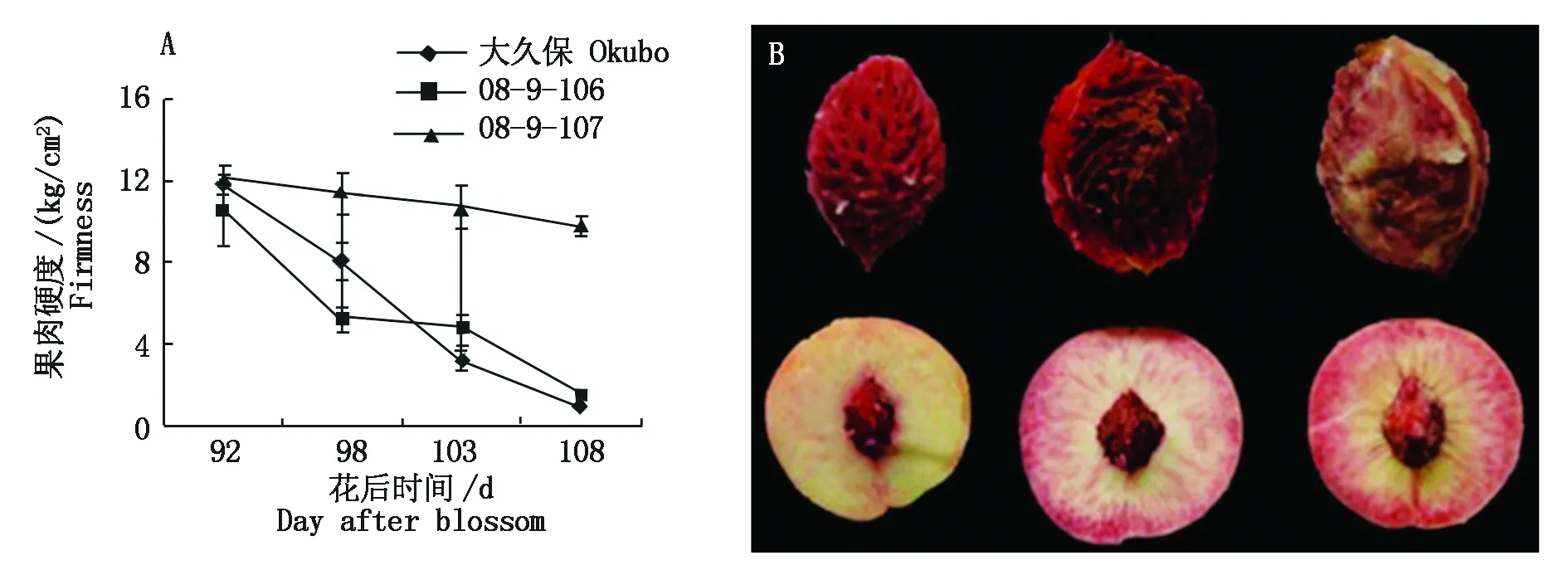
图1-B中从左到右依次为大久保、08-9-106和08-9-107。The accession in Fig.1-B from left to right was Okubo,08-9-106 and 08-9-107,respectively.
2.1.2 果实成熟后期果核外观 由图1-B的直接观察可知,大久保和08-9-106的桃果肉与果核分离,属于离核类型;08-9-107的桃果肉与果核粘连,属于粘核类型。结合3份种质果实成熟期的果肉硬度和果实横切面观察,判定大久保和08-9-106属于离核溶质类型,08-9-107属于粘核硬质(或不溶质)类型。
2.2 相关基因表达分析验证中果皮果肉硬度变化及粘离核性状的形成
桃果实质地的软化以及粘离核性状的形成主要是果肉组织细胞壁的结构降解和成分改变造成的,涉及多种细胞壁降解酶和调控因子。为进一步从分子水平验证3份桃种质果肉硬度下降的原因,分析了桃果实成熟后期中果皮和近核处果肉PpPG基因的表达。
由于PpPG基因座存在2个高度相似的基因Ppa006839m和Ppa006857m,二者CDS序列仅存在5个SNP差异,因此本研究中设计了兼并引物,对这对PpPG基因进行了表达分析。由图2-A可知,在中果皮果肉中,桃大久保和08-9-106的PpPG基因表达较高,但峰值出现的时间存在差异,大久保为花后98~103 d,而08-9-106为花后103 d。在果实成熟后期,桃08-9-107的中果皮果肉中PpPG基因的表达始终维持在较低的水平。由图2-B可知,在近核果肉处,桃大久保和08-9-106的PpPG基因表达规律与其在中果皮果肉类似;而桃08-9-107近核果肉处的PpPG基因表达量依然较低。分析基因表达与表型的关系,证实PG基因的表达是导致3份种质中果皮硬度变化和粘离核性状形成的主要原因。
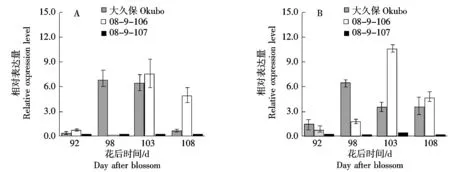
图2 果实成熟过程中中果皮(A)和近核处果肉(B)PpPG基因的表达Fig.2 Expression of PpPG gene in mesocarp (A) and flesh near endocarp (B) during peach fruit ripening
2.3 乙烯释放对中果皮果肉硬度和粘离核性状的影响
PG基因的表达受到乙烯的诱导[14],为了分析3份桃种质果肉硬度变化及粘离性状差异的原因,测定了桃果实成熟后期中果皮和近核处果肉的乙烯释放速率(图3)。由图3-A可知,桃08-9-107中果皮果肉的乙烯释放量在花后92~108 d维持在较低水平,乙烯释放速率在0.54~7.22 nL/(g·h)变化。在2个溶质桃类型中,大久保中果皮果肉在花后92~103 d缓慢释放乙烯,之后乙烯释放速率增大,到花后108 d乙烯释放速率达到42.26 nL/(g·h),是花后92 d的15.31倍;而另外一个溶质桃08-9-106的中果皮果肉乙烯释放速率却维持在极低的水平,花后92~108 d在0.26~2.20 nL/(g·h)波动。该结果暗示,桃08-9-106中果皮果肉PG基因的表达变化和硬度的下降与其乙烯释放无关。
由图3-B可知,大久保近核处果肉花后92~108 d的乙烯释放与中果皮类似,均在果实成熟期有明显释放,与其离核性状是一致的。同期,桃08-9-106和08-9-107近核处果肉的乙烯释放速率较低。鉴于后2份种质分别为离核和粘核,因此,乙烯释放可能同样不是08-9-106近核处果肉PG基因表达变化和离核的原因。
综上,将大久保归为响应乙烯的离核溶质类型,08-9-107为响应乙烯的粘核硬质类型,而08-9-106则为不响应乙烯的离核溶质类型。
2.4 相关基因表达分析验证果实乙烯释放速率的变化
2.4.1 不同桃种质中果皮和近核处果肉中PpACS1基因的表达 为了探究08-9-106桃果实成熟后期乙烯合成较低的原因,分析了乙烯生物合成的关键基因ACS的表达,结果表明,PpACS1在桃大久保的花后92~98 d的中果皮和近核处果肉中均有较高表达,接近成熟表达量快速下降(图4),基因表达峰值位于乙烯释放峰值之前;而桃08-9-106和08-9-107在果实成熟后期的中果皮和近核处果肉中PpACS1表达量极低(图4),与其无明显乙烯释放一致(图3)。
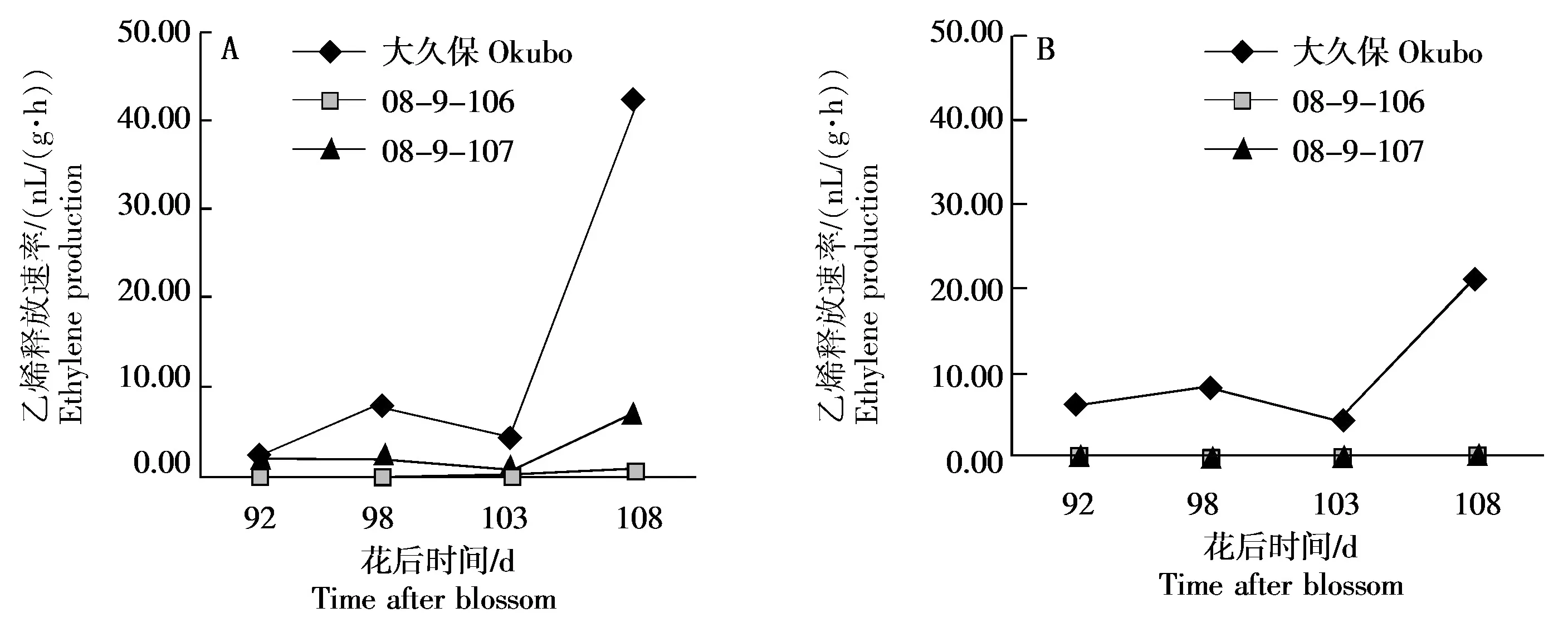
图3 桃果实成熟过程中中果皮(A)和近核处果肉(B)乙烯释放速率的变化Fig.3 Changes in ethylene production in mesocarp (A) and flesh near endocarp (B) during peach fruit ripening
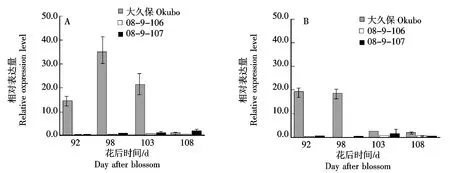
图4 桃果实成熟过程中中果皮(A)和近核处果肉(B)PpACS1基因的表达Fig.4 Expression of PpACS1 gene in mesocarp (A) and flesh near endocarp (B)during peach fruit ripening
2.4.2 不同桃种质中果皮和近核处果肉中PpACO1基因的表达 ACO是调控乙烯生物合成的另外一个关键酶[21]。由图5可知,基因PpACO1在桃大久保和08-9-106的花后103 d有表达峰值。然而,桃08-9-107在花后92~108 d同样有一定程度的表达,整体维持在恒定的水平,且在大部分时期表达量高于大久保。在近核处果肉中,桃08-9-107的PpACO1基因表达在花后92~108 d持续升高,而同期桃大久保和08-9-106则表达量较低。结合3份桃种质中果皮和近核处果肉乙烯的释放可知,PpACO1基因的表达与乙烯的合成关系的相关性不强。
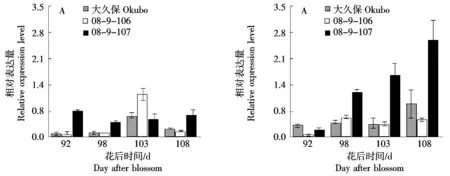
图5 桃果实成熟过程中中果皮(A)和近核处果肉(B)PpACO1基因的表达Fig.5 Expression of PpACO1 gene in mesocarp (A) and flesh near endocarp (B)during peach fruit ripening
2.4.3 不同桃种质中果皮和近核处果肉中PpYUC11基因的表达PpYUC11是生长素合成的关键基因,在桃中通过调控生长素的合成影响乙烯的释放。由图6-A可以看出,在桃大久保中果皮中检测到高表达的PpYUC11基因,而该基因在另外2份种质08-9-106和08-9-107中果皮表达量较低。而在近核处果肉中,PpYUC11基因在3份种质中的表达均随着果实成熟而增加,整体表现为大久保峰值最高,08-9-107上升速率较快,而08-9-106峰值出现最晚。综上所述,在中果皮果肉中,PpYUC11基因的表达与乙烯释放速率一致;而在近核处果肉中,PpYUC11基因的表达与乙烯合成无明显相关。
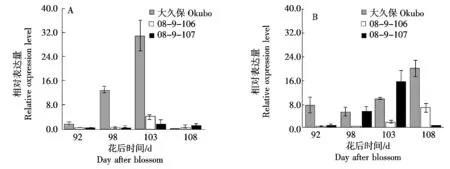
图6 桃果实成熟过程中中果皮(A)和近核处果肉(B)PpYUC11基因的表达Fig.6 Expression of PpYUC11 gene in mesocarp (A) and flesh near endocarp (B) during peach fruit ripening
3 结论与讨论
溶质型桃果实属于典型的呼吸跃变型,成熟过程中伴随着内源乙烯的显著增长,果肉硬度快速下降[22]。本研究分析了3份桃种质果实成熟后期中果皮果肉硬度变化和粘离核性状的形成,发现08-9-106中果皮果肉硬度在成熟后期迅速下降,这与其PpPG基因的高表达是一致的,因此将其归为溶质桃。然而,对乙烯释放速率和乙烯合成相关基因的表达变化分析结果表明,PpPG基因不受乙烯的诱导,因此该种质应属于不响应乙烯的溶质型桃,这与前人的结果存在较大差异[23],有待后续研究。
PpACS1和PpACO1是桃乙烯合成的关键酶,而PpACS1是乙烯合成的关键限速酶,其表达对桃果实成熟过程中硬度的变化发挥着重要的调控作用。本研究发现,在桃大久保中果皮果肉中,PpACS1的表达量较高,且峰值出现在乙烯大量释放之前,与前人研究结果[16]一致。然而,其PpACO1基因的表达量却低于08-9-106,即该基因并不是本研究3份种质乙烯合成的关键基因。过去报道硬质桃在成熟时乙烯释放量非常低,PpACS1不表达而PpACO1有较高表达量[24-25],与本试验结果一致。说明PpACS1是控制乙烯合成的主效基因[26]。
近年来的研究表明,PpYUC11基因可以通过调控生长素合成影响乙烯的释放[7],如Tatsuki等[24]研究发现,硬质桃果实乙烯生物合成受阻的主要原因是PpACS1基因转录受抑制。进一步分析表明[27-28],成熟期PpYUC11的不表达导致了IAA合成受阻,影响乙烯不能正常释放。在本研究中,同样发现溶质桃中果皮PpYUC11基因表达较高,与乙烯释放速率相关。为此,本研究同时分析了其在近核处果肉中的表达变化,试图揭示其与粘离核性状形成的关系。然而发现在果实接近成熟期,乙烯释放有显著差异的大久保和08-9-107的PpYUC11基因表达却存在明显差异,因此,本研究认为桃果实粘离核性状的形成与乙烯释放速率和PpACS1的表达有关,与PpACO1和PpYUC11无关。

