萱草属植物短缩茎组织培养及植株再生
王荣梅,褚焕宁,王金耀,李森,亢秀萍*
(1.山西农业大学 园艺学院,山西 太谷 030801;2.山西省设施园艺工程技术中心,山西 太谷 030801;3.山西省设施蔬菜提质增效协同创新中心,山西 太谷 030801)
萱草属(Hemerocallisspp.)植物是百合科(Liliaceae)多年生宿根草本植物,兼有食用、观赏和药用价值。近年来,随着育种工作的开展,育种和园林工作者不断培育出多种花色、花型、株高及不同花期的萱草品种。截至2018年7月24日,美国萱草协会(American Hemerocallis Society,AHS)已登录的萱草品种达87 714个[1]。
在生产中,萱草属植物的种苗繁殖主要是通过分株繁殖的方法,其繁殖系数小,繁殖速度较慢,限制了新优品种的大规模推广与应用。同时,经过多代营养繁殖后,造成不同程度品种种性褪化,严重影响观赏性状、产量及品质。为解决萱草属植物繁殖系数低及品种种性褪化的问题,解有利等[2]、杨丽莉等[3]和李淑英等[4]人先后将植物组织培养技术应用到萱草属植物的生产繁殖。
国外学者Meyer早在20世纪70年代最先进行了萱草属植物的组织培养研究,国内起步稍晚,1985年报道了杨乃博[5]关于杂种大花萱草花葶、花蕾的组织培养研究。周朴华和何立珍等[6]用不同外植体进行诱导,发现花柄的愈伤组织诱导率相对较高。解有利等[2]以大花萱草叶片为外植体进行诱导,发现叶片愈伤组织诱导需要100 d以上。前期课题组成员褚焕宁[7]以未受精子房,花葶,等为外植体进行诱导,均可诱导出组培苗,但取材受花期限制。基于上述研究,萱草属植物以叶片为外植体,形成愈伤组织时间较长,对基因型依赖性强;以花器官为外植体,受取材时期影响较大。不同外植体各有优势与不足,短缩茎取材不受时期限制,且诱导不定芽时间较短,对基因型依赖不强,但报道鲜少。
‘大同黄花’因其适应性强、营养价值高,是山西地区种植面积较广的萱草品种,也是黄花菜食用干菜主要食材来源。本研究以‘大同黄花’为主要研究对象,从短缩茎的取材时期、不定芽诱导、不定芽增殖等方面开展了研究,并选择另外14份萱草属植物进行体系验证,以期加速萱草属植物种苗的繁殖效率和质量,为开发适合萱草属植物短缩茎组培快繁体系提供理论基础。
1 材料与方法
1.1 材料
课题组于2012—2016年广泛收集萱草种质资源并定植于山西太谷(112°53’E,37°42’N)萱草种质资源圃,选择15份具有代表性的种质材料用于试验。其中,以‘大同黄花’为主要试材,研究不同采样时期、不同激素配比等对萱草属植物不定芽诱导、不定芽增殖、生根等组培效果的影响。另外,选择‘六月花’、‘血秋红’、‘四月白’、‘长嘴子花’、‘宿迁1号’、‘茄子1号’、‘野生萱草’、‘东庄黄花’、‘壶关黄花’、‘小葡萄紫’、‘淮安2号’、‘宿迁3号’、‘宿迁6号’和‘长嘴子花1号’等14份材料用于不定芽诱导组培体系验证。
1.2 ‘大同黄花’不定芽的诱导
将‘大同黄花’试验材料在流水下冲洗15 min,洗净表面泥沙,于超净工作台下,无菌水冲洗2次+75%乙醇30 s+0.1%升汞7 min+无菌水冲洗3次,进行消毒处理。将‘大同黄花’短缩茎(图1 A)用刀切掉两端部分,留取短缩茎纵切为0.5 cm×0.5 cm的外植体小块,将外植体接种于培养基中,采用竖直(生物学下端垂直平放培养基)方式进行接种,试验采取L9(32)正交设计,6-BA (1.0 mg·L-1,2.0 mg·L-1,3.0 mg·L-1),NAA (0.05 mg·L-1,0.1 mg·L-1,0.2 mg·L-1)2种激素,每瓶接种3块,重复3次。

图1 ‘大同黄花’外植体Fig.1 Explants of Datong Huanghua注:A:外植体取材部位-短缩茎;B:短缩茎横切面Note:A:Explants taken from the dwarf stem;B:Cross section of dwarf stem
1.3 不同时期取样对‘大同黄花’不定芽的诱导
以‘大同黄花’短缩茎为组培主要试验材料,在其萌芽期(2~3月下旬),展叶期(4月上旬~5月下旬),抽薹期(6月上旬~6月中旬),萌蕾开花期(6月下旬~7月中旬),采后枯叶期(7月下旬~9月中旬),秋季展叶期(9月下旬~初霜期),休眠期(霜后到翌年1月)7个时期进行采样,进行短缩茎不定芽诱导试验,不定芽诱导试验方法同不定芽的诱导。
1.4 ‘大同黄花’增殖培养
将‘大同黄花’诱导出的不定芽切割分离为单株,接种于增殖培养基中,进行增殖培养(图2),培养基配比为MS+2 mg·L-16-BA+0.5 mg·L-1NAA+30 g·L-1蔗糖。

图2 ‘大同黄花’增殖培养Fig.2 Proliferation culture of Datong Huanghua
1.5 ‘大同黄花’生根培养与炼苗移栽
本试验选取2种(A&B)不同培养基配方进行生根培养(图3),将不同生长阶段(植株高度0~3 cm,3~5 cm,5 cm以上)‘大同黄花’植株接种于不同培养基,A培养基:MS+0.25 mg·L-1NAA+30 g·L-1蔗糖,B培养基:MS+2 mg·L-1NAA+0.5 mg·L-16-BA+30 g·L-1蔗糖。每个处理接种10瓶,每瓶3株。20 d后统计观察生根情况。
将生根30 d后的‘大同黄花’组培苗打开瓶盖,在培养室放置3 d。将植株从培养基中取出,去除苗根部的培养基,用0.1%的多菌灵清洗根部,种植于灭菌后基质中,基质配比草炭∶珍珠岩∶蛭石为3∶1∶1。种植后将取基质浇透,放置在温室阴凉处,进行常规管理。10 d后统计移栽成活率及苗生长状况。

图3 ‘大同黄花’生根培养Fig.3 Rooting culture of Datong Huanghua
1.6 萱草属植物短缩茎不定芽诱导
将14份萱草属植物材料‘六月花’、‘血秋红’、‘四月白’、‘长嘴子花’、‘宿迁1号’、‘茄子1号’、‘野生萱草’、‘东庄黄花’、‘壶关黄花’、‘小葡萄紫’、‘淮安2号’、‘宿迁3号’、‘宿迁6号’和‘长嘴子花1号’短缩茎接种于不定芽诱导培养基中MS+1 mg·L-16-BA+0.1 mg·L-1NAA,每份材料接种3瓶,每瓶3块0.5 cm×0.5 cm的外植体小块,观察不定芽诱导情况。
1.7 培养条件
将培养瓶置于2 500 lx,25 ℃恒温组培室中,每天光照16 h。接种培养后每3 d,统计试验数据并记录分析。
1.8 数据处理
采用SAS (Release 8.01 TS Level 01M0.)、WPS表格(10.1.0.7469)进行数据处理分析。
2 结果与分析
2.1 诱导‘大同黄花’不定芽最适培养基为MS+1 mg·L-1 6-BA+0.1 mg·L-1 NAA
将‘大同黄花’短缩茎接种于添加不同激素浓度配比的MS培养基后,外植体切口处逐渐膨大变绿,15 d后诱导出不定芽,萱草属植物短缩茎较易诱导不定芽(图4),10种处理条件下均能诱导出不定芽,但不同处理间存在显著性差异(表1),Q2、Q3诱导率最高,达88.89%,Q2不定芽增殖系数最高,达6.67。综合各处理‘大同黄花’不定芽诱导率及生长情况得出,诱导‘大同黄花’不定芽最适培养基为MS+1 mg·L-16-BA+0.1 mg·L-1NAA。

图4 ‘大同黄花’外植体诱导不定芽Fig.4 Explants induce adventitious buds of Datong Huanghua
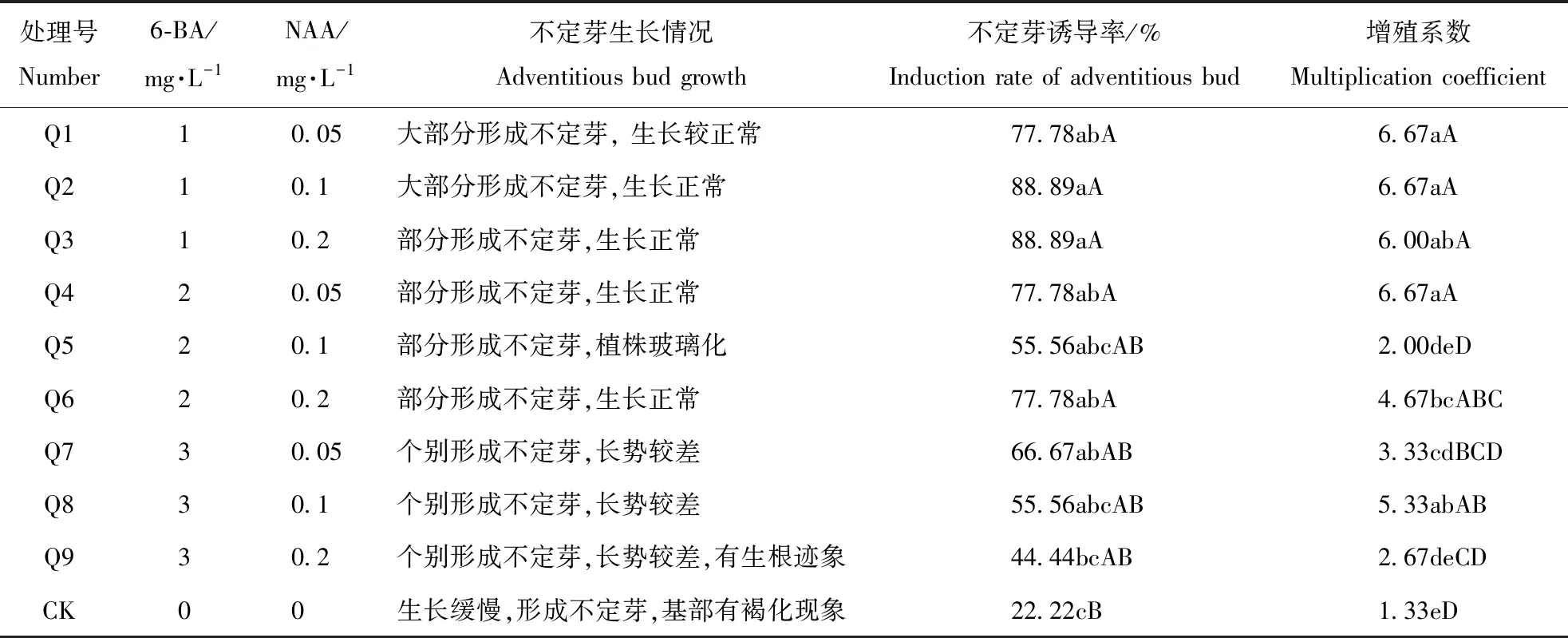
表1 不同激素浓度配比对‘大同黄花’不定芽诱导效果的影响Table 1 Effect of different hormone concentration ratios on the induction of adventitious buds of Datong Huanghua
注:数据为平均值,同列数字旁不同大写字母表示有极显著差异(P<0.01),小写字母表示有显著差异(P<0.05)
Note:The data is the average value.The uppercase letters next to the same column indicate that there is a significant difference (P<0.01),and the lowercase letters indicate significant difference (P<0.05)
2.2 ‘大同黄花’萌芽期繁殖系数极显著高于萌蕾开花期,采后枯叶期
将‘大同黄花’短缩茎接种于不定芽诱导培养基中,及时观察生长情况统计不定芽诱导率。萌芽期污染率0%,不定芽繁殖系数6.67,最高。采后枯叶期污染率80%,不定芽繁殖系数2.00,最低。采样时期不同,不定芽最高繁殖系数存在显著性差异,萌芽期的繁殖系数极显著高于萌蕾开花期,采后枯叶期。展叶期的繁殖系数显著高于萌蕾开花期,采后枯叶期。植株采样时期不同,最佳培养基有差异(表2)。

表2 不同取样时期对‘大同黄花’不定芽诱导效果的影响Table 2 Effect of different sampling periods on the induction of adventitious buds of Datong Huanghua
注:数据为平均值,同列数字旁不同大写字母表示有极显著差异(P<0.01),小写字母表示有显著差异(P<0.05)。
Note:The data is the average value.The uppercase letters next to the same column indicate that there is a sig.
2.3 ‘大同黄花’不定芽在MS+0.25 mg·L-1NAA+30 g·L-1蔗糖培养基上长势最好
将‘大同黄花’不同生长阶段(植株高度0~3 cm,3~5 cm,5 cm以上)不定芽接种于不同生根诱导培养基(A&B)(图5),接种15 d后开始生根,不同生长阶段不定芽生根数量,植株长势不同。接种在A培养基上,植株随着根生长而快速长高,不定芽(3~5 cm)植株长势最为良好,生根数最多(4.33根/株)。接种在B培养基上植株随着根的生长慢慢变黄萎蔫,长势较差(表3)。
长势良好的‘大同黄花’组培苗生根30 d后打开瓶盖,在培养室放置3 d。移栽于温室炼苗,成活率100%。

图5 植株生根情况Fig.5 Plant rooting注:A:植株高度(0~3 cm)生根情况;B:植株高度(3~5 cm)生根情况;C:植株高度(5 cm以上)生根情况。Note:A:Plant height (0~3 cm)rooting;B:Plant height (3~5 cm)rooting;C:Root height of plant height (5 cm or more).
2.4 12份萱草属材料诱导出不定芽,‘壶关黄花’、‘小葡萄紫’未诱导出不定芽
本研究选取‘六月花’、‘血秋红’、‘四月白’、‘长嘴子花’、‘宿迁1号’、‘茄子1号’、‘野生萱草’、‘东庄黄花’、‘壶关黄花’、‘小葡萄紫’、‘淮安2号’、‘宿迁3号’、‘宿迁6号’和‘长嘴子花1号’共14份萱草属植物材料的短缩茎接种于不定芽诱导培养基MS+1 mg·L-16-BA+0.1 mg·L-1NAA中,其中12份材料诱导出不定芽,‘壶关黄花’和‘小葡萄紫’未诱导出不定芽。

表3 ‘大同黄花’不同生长阶段不定芽接种于不同生根培养基生根情况Table 3 Different root growth conditions of adventitious buds in different growth stages of Datong Huanghua
注:长势程度分:良好(叶片挺拔,叶色深绿,长势旺盛),一般(叶片卷曲,叶色浅绿,长势较弱),较差(叶片萎蔫,叶片发黄,长势很弱)。
Note:The degree of growth is good:the leaves are tall and straight,the leaves are dark green,and the growth is strong;generally (the leaves are curled,the leaves are light green,the growth is weak);the poor (the leaves are wilting,the leaves are yellow,the growth is very weak).
3 讨论与结论
在组织培养过程中,外植体的类型、选取部位、取样时期、激素的浓度配比都影响着试验结果。外植体不同,所建立的再生体系不会完全重复[8]。以芽、腋芽、块茎等为外植体,不经过愈伤组织阶段,直接分化成器官直接获得再生植株[9]。萱草属植物组织培养常用的外植体有叶片、花葶、子房、花瓣、种子、根状茎、茎尖等。王凤翱等[10]以幼叶、花葶、花梗、花丝等为外植体进行诱导,研究发现均能产生愈伤组织,但花葶、花梗诱导效果相对较好。范银燕和崔根芳[11]发现花葶较新叶诱导率高。周朴华和何立珍[6]试验结果显示花柄的愈伤组织诱导率相对较高。花柄的出愈率虽然较叶片、花茎高,但是其遗传稳定性较差,因此在实际应用中不宜选用其作为组培外植体。刘小英等[12]以花器官为外植体,较易诱导愈伤组织,但受采样时期限制;以叶片为外植体进行诱导,增殖系数较高,但需要叶片幼嫩,且对基因型依赖较强。不同外植体各有优势与不足,在实际应用中应根据需要及条件选择合适外植体进行诱导。
本试验研究发现,以短缩茎作为外植体,可实现周年采样进行组培快繁,采样时期不受限制。萌芽期取材,诱导率最高,污染率最低,可能由于植株在生长季酶活性较强,酚类物质较多,故诱导效果最好。采后枯叶期植株酶活性较弱,土壤含菌量较多,污染率较高。合适的时期取材,选取合适的植株部位进行诱导,可实现最为理想的组培效果。
短缩茎接种于添加不同激素浓度配比的MS培养基后,外植体切口处逐渐膨大变绿,15 d后诱导出不定芽。张伟丽和金欣庆[13](2007)以花托为外植体,培养40 d后由芽点逐渐变成芽丛。彭广霖等[14]接种花梗斜切片,7周左右观察到愈伤组织中开始形成丛生芽。解有利等[2]研究表明,以叶片为外植体,愈伤组织形成时间最长,达100 d以上。以短缩茎为外植体诱导不定芽,诱导时间短,基因型依赖性弱,较易诱导不定芽。
植物组织培养中常以生长素和细胞分裂素这两类激素按一定比例混合使用。在萱草属植物组织培养时,大部分研究者在愈伤组织诱导和分化过程,主要是6-BA和NAA按一定比例结合使用,且6-BA和NAA浓度分别在1.0~4.0 mg·L-1和0.1~0.5 mg·L-1范围较适宜。6-BA浓度过高,不定芽增殖过程中,外植体会出现不同程度的玻璃化现象[15]。根诱导过程中以0.1~0.6 mg·L-1范围内的NAA为宜,生根效果随着浓度升高而变好,超出这个范围,则会降低生根效果。对于不同植物不同外植体,关键在于调节培养基中细胞分裂素和生长素浓度配比,不同激素浓度配比影响外植体成苗的发生形式。以萱草属植物短缩茎为外植体,添加不同浓度的植物生长激素,较易诱导不定芽,但不同基因型间诱导效果不同。

