响应面法优化黄芪三种活性成分的闪式提取工艺
王梦茹,雷振宏,梁华,李文倩,张莹,梁建萍*,赵建平,柴智
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西振东道地药材开发有限公司,山西 长治 047100;3.山西中医药大学 黄芪资源产业化及产业国际化协同创新中心,山西 晋中 030619)
黄芪是豆科植物蒙古黄芪[Astragalusmembranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao]或膜荚黄芪[Astragalusmembranaceus(Fisch)Bge.]的干燥根,为历代中医常用的药材,素有“十药八芪”之称,具有扶正补气之功效。近年来,国内外学者对黄芪的化学组成、药理活性进行了较为广泛的研究和临床试验,表明黄芪含有多种化学成分,其中多糖、皂苷、黄酮是主要活性成分,能增强机体的免疫力,有抑制肿瘤、降血糖、抗菌抗病毒、延缓衰老等功效[1~4]。除药用外,黄芪也可作保健食品、饮料、化妆品等原料[4],2018年国家卫生健康委员会将黄芪正式列入了药食同源中药材目录,这极大地拓宽了黄芪的消费市场,使黄芪在功能食品的开发研究中呈现广阔的前景。
黄芪药效成分研究和应用的关键问题是如何提高提取率和生物利用率,因而研究有效成分的提取分离及优化工艺显得格外重要。目前,黄芪药效成分的提取常采用浸提法、煎煮法、回流提取法、超声提取法、索氏提取法、高速离心法、微波提取法、闪式提取法、超滤法[5,6]等,其中闪式提取作为一种新式提取方法,具有省时、成本低、效率高等优点,在中药材成分提取中占有重要地位[7~9]。黄芪闪式提取工艺的优化常采用单因素[10]、正交试验[11],而单因素和响应面法相结合优化提取工艺报道罕见。响应面法是近年来国际上新发展的一种优化试验设计和数学建模的理论方法,广泛应用于化工、农业、制药、环境和机械工程等领域,具有试验次数少、试验周期短、精密度高、求得回归方程精度高、预测性能好等优点[12]。本研究以乙醇提取浓度、料液比、提取时间及电压为设计因素,分别确定其最优值范围,采用Box-Behnken (BBD)响应面优化设计方法获得多糖、皂苷、黄酮最佳提取工艺条件,旨在为充分利用黄芪功效成分,开发、利用、挖掘黄芪资源潜力,促进黄芪产业的健康发展提供技术支撑。
1 材料与方法
1.1 仪器与药品
试验仪器:JH881-3精密烘箱,HC-200型华晨高速多功能粉碎机,WZS-20小型振动筛(标准筛),BS223S型电子天平,JHBE-50T闪氏提取器,Neofuge 15R高速冷冻离心机,IKA RV10数显型旋转蒸发仪,SHZ-Dm循环水式多用真空泵,恒温水浴锅,SLM-F140AY65-PC雪花制冰机,UV1900PC双光束紫外可见分光光度计;
试验药品:无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、苯酚、浓硫酸、乙酸乙酯、正丁醇、香草醛,以上药品均为分析纯;芦丁标准品(批号:804D023),D(+)-无水葡萄糖标准品(批号:1122A026),黄芪甲苷标准品(批号:912A023),以上标准品均购自北京索莱宝科技有限公司(纯度≥98%)。
1.2 试验材料
试验用2年生黄芪材料,经山西农业大学梁建萍教授鉴定为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao.的干燥根,采自山西省静乐县安子梁乡中药材种植基地,于2017年10月20日黄芪地上干枯后采集黄芪完整根部,洗净、吸干水分,105 ℃杀青,65 ℃烘至恒重,粉碎并过60目筛,分装至密封袋中,标记后保存于干燥阴凉处备用。
1.3 黄芪三种活性成分的提取
采用闪式提取法提取黄酮[13]、多糖[10]、皂苷[14],具体步骤如下:
准确称取1 g黄芪粉末溶于一定量的乙醇溶液,设置提取电压、时间于闪式提取器上提取。将提取好的溶液于4 ℃ 5 000 r·min-1离心15 min,得上清液。
将上清液浓缩至2 mL,加30%乙醇定容至10 mL得黄酮待测液;
上清液浓缩至5 mL,加4倍的无水乙醇过夜醇沉,离心沉淀为多糖粗品,经烘干后用蒸馏水定容至100 mL得多糖待测液;
上清液浓缩至2 mL,水饱和乙酸乙酯萃取3次得水层,再用水饱和正丁醇萃取3次得正丁醇层,然后浓缩至5 mL加无水乙醇定容至10 mL得皂苷待测液。
1.4 黄芪三种活性成分的测定
黄酮含量的测定采用硝酸铝-亚硝酸钠法[15]。称取10 mg芦丁标准品,30%的乙醇定容至50 mL,得到0.2 mg·mL-1的芦丁标准溶液;以芦丁质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,回归方程:y=7.7186 x-0.0088 (R2=0.998 7)。
多糖含量的测定采用苯酚-硫酸法[16]。称取10 mg葡萄糖标准品,蒸馏水定容至100 mL,得到0.1 mg·mL-1葡萄糖标准液;以多糖质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,得回归方程:y=77.846 x + 0.002 5 (R2=0.996 7)。
皂苷含量的测定采用香草酫-硫酸法[17]。称取10 mg甲苷标准品,无水乙醇定容至50 mL,得到0.2 mg·mL-1甲苷标准溶液;以甲苷质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,得回归方程:y=14.073 x + 0.007 1 (R2=0.992 2)。
1.5 单因素试验
1.5.1 乙醇浓度筛选
设定闪式提取器电压为120 V,提取时间为90 s,料液比为1∶20,试验研究不同乙醇浓度70%、75%、80%、85%、90%对黄酮提取率的影响;水及乙醇浓度2.5%、5%、7.5%、10%对多糖提取率的影响;乙醇浓度60%、65%、70%、75%、80%对皂苷提取率的影响。
1.5.2 料液比的筛选
设定提取黄酮、多糖、皂苷的乙醇浓度分别为80%、5%、75%,提取电压为120 V,提取时间为90 s,测定1∶15、1∶20、1∶25、1∶30、1∶35料液下黄酮、多糖、皂苷的提取率。
1.5.3 提取电压的筛选
设定提取黄酮、多糖、皂苷的乙醇浓度分别为80%、5%、75%,料液比为1∶20,提取时间为90 s,分别测定电压为100 V、110 V、120 V、130 V、140 V下黄酮、皂苷的提取率,110 V、115 V、120 V、125 V、130 V电压下多糖的提取率。
1.5.4 提取时间的筛选
设定提取黄酮醇浓度80%、时间110 V、料液比1∶20,测定时间为45 s、60 s、75 s、90 s、105 s时的黄酮提取率;设定提取多糖醇浓度5%、时间120 V、料液比1∶20,测定时间为60 s、75 s、90 s、105 s、120 s时的多糖提取率;设定提取皂苷醇浓度75%、时间120 V、料液比1∶20,测定时间为60 s、75 s、90 s、105 s、120 s时的皂苷提取率。
1.6 响应面优化试验
基于上述单因素试验,利用 Design-Expert 软件,依据响应面 Box-Behnken 设计原理,采用4因素(料液比、乙醇浓度、提取时间、提取电压)3水平(用-1、0、1表示)设计方法,对黄芪黄酮、多糖、皂苷三种活性成分提取工艺进行优化,具体如表1所示。

表1 响应面试验分析因素与水平Table 1 Response Surface Test Analysis Factors and Levels
2 结果与分析
2.1 不同提取条件对黄芪药效成分提取的影响
由图1可知,随着乙醇浓度的升高,黄酮提取率呈先上升后下降的趋势,乙醇浓度为80%时达到峰值(0.554%),浓度选取范围为75%~85%;多糖提取率呈先下降后上升再下降的趋势,浓度为5%时达到峰值(0.712%),浓度选取范围是2.5%~7.5%;皂苷提取率呈先上升后下降趋势,浓度为75%时达到峰值(0.903%),浓度选取范围是70%~80%。三种药效成分选取的乙醇浓度范围不同,这可能与其溶解率有关,在适宜的范围内,随着乙醇浓度的增大溶解率升高,目的产物得以释放,超过这个范围则下降。
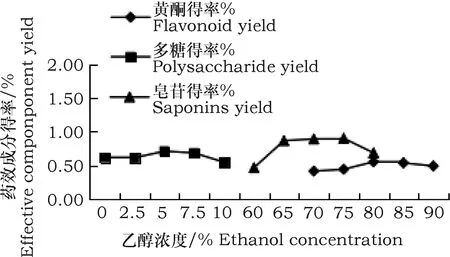
图1 乙醇浓度对黄芪三种活性成分提取率的影响Fig.1 Effect of ethanol concentration on extraction rate of active components 0f Astragalus membranaceus
图2显示,随着料液比的增大,黄酮提取率呈快速上升后下降再缓慢上升再下降的趋势,料液比为1∶20时达到峰值(0.523%),料液比的选取范围为1∶15~1∶25;多糖、皂苷提取率均呈先上升后下降的趋势,提取率分别在1∶20、1∶25处达到峰值(0.794%、0.888%),料液比的选取范围分别是1∶15~1∶25、1∶20~1∶30。以上结果表明在适宜的料液比范围内,随着料液比的增加,有效成分与溶剂的接触面积加大,在一定程度上加快了溶解效率,以至提取率升高;超过这一范围提取率下降,这可能是由于溶剂体积过大导致物料与刀头剪切几率下降,有效成分不能充分释放所致。

图2 料液比对黄芪三种活性成分提取率的影响Fig.2 Effect of solid-liquid ratio on extraction rate of main active components 0f Astragalus membranaceus
由图3可知,随着电压的增强,黄酮、皂苷提取率均呈先上升后下降的趋势,提取率分别在电压为110 V、120 V时达到峰值(0.547%、0.897%),选取的电压范围分别是100~120 V、110~130 V;多糖提取率呈先上升后下降再上升的变化趋势,在电压为120 V时达到峰值(0.672%),选取的电压范围是115~125 V。结果表明当电压最小时,药效成分的提取率均处于最低值,随着电压的增大,提取率上升,说明适宜的剪切力有助于溶质的扩散、溶出,超过这个范围则下降,这可能是电压增大导致剪切速度加快、料液温度升高,药效成分的结构遭到破坏,或者加速了其它非目的产物的溶出,溶液达到动态平衡,影响了目的产物的完全释放,以致提取率降低。

图3 提取电压对黄芪主要活性成分提取率的影响Fig.3 Effect of extraction voltage on extraction rate of main active components 0f Astragalus membranaceus
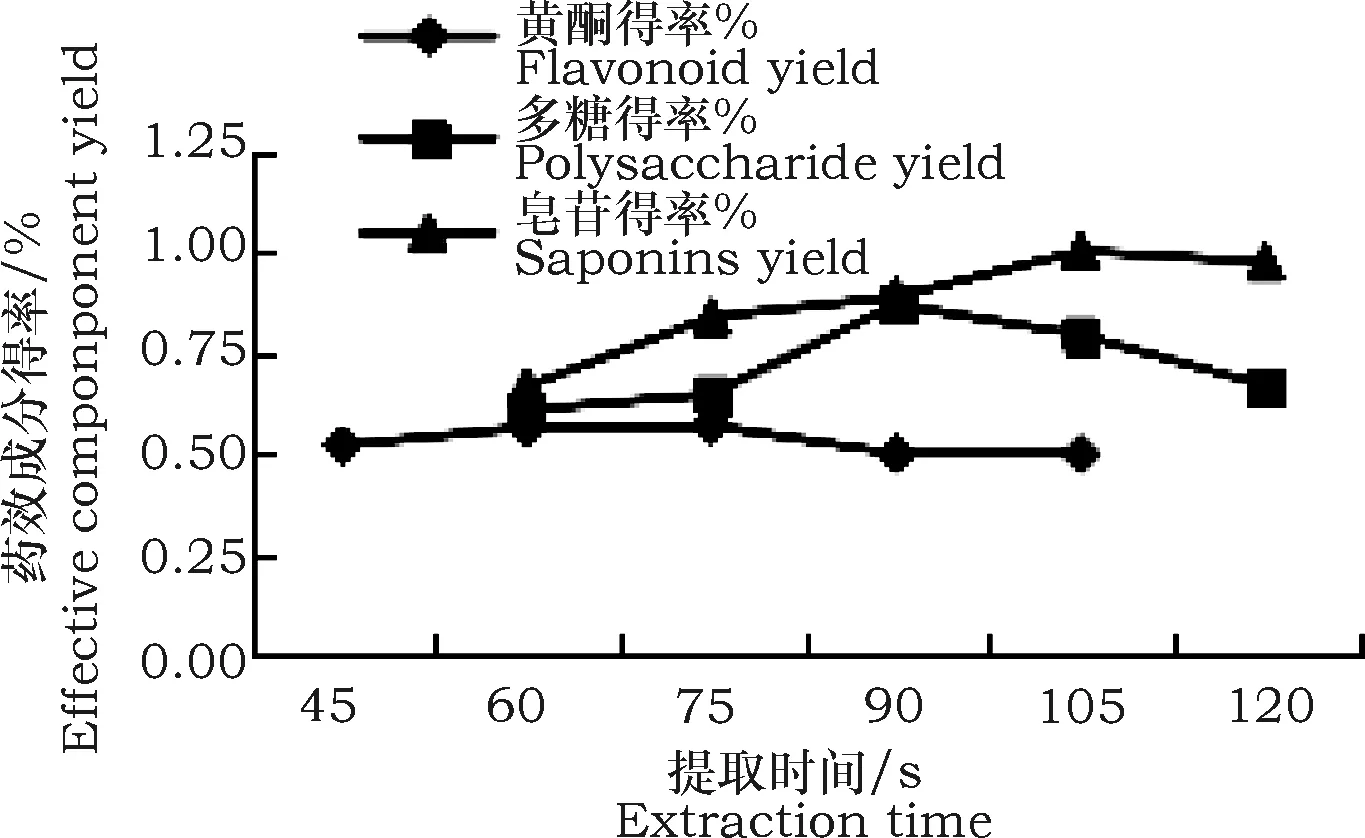
图4 提取时间对黄芪主要活性成分提取率的影响Fig.4 Effect of extraction time on extraction rate of main active components 0f Astragalus membranaceus
图4表明,随着提取时间的延长,黄酮、多糖、皂苷提取率均呈先上升后下降的变化趋势,提取率分别在时间为75 s、90 s、105 s时达到峰值(0.570%、0.869%、1.001%),选取的时间范围分别是60~90 s、75~105 s、90~120 s。继续延长时间,导致料液温度升高,一方面可能使药效成分结构遭到破坏,另一方面加速了乙醇溶液的挥发,进而导致提取率的下降。
2.2 响应面回归模型的建立
响应面试验设计及结果见表1、表2,由表2可知,响应面设计中四因素三水平的基础数据是24组,零点重复试验是5组,其中零点重复试验结果也可反映单因素试验优化结果,即黄酮、多糖、皂苷的平均得率为0.519%、0.668%、0.610%。采用Design-Expert 8.0.6软件,以表2中黄酮得率(Y1)、多糖得率(Y2)、皂苷提取率(Y3)对因素料液比(A)、乙醇浓度(B)、提取时间(C)、提取电压(D)进行回归分析,模拟回归方程如下:
Y1=0.52+0.026×A+0.039×B-0.018×C+0.015×D+1.500E-003×A×B+1.750E-003×A×C+9.750E-003 ×A×D-0.029×B×C+0.025×B×D-9.750E-003×C×D-4.125E-003×A2+0.019×B2-8.250Ev003×C2-0.022×D2
Y2=0.67+0.012×A-0.091×B+0.024×C+0.021×D+0.11×A×B-0.019×A×C-6.000 E-003×A× D+0.055×B×C+0.062×B×D-0.048×C×D+0.058×A2+0.028×B2-0.015×C2-1.208E-003×D2

表2 响应面试验设计及结果Table 2 The design and results of response surface test
Y3=0.61+0.092×A-0.081×B+0.031×C-0.038×D-0.14×A×B+0.067×A×C-0.089×A×D-3.750E-003×B×C+0.039×B×D-0.026×C×D-0.057× A2+0.057×B2+2.550E-003×C2-0.049×D2方差分析表明(表3),各因素对黄酮提取率的影响为B>A>C>D,对多糖提取率的影响为B>C>D>A,对皂苷提取率的影响为A>B>D>C。为了进一步直观反映各因素对成分提取的影响,根据回归模型绘制了试验因素交互作用的三维立体响应曲面(图5、6、7)。由图5可知,黄酮得率随着醇浓度、料液比的升高而增加,醇浓度、料液比对黄酮得率的影响分别达极显著、显著水平,各因素间具有交互作用但对黄酮得率的影响不显著。由图6可知,醇浓度对多糖得率的影响达到极显著水平,醇浓度与料液比、提取时间、提取电压之间的交互作用达到极显著,而提取时间、提取电压、料液比之间的交互作用不明显。图7显示,醇浓度、料液比对皂苷得率的影响极显著,提取电压对皂苷得率的影响显著;料液比与醇浓度、提取电压之间的交互作用极显著。料液比与提取时间交互作用显著,醇浓度与提取时间、提取电压,提取时间与提取电压的交互作用均不显著。综合以上,响应面分析结果与方差分析结果一致。
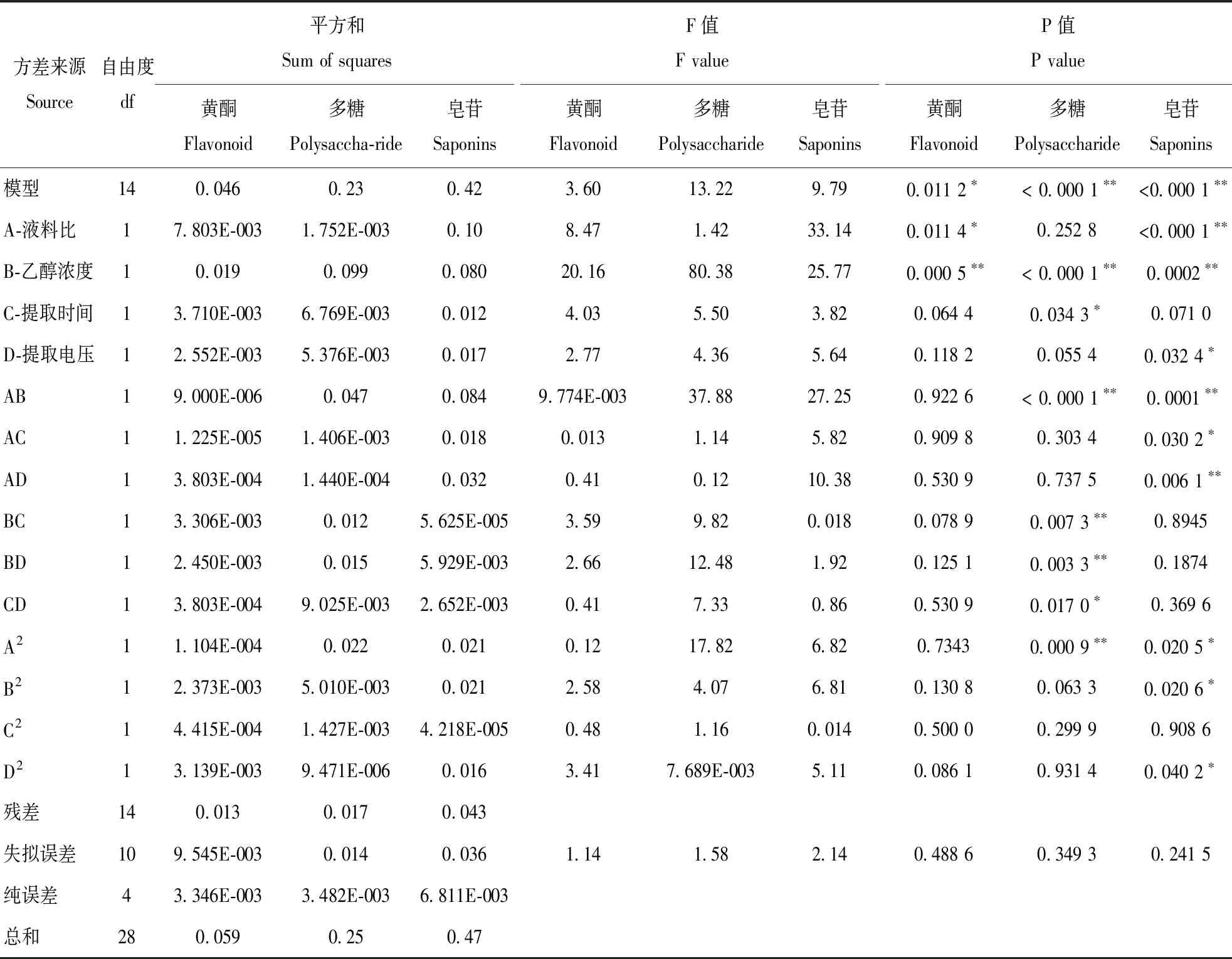
表3 闪式提取工艺回归模型方差分析Table 3 Variance analysis of flavonoids extraction process by regression model
注:*表示差异在p=0.05水平上显著,**表示差异在p=0.01水平上显著。
Note:*show that the difference is significant at p=0.05 level,**show that the difference is extremely significant at p=0.01 level.
三个模型的P值均小于0.05,表明建立的响应面模型达到显著水平;失拟误差项的P值均大于0.05,说明实验误差小,能充分反映实际情况,可对黄酮、多糖、皂苷提取工艺进行分析、预测。
2.3 响应面优化工艺的确定及验证
运用 Design-Expert 8.0.6 软件分析获得黄芪3种药效成分最佳提取工艺如下:黄酮为85%乙醇、料液比1∶25、电压119.99 V、时间60 s,多糖为2.5%乙醇、料液比1∶15、电压115 V、时间105 s,皂苷为70%乙醇、料液比1∶30、电压110.21 V、时间120 s,此时黄酮、多糖、皂苷提取率的预测值分别是0.673%、0.994%、1.174%。
为方便实际操作,对上述优化工艺加以修正,具体如下:黄酮为85%乙醇、料液比1∶25、电压120 V、时间60 s,多糖为2.5%乙醇、料液比1∶15、电压115 V、时间105 s,皂苷为70%乙醇、料液比1∶30、电压110 V、时间120 s。根据修正后的工艺进行验证实验,黄酮、多糖、皂苷的提取率分别是0.663%、0.965%、1.126%,与预测值分别相差0.01%、0.029%、0.048%,理论与实际较吻合,优化工艺可靠。

图5 各因素交互影响黄芪黄酮得率的三维响应面图Fig.5 Three-dimensional response surface diagram showed the interactive effects of different factors on the yield of flavonoids from Astragalus membranaceus
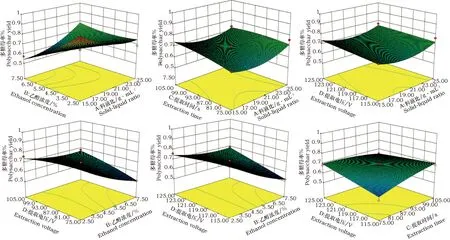
图6 各因素交互影响黄芪多糖得率的三维响应面图Fig.6 Three-dimensional response surface diagram showed the interactive effects of different factors on the yield of polysaccharides from Astragalus membranaceus
3 讨论与结论
黄芪是中医临床上常用的中药之一,药理活性广泛,具有多种功效,而黄酮、皂苷、多糖是发挥其疗效的主要活性成分。近年,随着黄芪现代药理学的研究、活性成分靶向治疗疾病的临床验证、以及药食同源功能食品的开发,黄芪主要活性成分的提取、分离、纯化技术越来越得到业界的关注。目前,一些新型现代技术的出现,弥补了传统提取技术能耗高、周期长、得率低、成本高、高温破坏热敏性成分[18]等缺陷,大大提高了中药材活性成分的提取效果和质量。超声波提取在室温下操作,安全、收率高,微波提取快速、便捷,超临界萃取技术室温操作,不破坏成分结构,但这些技术存在成本高、有效成分受高温影响、提取范围受限等缺点。而闪式提取技术吸取了上述各种方法的优点,克服其不足,可在室温下操作,不破坏热敏性成分,具有快速、安全、节能、环保、高效[11]等优点,为中药有效成分的提取开辟了新的途径。
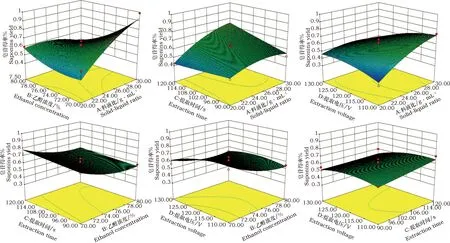
图7 各因素交互影响黄芪皂苷得率的三维响应面图Fig.7 Three-dimensional response surface diagram showed the interactive effects of different factors on the yield of saponins from Astragalus membranaceus
本研究采用闪式提取法提取黄芪中黄酮、皂苷、多糖3种活性成分,根据单因素试验确定了乙醇浓度、料液比、提取时间、提取电压的取值区域及最优取值点,在此基础上采用BBD 响应面优化设计方案,利用 Design-Expert 软件对各成分提取工艺进行优化。试验表明,采用单因素与响应面相结合优化提取工艺,黄酮、多糖、皂苷提取率与单因素优化结果相比分别高出0.144%、0.297%、0.516%,这可能是因为在黄芪三种活性成分的提取过程中各因素间具有一定的交互作用,因此只采用单因素优化提取工艺实验精确度低,而响应面通过分析各因素连续取值的整个区域,得到整个区域上因素的最佳组合和响应最优值,试验精度高。在四种提取因素中,醇浓度对4种成分得率的影响最明显,都达到极显著水平,且提取浓度各不相同,这可能与不同成分在乙醇中的溶解性有关,黄酮、皂苷易溶于乙醇,因而提取浓度较高,分别为85%、70%,这与肖卫华[19]、林晓[20]的研究结果相近;而多糖在高浓度的乙醇中会形成沉淀即醇沉,但低浓度的乙醇提取比水提效果要好[10,21],本试验也得到了证实。料液比对皂苷、多糖的影响达显著水平,对黄酮的影响不明显。提取时间和提取电压对成分得率的影响最小。
本试验采用二阶模型拟合了黄酮、多糖、皂苷三种成分提取率对各提取条件的回归方程,并对其进行了方差分析,绘制了三维立体响应曲面,结果表明三个模型的P值均小于0.05,失拟项Pr值均大于 0.05,说明三个模型在整个回归区域内拟合精度好[12]。进一步对各模型进行了工艺优化和验证,证实3个模型较好地拟合了实际情况。
综上所述,本研究应用响应面法对闪式提取黄芪中黄酮、皂苷、多糖的工艺研究和参数优化,不仅科学合理,而且快速有效,可为黄芪有效成分的综合利用、新药研发提供技术支撑,也将推动黄芪产业发展和现代化进程。

