Krupple样因子6及诱导型一氧化氮合酶在铜绿假单胞菌上清液感染RAW264.7凋亡过程中的表达
刘梦茹,王雅琪,张 伟,姚富荣,苍 林, 柴文戍
(1. 锦州医科大学附属第一医院呼吸内科,辽宁 锦州 121000;2. 青岛大学附属医院检验科,山东 青岛 266000;3.锦州医科大学,辽宁 锦州 121001)
铜绿假单胞菌(pseudomonas aeruginosa,PA)是院内感染最常见的一种革兰阴性机会致病菌,易感人群主要为肺囊性纤维化[1]、慢性阻塞性肺疾病[2]、肿瘤[3]、获得性免疫缺陷症等免疫力低下的患者。近年来,PA已经成为医院感染高患病率和致死率最常见的致病因子之一,且耐药率呈逐年上升的趋势。本实验选取PA作为研究对象,意图探明其对免疫细胞的作用机制,从而为治疗其感染寻找新的靶点。
来自于单核细胞的巨噬细胞是被招募到炎症部位的主要先天免疫细胞。在机体发生感染导致局部炎症产生后,这些被招募到炎症部位的巨噬细胞在炎症的发生、扩散和消退过程中起着关键作用,巨噬细胞增殖能力降低,减弱了巨噬细胞吞噬病原体的能力,造成持续感染,损伤肺组织[4]。巨噬细胞的增殖与凋亡在感染过程中发挥着重要的作用,因此,探讨PA上清液对巨噬细胞增殖抑制、凋亡的影响是控制PA感染机体的关键。
Krupple样因子6(Krupple-like factor 6,KLF6)是Kruppel样C2H2锌指转录因子家族的成员,参与多种细胞增殖、凋亡等过程[5]。KLF6在炎症反应的基因表达调控中发挥重要作用,有报道表明,KLF6与诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)之间是有作用联系的。iNOS通常不在细胞中表达,在巨噬细胞中,通常是由一些病原体或者细胞因子刺激,诱导iNOS合成并产生一氧化氮(NO),破坏细胞稳定,发挥细胞毒性作用,促进细胞凋亡,也可导致周围组织损伤[6-7]。我们前期研究发现,PA可诱导肺组织细胞中KLF6的表达,并可能通过调控iNOS,介导肺组织细胞凋亡[8]。本实验以小鼠单核巨噬细胞白血病细胞RAW264.7为研究对象,探讨PA上清液对RAW264.7凋亡的影响,同时检测KLF6及iNOS在此过程中的表达情况。
1 材料
1.1 细胞株与菌株RAW264.7细胞,北部战区总医院心血管病研究所赠予。PA为标准菌株ATCC27853,来自锦州医科大学微生物实验室。
1.2 试剂DMEM培养基(Gibco);胎牛血清(PAN);Annexin V-FITC/PI试剂盒(上海翊圣生物科技有限公司);MTT、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒(北京索莱宝科技有限公司); Hoechst 33342染色液(万类生物科技有限公司)。
1.3 仪器流式细胞仪、成像仪(美国BD Biosciences公司);半干转仪(美国Bio-Rad公司);高速冷冻离心机(德国Thermo Fisher公司)。
2 方法
2.1 细胞培养与传代RAW264.7细胞在含10%胎牛血清的DMEM中,5% CO2、37 ℃条件下进行培养,每1~2 d半量更换培养基。细胞生长至80%融合时,按1 ∶5传代培养。
2.2 菌株、细菌培养及细菌上清液的制备将细菌株复苏后,取血琼脂平板上单个PA菌落,接种于8 mL的大豆肉汤培养基中,通过振颤法(37 ℃,8 h)对PA进行增菌,获取OD600=1的浓度的菌液,然后1 600×g离心15 min,获得上清液,用孔径0.22 μm的滤膜过滤,最后灭活(56 ℃、1 h),储存在-20 ℃备用。
2.3 MTT检测RAW264.7细胞增殖将RAW264.7细胞按照13 000个/孔接种到96孔板中,培养过夜。24 h后,分为阴性对照组(只加细胞)、PA上清感染组(体积比为0.15、0.3、0.45的PA上清液与培养基的混合液),每组6个复孔,置于37 ℃、5% CO2细胞培养箱培养,分别培养6、12、24 h后,每孔加入20 μL MTT染色液,在细胞培养箱内继续孵育4 h。吸弃上清,每孔加入150 μL DMSO,酶标仪在560 nm测定每孔的吸光度值,实验重复3次。细胞增殖抑制率=(1-实验组OD值/阴性对照组OD值)×100%。
2.4 Hoechst 33342染色RAW264.7细胞以1.8×105个/孔接种于12孔板中,置37 ℃、5% CO2细胞培养箱培养24 h后,分别加入体积比为0.15、0.30、0.45的PA上清液与培养基的混合液,以24 h为检测点,吸尽培养液,加入300 μL固定液固定15 min,PBS洗5 min,加入300 μL Hoechst 33342染液,室温孵育15 min,PBS洗涤3遍,每次5 min。随后在Cytation3细胞成像多功能检测仪20×微米级分辨率,观察凋亡细胞核形态。
2.5 Annexin V-FITC/PI双染流式细胞仪检测RAW 264.7细胞凋亡取对数生长期细胞,按2×105个/孔接种于6孔板,置37 ℃、5% CO2培养过夜,按浓度梯度加入PA上清液,对照组为正常培养的细胞,24 h为检测点。离心收集细胞,用预冷PBS洗涤1次,加入Binding buffer 100 μL重悬细胞,每管加入5 μL Annexin V-FITC混匀后,避光室温反应10~15 min。检测前,加入10 μL PI staining solution,1 h内检测完毕。
2.6 Western blot检测KLF6及iNOS的表达细胞培养、分组和干预同“2.5”,另设体积比为0.3的PA上清液与培养基混合液,分别作用12、24 h,收集细胞,加入裂解液,冰上充分裂解,提取总蛋白。按BCA蛋白浓度测定试剂盒说明进行蛋白浓度测定,10% SDS-PAGE分离蛋白,用电转仪半干法转至硝酸纤维素膜上。加入1 ∶1 000稀释的β-actin一抗,1 ∶500稀释的KLF6一抗,1 ∶1 000稀释的iNOS一抗,4 ℃孵育过夜,TBST洗涤3次,每次10 min,再加入1 ∶10 000稀释的二抗孵育1.5 h。最后滴入超敏ECL显影并曝光。以目的蛋白与内参β-actin蛋白的条带灰度值之比表示各蛋白的相对表达水平,实验重复3次。
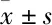
3 结果
3.1 PA上清液对RAW24.7细胞增殖的抑制作用Fig 1的MTT结果显示,在12、24 h时,与对照组相比,PA上清液组细胞增殖抑制率均明显增加(P<0.01)。不同浓度上清液组之间比较,细胞增殖抑制率随着浓度的增加而增加(P<0.01)。24 h不同浓度上清液组组与12 h组比较,细胞增殖抑制率随着时间的延长而增加(P<0.01)。说明PA上清液能明显抑制RAW264.7细胞的增殖,抑制效应呈浓度-时间依赖关系。
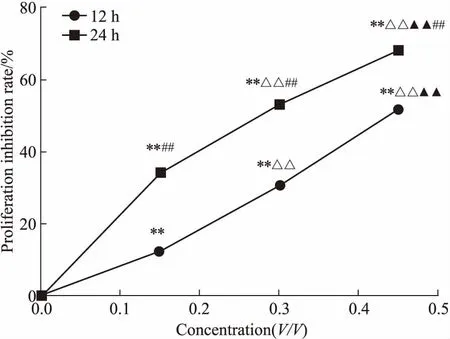
Fig 1 Effect of PA supernatant on proliferation inhibitory rate of RAW 264.7 n=3)
**P<0.01vscontrol;△△P<0.01vs0.15 group;▲▲P<0.01vs0.3 group;##P<0.01vs12 h group
3.2 PA作用RAW264.7细胞后的形态学变化经Hoechst 33342染色后,对照组RAW264.7细胞的细胞核呈蓝色圆形或椭圆形,染色体均匀一致;经不同体积浓度比的PA上清液处理RAW264.7细胞24 h后,细胞核固缩,深染,核内可见浓染致密的块状颗粒,这些细胞核形态变化均为细胞凋亡的表现,其中以0.45的PA上清液处理组最为明显,见Fig 2。
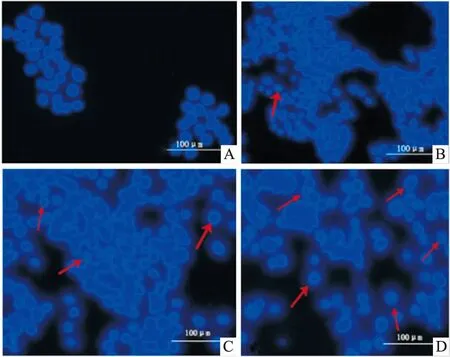
Fig 2 Effect of PA supernant on Cytation3 cell imaging multi-function detector of RAW264.7
A: Control;B: 0.15;C: 0.3;D: 0.45. Red arrow refers to apoptotic cells
3.3 PA诱导RAW264.7细胞凋亡Fig 3的流式细胞仪检测结果显示,RAW264.7细胞与不同浓度的PA上清液作用24 h后,与对照组相比,RAW264.7细胞的凋亡率随着PA上清液浓度的增高而增加(P<0.05),0.3浓度PA上清液组与0.15浓度PA上清液组比较,细胞凋亡率有明显增加(P<0.01)。与0.15、0.3浓度PA上清液组比较,0.45浓度PA上清液组细胞凋亡率均有明显增加(P<0.01)。提示PA上清液增加RAW264.7细胞凋亡比例呈浓度依赖性。
3.4 PA上清液促进RAW264.7细胞KLF6及iNOS的表达如Fig 4所示,与对照组相比,PA上清液组能够以浓度依赖性的方式增加KLF6蛋白表达(P<0.05),同时iNOS表达增加(P<0.01);与0.15浓度PA上清液组比较,0.3浓度PA上清液组KLF6表达增加(P<0.05),iNOS表达增加(P<0.01);与0.15、0.3浓度PA上清液组比较,0.45浓度PA上清液组KLF6表达增加(P<0.05),iNOS表达增加(P<0.01);尤以0.45浓度PA上清液组变化明显。如Fig 5所示,0.3浓度PA上清液组分别作用12、24 h后,与对照组相比,12 h组、24 h组KLF6、iNOS表达水平均明显增加(P<0.05,P<0.01),24 h组与12 h组比较,KLF6及iNOS表达增加,差异有统计学意义(P<0.01,P<0.05);以24 h实验组变化更为明显。
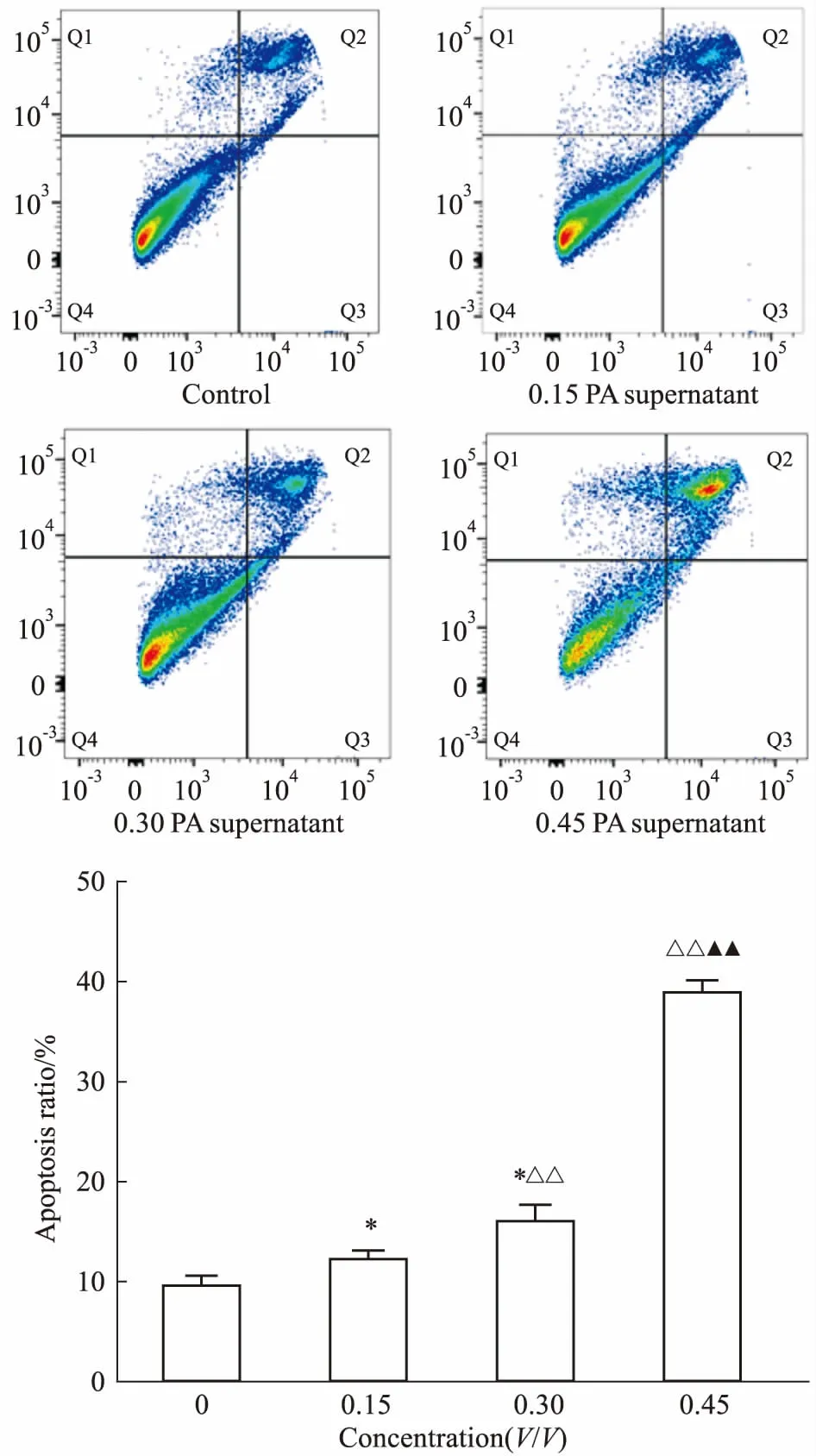
Fig 3 Effect of PA supernatant on apoptosis
*P<0.05vscontrol;△△P<0.01vs0.15 group;▲▲P<0.01vs0.3 group
4 讨论
PA是引起院内感染致死率较高的最主要病原体之一,PA的毒力因子能够抵消宿主防御,并且能对宿主组织造成直接损害或提高细菌的竞争力,诱导多种免疫细胞凋亡,导致机体发生急、慢性感染。
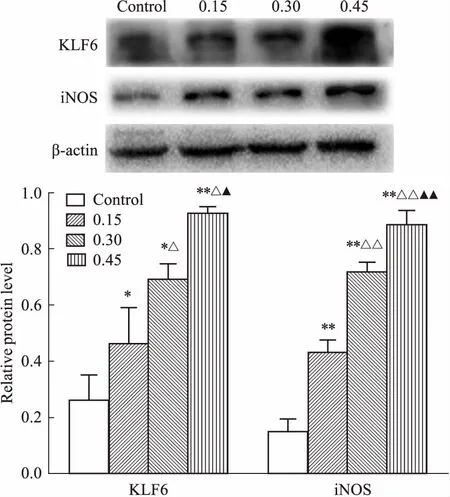
Fig 4 KLF6 and iNOS protein expression in RAW264.7 cells treated with different volume concentrations
*P<0.05,**P<0.01vscontrol;△P<0.05,△△P<0.01vs0.15 group;▲P<0.05,▲▲P<0.01vs0.3 group
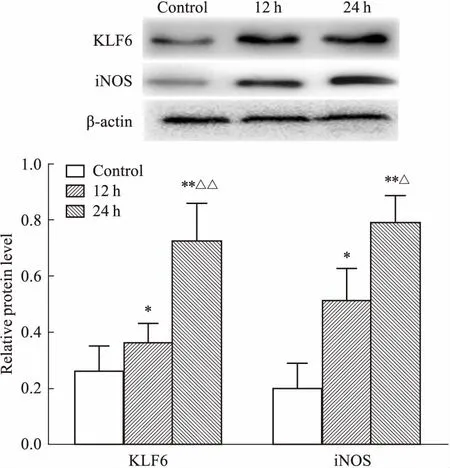
Fig 5 KLF6 and iNOS protein expression at different time in RAW264.7 cells treated with PA n=3)
*P<0.05,**P<0.01vscontrol;△P<0.05,△△P<0.01vs12 h group
加之近年来,由于PA对越来越多的抗生素产生耐药性,因此,研究PA对免疫细胞的作用机制对PA感染的治疗有重要作用。本研究结果显示,PA上清液能够明显抑制RAW264.7细胞的增殖,说明PA的致病机制可能是通过抑制机体的免疫细胞,从而抑制了机体的免疫反应,导致机体或局部的炎症反应持续存在,迁延不愈。
迄今为止,关于PA诱导细胞凋亡的分子机制有了广泛的研究。3种主流的细胞凋亡诱导途径相关的凋亡相关基因主要包括Fas配体(FasL)、Bax和Bcl-2。其中,FasL是一种能够与死亡受体Fas结合,并介导细胞毒性诱导的细胞凋亡的配体[9]。Bcl-2能够抑制细胞凋亡,然而,Bcl-2也通过线粒体途径诱导细胞凋亡[10]。Bax抑制Bcl-2活性,并拮抗其抗细胞凋亡作用[11]。但目前关于KLF6和iNOS在PA对巨噬细胞凋亡方面的研究甚少。
近年来,对于KLF6在炎症调节方面的作用研究较多。例如KLF6能够直接与iNOS启动子形成KLF6-DNA复合物,调控iNOS表达释放NO,破坏细胞的稳定性,发挥细胞毒作用,参与病毒感染诱导的炎症反应,下调上皮细胞中KLF6基因的表达后,iNOS表达减少,NO活性降低,减轻了气道高反应,并延缓了炎症的发展[12]。早在1994年,Kamijo等[13]就已经证实,巨噬细胞可通过iNOS表达的增加,激活NO的释放。Mgbemena等[12]及王春波等[14]的研究表明,iNOS可转录生成NO,促进细胞凋亡。由此推测,本实验结果中,KLF6和iNOS的表达水平同时增加是由于PA诱导增加了KLF6的表达,而iNOS表达的上调是由KLF6诱导的,同时,iNOS能够促进NO释放,从而参与细胞凋亡。这一途径形成了单核巨噬细胞生长抑制和细胞毒性作用的基础,促进巨噬细胞凋亡。
综上所述,PA上清液抑制了RAW264.7细胞增殖,诱导细胞凋亡,可能是由于PA刺激KLF6表达的增加,从而调控iNOS的表达,激活NO的释放,促进细胞凋亡。KLF6和iNOS可能共同参与了PA上清液诱导的RAW264.7细胞凋亡。然而,iNOS的表达是否依赖于KLF6的诱发,KLF6在PA上清液诱导RAW264.7细胞凋亡过程中是否起决定性作用,还有待于进一步研究。本研究为减轻PA感染引起的炎症反应提供了新的理论依据和研究方向。
(致谢:本实验在辽宁省锦州医科大学附属第一医院转化医学研究院完成,感谢各位老师和同学对实验的指导与帮助!)