芝麻酚调控乳腺癌细胞MCF-7增殖的机理初步研究
苏龙俊,罗冬平,丁雅芳,林荣霄,伍家发,徐正顺
乳腺癌是女性最常见的恶性肿瘤之一,我国乳腺癌发病率有逐年增高趋势,已位于女性癌症第二位,死亡率则平均每年上升6.9%,且发病年龄早于西方国家10~15 a,呈年轻化趋势[1]。研究表明乳腺癌发病与膳食密切相关,特别是饮食习惯[2-3],如膳食中抗氧化成分可能调节体内的氧化应激状态[4]。有研究发现膳食中抗氧化成分较多的人群患乳腺癌的风险较低[5]。
芝麻酚(3,4-亚甲二氧基苯酚,sesamol)是芝麻油主要的香气成分和品质稳定剂,具有很强的抑菌和抗氧化活性,是优良的无毒抗氧化剂[6-7]。芝麻酚可作为代谢调节剂,抑制动脉粥样硬化的进展,降低血浆胆固醇和三酰甘油水平[8-9],具有抗诱变[10]、抗损伤、抗衰老[11]和化学预防的作用[12]。最近,已经阐明了芝麻的多种生物学功能,例如抑制炎症和抗癌作用,芝麻酚在小鼠肠癌细胞中通过抑制COX-2转录抵抗炎症[13],芝麻酚可诱导肝癌细胞(HepG2)[14]、结肠癌细胞(HCT116)[15]、乳腺癌细胞(MCF-7、T47D)凋亡[16]。
芝麻酚影响乳腺癌细胞增殖的研究虽有少量报道,但其作用的分子机理尚不清楚。本文试图阐明芝麻酚抑制乳腺癌增殖的分子机理,为后续的进一步研究打下基础。
1 材料与方法
1.1 材料人乳腺癌MCF-7细胞购自中国科学院上海生命科学研究院细胞资源中心;芝麻酚(CAS:533-31-3,BC grade)购自生工生物工程(上海)股份有限公司,用DMSO配制;碘化丙啶、CCK8试剂盒购自碧云天生物技术有限公司;RT-PCR所用试剂购自江苏康为世纪生物科技有限公司;引物由生工生物工程(上海)股份有限公司合成。
1.2 细胞培养利用RPMI-1640培养液(含10%胎牛血清)培养乳腺癌MCF-7细胞, 37 ℃,CO2体积分数为5%。
1.3 细胞毒性检测采用CCK8比色法检测细胞毒性。取对数生长周期的MCF-7细胞,制成单细胞悬液,每孔100 μL(5 000个细胞)接种于96孔板,每组设3个复孔。实验组:添加不同浓度(0、20、50、100和200 μmol·L-1)芝麻酚,对照组:添加DMSO。培养48 h,换液后加入CKK8溶液10 μL,孵育1 h,以不加细胞只加培养液和CCK8为空白对照,在酶标仪上检测波长450 nm的吸光度(OD450 nm)。使用GraphPad Prism 5 计算IC50。
1.4 细胞增殖采用CCK8比色法检测细胞增殖情况。取对数生长周期的MCF-7细胞,制成单细胞悬液,每孔100 μL(2 000个细胞)接种于96孔板,每组设3个复孔。实验组:添加不同浓度芝麻酚(0、20、50、100和250 μmol·L-1),对照组:添加DMSO。分别于第1、2、3、4和5 d,换液后加入CKK8溶液10 μL,孵育1 h,以不加细胞只加培养液和CCK8为空白对照,在酶标仪上检测波长450 nm的吸光度(OD450 nm)。以吸收值为纵坐标,时间为横坐标绘制细胞生长曲线,并用SPSS 19.0 进行统计分析。
1.5 细胞周期检测采用PI单染色法检测细胞周期。按照上述方法进行MCF-7细胞接种,给予芝麻酚(50 μmol·L-1)处理后继续培养48 h,制成单细胞悬液,离心洗涤后加入PI(50 μg·L-1)溶液和 RNaseA(20 μL·mL-1),用200目尼龙膜过滤样品,选488 nm波长在流式细胞仪上检测并进行细胞周期的分析。
1.6 RT-qPCR检测利用Trizol试剂盒提取RNA,然后用逆转录试剂盒将RNA 逆转录为cDNA,利用SYBR-Green试剂进行qPCR反应,反应条件:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火1 min,72 ℃延伸1 min,40个循环。qPCR引物:p53上游:5’-ATTTGCGTGTGGAGTATTTGGATG-3’,p53下游:5’-CGCCCATGCAGGAACTGTTAC-3’;p21上游:5’-ATGGAACTTCGACTTTGTCACCG-3’,p21下游:5’-CCTGCCTCCTCCCAACTCATC-3’;GAPDH上游:5’-TGGCACCGTCAAGGCTGAGAAC-3’,GAPDH下游:5’-TGGTGGTGAAGACGCCAGTGGA-3’。
1.7 统计学方法所得数据采用SPSS 19.0统计软件处理,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 芝麻酚对乳腺癌细胞MCF-7的IC50采用不同浓度(0、20、50、100和200 μmol·L-1)芝麻酚处理MCF-7细胞,然后采用CCK8比色法检测细胞毒性。经GraphPad Prism 5 计算IC50为48.91 μmol·L-1。
2.2 芝麻酚对MCF-7细胞增殖的影响采用不同浓度的芝麻酚处理MCF-7细胞,然后通过CCK8试剂盒检测增殖程度。图1所示除20 μmol·L-1浓度之外,50、100和250 μmol·L-1的实验组与对照组相比,抑制程度均具有显著差异(P<0.05)。
2.3 芝麻酚对细胞周期的影响采用50 μmol·L-1芝麻酚处理细胞,然后用流式细胞仪检测细胞周期分布情况,如图2所示,与对照组相比,芝麻酚处理组的S期细胞比例显著减少(由32.00%降到18.30%),G0/G1期细胞显著增加(由34.10%升到50.90%),结果表明发生G1/S期阻滞。
2.4 芝麻酚对增殖相关基因表达的影响用50 μmol·L-1芝麻酚处理细胞48 h,然后利用RT-qPCR对G1/S期转换的调控基因(p53、p21)进行检测,经芝麻酚处理后,p53和p21的表达水平分别上调3.37和2.21倍(P<0.05)。见图3-4。
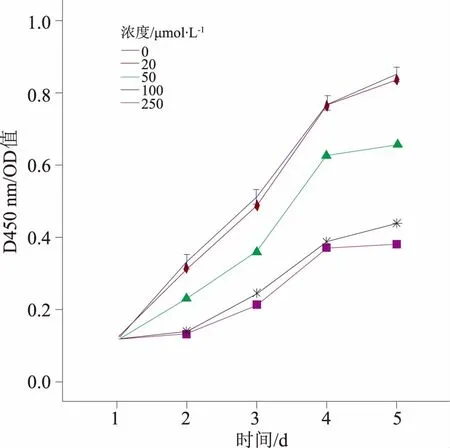
图1 芝麻酚对乳腺癌MCF-7细胞增殖的影响

图2 芝麻酚对乳腺癌MCF-7细胞周期的影响
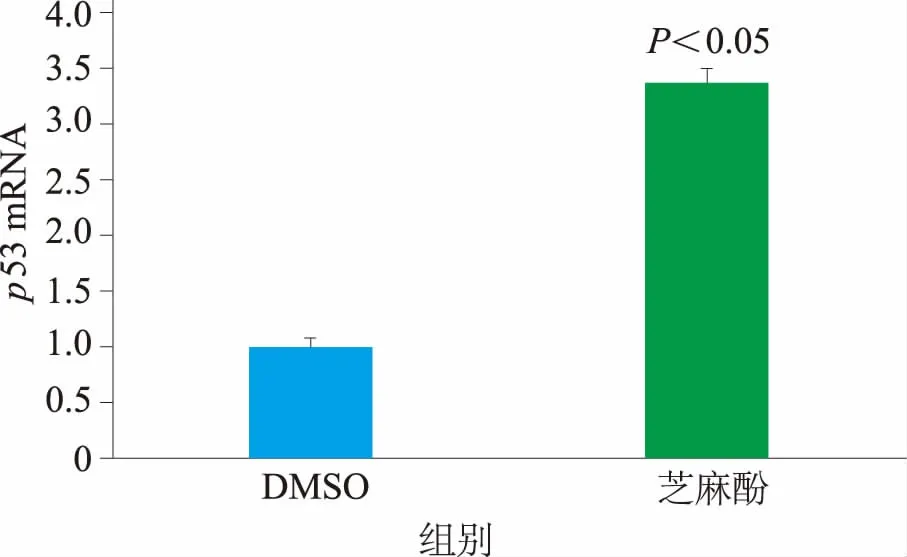
图3 芝麻酚对p53表达的影响

图4 芝麻酚对p21表达的影响
3 讨论
芝麻酚可以诱导多种肿瘤发生凋亡,如可以通过线粒体等信号途径诱导结肠癌[15]、皮肤癌[17]、肝癌[14,18]和肺癌[19]细胞发生凋亡。从图2可以看出,在芝麻酚的作用下,亚二倍体细胞数量显著增加,表明芝麻酚能够诱导MCF-7发生凋亡,但是其分子机理有待进一步研究。
芝麻酚还可以抑制乳腺癌[16]细胞的增殖,但其作用的分子机理尚不清楚。p53基因是重要的肿瘤抑制基因,在细胞周期调控中发挥重要作用,DNA损伤导致p53表达水平上升;p53诱导p21的表达,p21基因是Cip家族中的一员,主要对G1期CDKs起抑制作用,从而引发G1/S期阻滞,p53和p21共同构成细胞周期G1期检验点。p53同时激活DNA修复,如修复失败,p53引发细胞凋亡[20-21]。本研究发现,芝麻酚可以引发G1/S期阻滞,芝麻酚能够显著上调p53和p21表达,芝麻酚对G1/S期调控基因MYC和CCND1表达没有显著影响(结果未显示)。研究发现,芝麻酚的抗肿瘤活性可能与DNA的相互作用有关,芝麻酚能够与DNA的小沟相互作用并能够在细胞核中累积[14]。因此作者推测芝麻酚可能干扰DNA的复制和/或修复过程,进而激活G1期检验点,然后p53和p21表达水平上升,导致G1/S阻滞。
此外,芝麻酚的抗肿瘤活性可能与其强大的自由基清除能力有关[10-11]。活性氧(ROS)与肿瘤发生的关系目前仍存在争议,部分学者认为肿瘤细胞高水平活性氧启动分裂增殖、存活和代谢适应信号[22],如用抗氧化药物(如NAC或NADPH氧化酶抑制剂)减少细胞内活性氧水平可以抑制Kras诱导的成纤维细胞转化的促有丝分裂信号[23]。另一方面肿瘤细胞通过提高抗氧化能力,避免因严重氧化应激导致细胞死亡[24-25]。
除上述抗肿瘤活性外,芝麻酚还参与脂肪和糖代谢的调控过程[26-27],通过调节ERK、PI3K/AKT和JNK信号转导途径来抑制黑色素合成和酪氨酸酶表达[28],芝麻酚具有抵抗炎症的功效,在坏死性结肠炎中具有防护的作用[29]。 以上显示,芝麻酚具有潜在的药物开发价值。

